摘要:
化疗联合免疫治疗可改善一线非小细胞肺癌(NSCLC)晚期的治疗效果。我们设置两个组来研究非鳞状和鳞状NSCLC(nsqNSCLC/sqNSCLC)患者对PD-1抑制剂sintilimab(信迪利单抗)的安全性和疗效,并确定治疗反应后的潜在生物标志物。在1b期临床研究中设置两个组,nsqNSCLCs初次治疗患者,给予PD-1抑制剂sintilimab和化疗(D组),和sqNSCLC初次治疗治疗,然后进行只进行化疗(E组)。进行随访后,分析结果显示,Sintilimab(信迪利单抗)联合化疗在nsqNSCLC和sqNSCLC患者中表现出可控的毒性和抗肿瘤活性,且PD-L1表达和肿瘤突变负荷值与治疗效果改善均无显著相关性。

背景:肺癌是全世界癌症相关死亡率的主要原因,非小细胞肺癌(NSCLC)占诊断肺癌病例的85%,并且约70%的NSCLC患者为非鳞癌。铂化疗是缺乏靶向突变的1L晚期NSCLC患者的标准治疗,然而,总的临床结果并不理想,这使得化疗与免疫治疗相结合的治疗方法成为可能。pembrolizumab(派姆单抗)结合基于铂的化疗表现了良好的抗肿瘤活性以及对1L晚期NSCLC患者有可控的毒性。PD-L1是一个潜在的生物标志物,可以预测PD-L1肿瘤比例评分的1L转移的NSCLC患者对pembrolizumab单药治疗的反应。然而,nivolumab(纳武利尤单抗)的结果并不一致,PD-1抑制剂(pembrolizumab或nivolumab)联合化疗治疗NSCLC患者1L组,治疗效果与PD-L1表达无明显相关性。肿瘤突变负荷(TMB)已成为一种新的生物标志物来识别患者进行免疫治疗,在pembrolizumab或nivolumab单药治疗环境下,TMB水平较高的NSCLC患者表现出更好的反应和生存获益,然而,这些PD-1抑制剂加化疗作为1L治疗的联合设置结果存在差异。T细胞受体(TCR)在抗原识别中起重要作用,其主要可变区为互补决定区3 (CDR3),TCR多样性和克隆性可以用来提示免疫检查点抑制剂(ICPi)治疗患者的临床结果。Sintilimab是一种高度选择性的抗PD-1抗体,与pembrolizumab和nivolumab相比,其与人PD-1的结合亲和力更高。
结果:
设计D、E两个组来初步评估sintilimab单抗-化疗对nsq/sqNSCLC患者的有效性和安全性。D组患者每3周接受多达4个周期的信迪利单抗(sintilimab)联合培美曲塞和顺铂治疗,E组中,患者每3周接受多达6个周期的信迪利单抗(sintilimab)联合吉西他滨和顺铂,联合治疗后,患者每隔3周接受先前剂量的sintilimab维持治疗,并在D组中使用Sintilimab加培美曲塞,在E组中使用sintilimab单药。对患者会进行随访观察,并采样提取RNA使用艾沐蒽生物科技公司的ImmuHub高通量测序TCR分析系统做深度分析。
1.疗效在D组中,19位患者中,13位(68.4%)达到PR,3位(15.8%)达到SD,3位患者发展为PD(15.8%)。
在E组中,17位患者中,11位(64.7%)达到PR,6位(35.3%)达到SD,并且没有患者发展为PD。
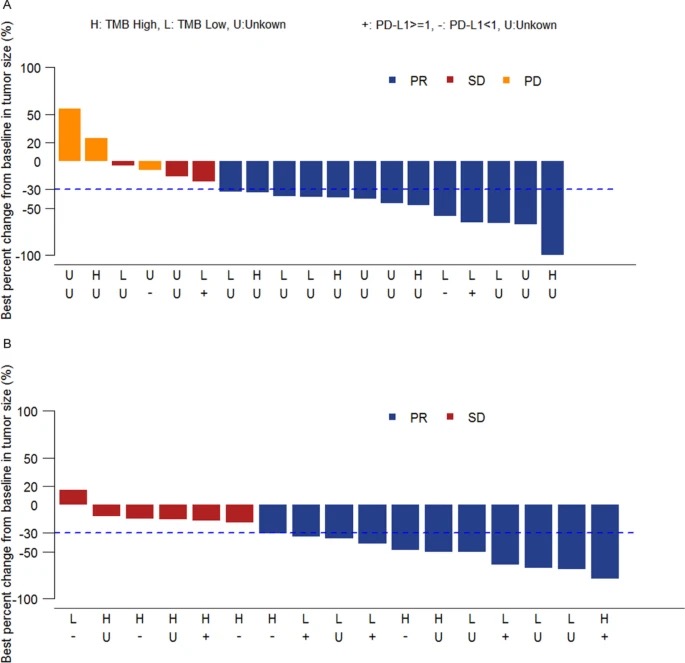
PR为部分缓解,SD为病情稳定,PD为疾病进展
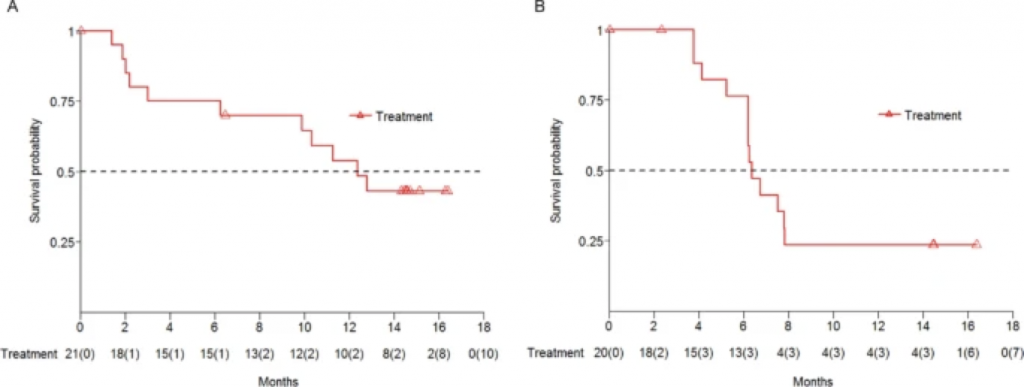
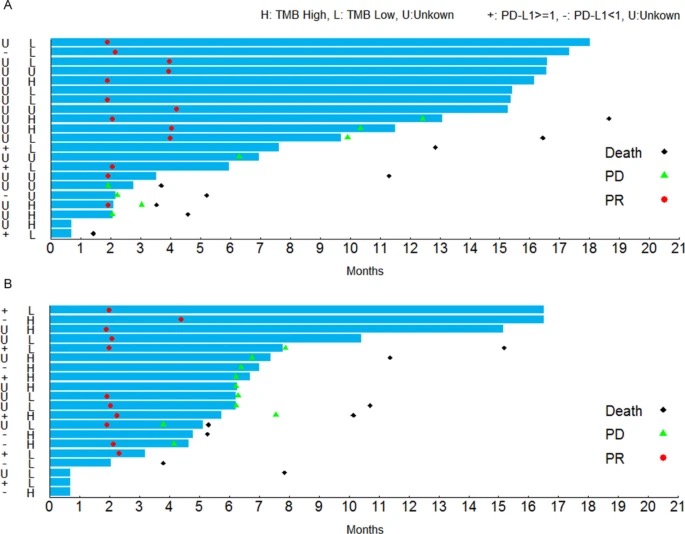
D组的中位PFS(无进展生存期)为12.6个月,而在6个月和12个月时的PFS率为75.0%和54.0%。E组的中位PFS为6.5个月,在6个月的PFS率是76.0%,在12个月的为24.0%。
2.PD-L1表达与反应之间的相关性
D组中,可评估PD-L1表达水平的5位患者中有3位患者高表达,2位患者低表达(图3),对比发现,肿瘤反应与PD-L1表达无显著相关性。在E组中,12位可评估的患者中,有6例肿瘤PD-L1高表达(TPS≥1%),6例低表达,同样,在肿瘤反应与PD-L1表达之间也未观察到显著相关性。
3.肿瘤突变负荷(TMB)与反应之间的相关性
D组的TMB-H组6位患者的 ORR(客观缓解率)为83.3%,TMB-L组(TMB <4.25)7例ORR为71.4%(图 3A),在这组中,TMB高的患者没有显示出比TMB低的患者显着更好的反应(P > 0.05)。在E组中,TMB-H(TMB≥4.25)组的患者12例,TMB-L(TMB <4.25)组的患者8例,ORR分别为54.5%和83.3%(图 3B),TMB高的患者也没有表现出比TMB低的患者更好的反应。
4.TCR测序分析
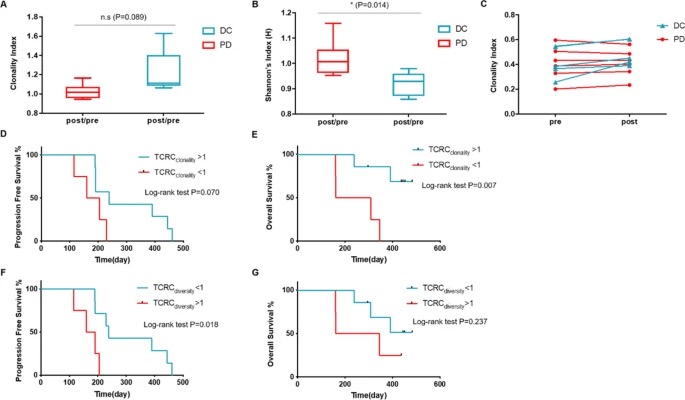
两组中的11例患者进行TCR相关性分析,已进展且退出研究的患者为PD组,其余患者分为疾病控制DC组。在DC组中,治疗前后TCR克隆性指标比率更高,与PD组相比,统计学上无显著差异。在多样性指标上(治疗前后比率),与PD组相比,DC组显著性更低。TCR克隆性在治疗后比治疗前有增加的趋势,而PD组中表现为大致稳定的变化趋势。
为了更好地反映治疗效果与TCR变化趋势之间的关系,我们使用TCRC克隆性或TCRC多样性为1作为截止值,发现高TCRC克隆性与总生存期OS改善显著相关(图 4E); 另外,低的TCRC多样性与延长的PFS明显相关(图 4)。
讨论:研究中,Sintilimab-chemo比nivolumab-chemo的反应有所增强,D组ORR为68.4%,E组ORR为64.7%。研究表明nsqNSCLC和sqNSCLC的患者中PD-L1表达与对sintilimab-chemo的反应之间无显着相关性,这与一项3期研究中的结果表现一致[2]。免疫-化学疗法策略还显示出改善的长期生存获益,1L nivolumab-chemo(派姆单抗结合基于铂的化疗PT-DC)对晚期NSCLC患者表现出有望的生存获益,中位PFS为4.8-7.1个月,中位OS为11.6至19.2个月,这比之前的数据都更长[3]。对于以前未经治疗的,缺乏EGFR或ALK突变的nsqNSCLC转移患者,与单独化疗相比,Pembrolizumab-chemo(pemetrexed + cisplatin / carboplatin)显著延长了中位PFS (8.8 m vs. 4.9 m)[2]。我们的结果表明,sintilimab-chemo可以改善长期生存率,其中nsqNSCLC患者的中位PFS估计为12.6个月,sqNSCLC患者的中位PFS为6.5个月。对抗PD-1 / PD-L1方案的反应后,机体有望产生新抗原特异性T细胞的克隆扩增[4]。TCR库克隆性增加与高密度的三级淋巴结构B细胞相关,这是非小细胞肺癌OS升高的生物标志[ 5]。在治疗前,高TCR多样性表明更好的免疫状态,其机制是高多样性可以通过增加更多潜在的肿瘤特异性T细胞来阻止免疫逃逸的程度,从而可以控制肿瘤细胞的生长并识别相应的抗原[6]。在我们的研究中,更高的TCRC克隆性(治疗后TCR克隆性的提高)或较低的TCRC多样性(治疗前的TCR多样性较高)与信迪利单抗化疗OS或PFS延长获益显著相关。但是,还需要进一步的证据来支持将这些指标作为PD-1抑制剂和化疗联合策略的有效预测指标的潜在用途。缩略词参考:
部分缓解:Partial Response(PR)病情稳定:stable disease(SD)疾病进展:progressive disease(PD)客观缓解率:Objective Response Rate(ORR)肿瘤突变负荷:Tumor mutation burden(TMB)总生存期:Overall Survival(OS)无进展生存期:Progression-free survival(PFS)
参考文献
Jiang, H., Zheng, Y., Qian, J. et al. Efficacy and safety of sintilimab in combination with chemotherapy in previously untreated advanced or metastatic nonsquamous or squamous NSCLC: two cohorts of an open-label, phase 1b study. Cancer Immunol Immunother (2020).
