Seq-MRD®获得欧盟CE资质(注册号:DE/CA20/01-IVD-Luxuslebenswelt-190/22),此次获批的是人淋巴B细胞微小残留病基因检测试剂盒(可逆末端终止测序法)。

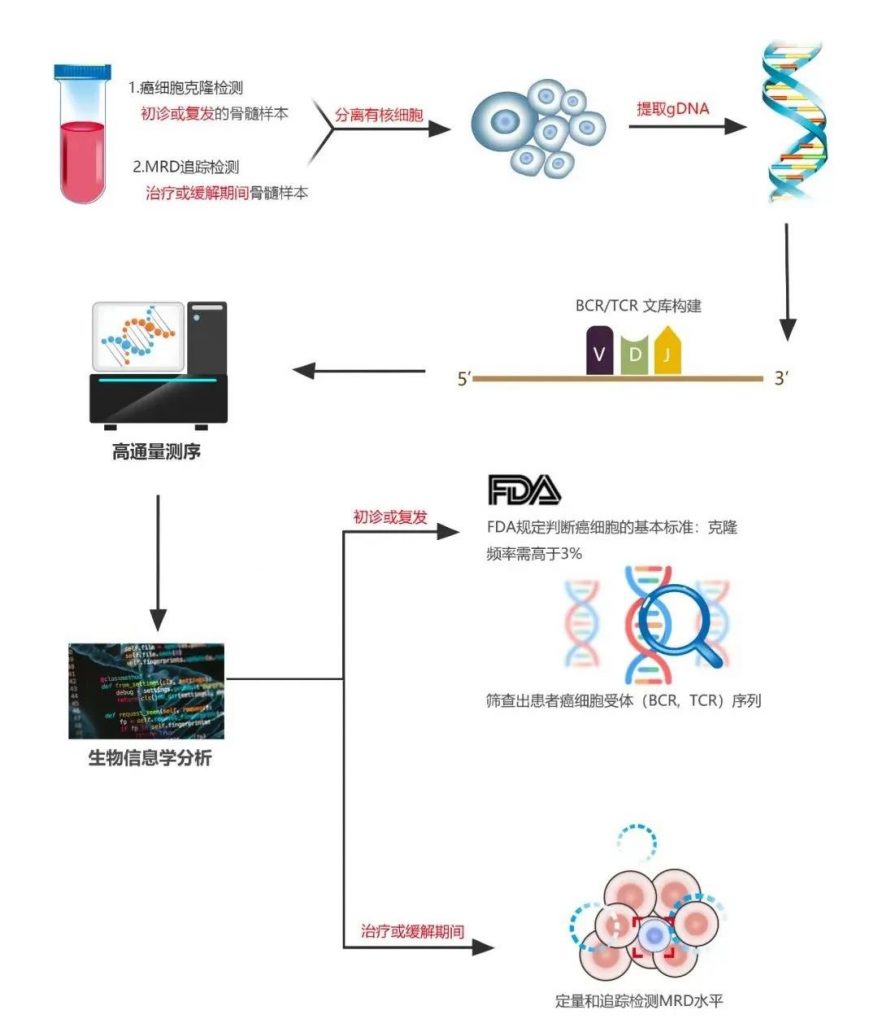
Seq-MRD®以新一代高通量测序(NGS)平台为基础,通过特异性检测T或B淋巴细胞的T细胞受体(TCR)TRB/TRG基因或B细胞受体(BCR)IgH/K/L基因的CDR3区域序列,筛选出患者体内肿瘤细胞显著而特异性的克隆重排形式,可在治疗后对这些肿瘤细胞进行跟踪,即进行MRD的检测,从而为癌症幸存者后续治疗方案提供参考。适用于B系白血病(B-ALL/CLL)、多发性骨髓瘤(MM)和T系白血病(T-ALL)患者等。
Seq-MRD®检测优势如下:
01、灵敏度高
灵敏度高达10-6,传统的流式细胞仪(FC)技术灵敏度10-4,相比灵敏度可提高100倍,能够更好地满足临床对血癌患者的精准治疗需求。有研究表明流式MRD阴性患者仍有近20%的复发率,而NGS-MRD阴性复发率0%,大大提高了患者的生存率[1]。
02、特异性高
基于Ig/TCR基因重排检测,可避免由新的抗体靶向治疗方式和癌细胞突变所引起的检测误差,因为上述情况会改变用于鉴定MRD的标志物的表达,从而导致假阴性结果。
03、追踪新克隆
可以发现克隆演变,并能对新出现的克隆进行追踪,给予患者更可靠的检测结果。
04、增加Seq-SHM®功能
针对B型克隆性检测中可以分析IGHV突变,IGHV突变比例>2%预后较好,≤2%预后较差。可靠的突变评估结果可以指导临床医生对患者采取个性化治疗方案。
Seq-MRD®检测相关阅读:Seq-MRD®检测CAR-T治疗血液肿瘤MRD临床试验解读
参考文献:Pulsipher, M. A. et al.IgH-V(D)J NGS-MRD measurement pre- and early post-allotransplant defines verylow- and very high-risk ALL patients. Blood125, 3501-3508,doi:10.1182/blood-2014-12-615757 (2015).
关于CE
CE标志(CE Marking)是按照法规要求,部分产品在部分欧洲国家上市时,必须带有的产品安全标志。带有CE标志的产品意味着产品符合欧盟相关产品法规基本/通用要求,适于预期用途,可以在要求CE标志的国家自由流通。
关于艾沐蒽
杭州艾沐蒽生物科技有限公司由美国芝加哥大学科研团队回国创办,是一家专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展的国家高新技术企业。艾沐蒽站在适应性免疫系统研究的前沿,自主研发的免疫医学平台可揭示和翻译适应性免疫系统的遗传密码,并能应用于癌症、自身免疫性疾病、传染性疾病等免疫介导性疾病的诊断、监测和治疗中。
