多发性骨髓瘤(MM)是一种浆细胞恶性肿瘤,目前的治疗手段四联疗法(抗 CD38 mAb+PI+IMiDs+dex)+自体干细胞移植(ASCT)能够显著提高新诊断的多发性骨髓瘤(NDMM)患者的缓解深度和持续时间。但是NDMM在生物学、表现和治疗反应上存在异质性,目前的治疗标准对某些患者可能不足,而对另一些患者可能过度。因此,需要开发精确的方法来检测残留疾病并理解治疗反应。
MRD已被证明是无进展生存期(PFS)和总生存期(OS)最重要的动态预后标志物之一,美国肿瘤药物咨询委员会 (ODAC)也建议将MRD作为加速 FDA 药物批准的终点。基于高通量测序(NGS)的MRD检测方法具有很高灵敏度(10-6),且能够提供对肿瘤负荷(浆细胞克隆)的直接估计,为准确描述治疗手段的增量益处提供了机会。
ASCT是符合移植条件的NDMM患者的主要巩固策略,但它具有短期和长期毒性。发表于Blood Cancer Journal杂志的一篇研究通过NGS方法检测NDMM患者ASCT前后的MRD水平,来评估独立于诱导治疗的ASCT效应,为开发TCR-T疗法作为ASCT的替代或辅助巩固策略提供了基准。


研究者收集了330名NDMM患者在诱导治疗后和ASCT后的NGS MRD状态。患者分为接受四联(PI+IMiD+dex+抗CD38单克隆抗体)和三联(PI+IMiD+dex)诱导治疗的两组。研究分析了MRD在10^-5和10^-6阈值下的阴性率以及定量疾病负担,并根据诱导治疗类型和细胞遗传学亚组进行了分析报告。

在接受四联诱导治疗的279名(85%)患者中,诱导治疗后MRD-5的患者比例为29%(MRD-6比例为15%),ASCT后这一比例增加到59%(MRD-6比例增加到45%)(图1A)。在诱导治疗后MRD>10-5的患者中,ASCT使其中68.5%的患者的MRD负担降低了至少1个对数级(图1C)。对于四联疗法诱导后疾病负担较高的患者(MRD≥10−3),通过ASCT转换为MRD−5的可能性较低,20%的患者成功转换为MRD−5,17%患者成功转换为MRD−6(图1A)。
在51例(15%)接受三联疗法的患者中,诱导治疗后MRD-5的患者比例为16%(MRD-6比例为4%),ASCT后这一比例增加到41%(MRD-6比例增加到24%)(图1B)。在诱导治疗后MRD≥10−5的患者中,ASCT使其中55.8%患者的MRD负荷降低了至少1个对数级(图1C)。无论是四联诱导治疗还是三联治疗,ASCT对MRD负担的降低程度是相似的。
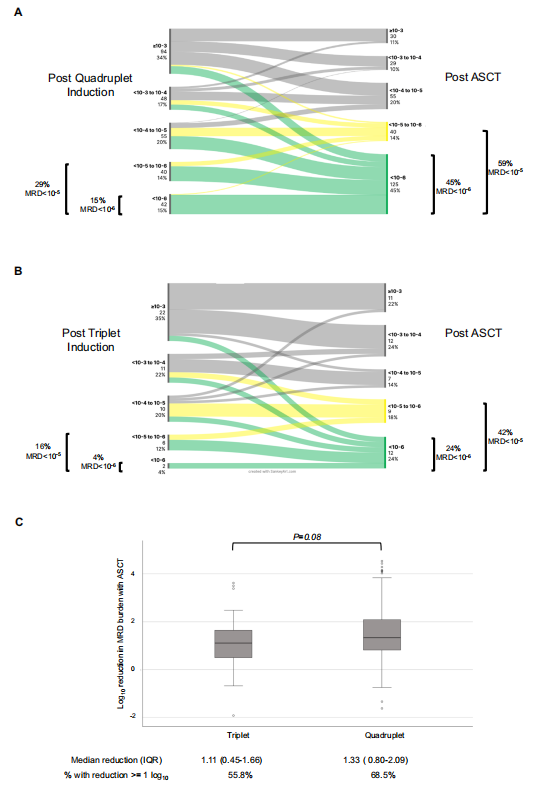
图1
在270例有基线细胞遗传学信息的接受四联疗法的患者中,36%的患者有1个高风险细胞遗传学异常(HRCA),15%患者有2+HRCA。在四联诱导治疗后,0、1、2+HRCA患者MRD−5的比例分别为19%、31%和28%,ASCT后比例提高至53%、66%和65%。MRD−6的比例由诱导治疗后的17%、14%和10%提高至ASCT后的41%、50%、48%(图2)。
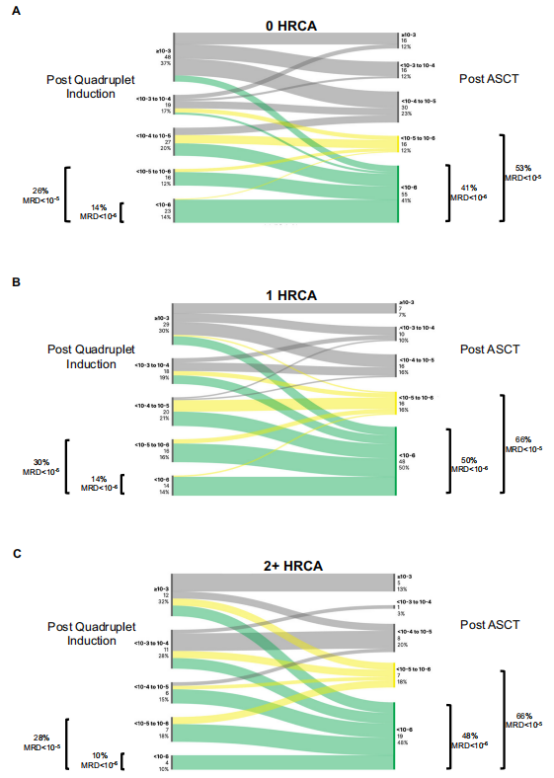
图2
在所有诱导治疗后MRD≥10−5的患者中,ASCT使0、1和2+ HRCA的患者MRD负荷降低1个对数级以上的比例分别为60%、72%和81%。接受四联诱导治疗的患者亚组也观察到了类似的结果(图3)。超高危MM(2+HRCA)患者接受ASCT后,疾病负担减轻最大(图2和3)。
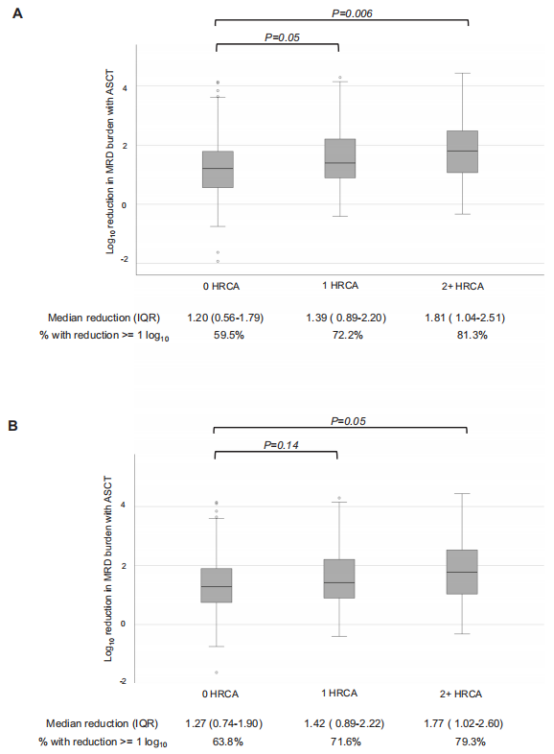
图3
四联诱导治疗后,相当一部分患者能够达到较低的MRD水平,但ASCT仍然能够进一步降低MRD负担,表明ASCT在降低MRD方面具有额外的价值,尤其是在高风险细胞遗传学异常的患者中。在将MRD用作加速药物批准的终点的新环境中,该研究为评估新型治疗策略如TCR-T疗法提供了精细的特定于分层的基准。
参考文献:
Bal S, et,al. Establishing measurable residual disease trajectories for patients on treatment for newly diagnosed multiple myeloma as benchmark for deployment of T-cell redirection therapy. Blood Cancer J. 2025 Apr 23;15(1):73. doi: 10.1038/s41408-025-01252-6.

艾沐蒽专注于免疫组二代测序领域多年,是全国首家推出血液肿瘤NGS MRD检测产品Seq-MRD®的公司。Seq-MRD®适用于B/T系白血病、B/T系淋巴瘤、多发性骨髓瘤,能够帮助临床医生预测长期疗效、评估治疗效果、监测缓解状态以及监测早期复发。经过多年的积累和发展,Seq-MRD®在临床检测和科学研究上均取得不少成果,并获得国际市场认可。
获得欧盟CE资质认证
Seq-MRD®获得欧盟CE资质(注册号:DE/CA20/01-IVD-Luxuslebenswelt-190/22),获批的是人淋巴B细胞微小残留病基因检测试剂盒(可逆末端终止测序法)。

获得三项发明专利
艾沐蒽推出的Seq-MRD®血液癌症MRD检测是最早批实现商业化的产品,自2016年研发专利技术至今,艾沐蒽Seq-MRD®已经获得3项国家发明专利:
[1]“一种应用于高通量测序检测T细胞白血病微小残留病的引物组合及试剂盒”(专 利 号: 2016 11204857.0,授权公告号:CN 106957906 B)
[2]“一种检测微小残留病MRD的试剂盒”(专 利 号: 2018 1 1550133.0,授权公告号: CN 109652518 B)
[3]“一种检测微小残留病MRD的方法”(专 利 号: 2018 1 1549203.0,授权公告号: CN 109680062 B)

获得相关软件著作
[1]“免疫组库MRD检测自动化报告系统[简称ImmuReport] V1.0”(登记号:2019SR0916207)
[2]“Seq-MRD检测自动化分析系统(DiscTermite)[简称:DiscTermite]0.4.6“(登记号:2019SR1131517)
[3]“基于免疫组库二代测序的微小残留病(MRD)检测数据处理系统”(登记号:2020SR0507594)

获得荣誉证书
1、艾沐蒽联合浙大附一黄河教授完成的《新型CAR-T细胞研发及其治疗恶性血液病临床转化创新体系建立》获2023年度浙江省科学技术进步奖一等奖。Seq-MRD®在该技术的创新与应用中起到了关键性作用。

2、艾沐蒽申报的“免疫组TCR/Ig高通量测序技术/血液肿瘤微小残留病(MRD)检测/Seq-MRD®”因其创新性、前沿性、市场实用性荣获“2022年度CCTB中国肿瘤标志物产业创新大会创新技术/产品评选”项目二等奖。

2023年获批了【全血/骨髓基因组DNA提取试剂盒】(离心吸附柱法)备案编号:浙杭械备20230798 ,试剂盒分别适用于人外周血、骨髓样本的核酸的提取。
发表相关文献
Seq-MRD®发表相关文献
1、Huang Y, Zhao H, Shao M, Zhou L, Li X, Wei G, Wu W, Cui J, Chang AH, Sun T, Hu Y, Huang H. Predictive value of next-generation sequencing-based minimal residual disease after CAR-T cell therapy. Bone Marrow Transplant. 2022 Jun 1. doi: 10.1038/s41409-022-01699-2. Epub ahead of print. PMID: 35650329.(点击链接可查看文章内容)

2、Chen H, Gu M, Liang J, Song H, Zhang J, Xu W, Zhao F, Shen D, Shen H, Liao C, Tang Y, Xu X. Minimal residual disease detection by next-generation sequencing of different immunoglobulin gene rearrangements in pediatric B-ALL. Nat Commun. 2023 Nov 17;14(1):7468. doi: 10.1038/s41467-023-43171-9. (点击链接可查看文章内容)

3、Min’er Gu,Yahong Xia, Jingying Zhang, Yongmin Tang, Weiqun Xu, Hua Song Xiaojun Xu. The effectiveness of blinatumomab in clearing measurable residual disease in pediatric B-cell acute lymphoblastic leukemia patients detected by next-generation sequencing. Cancer Med. 2023 Dec;12(24):21978-21984. doi:10.1002/cam4.6771. (点击链接可查看文章内容)

4、Yan N, Wang ZL, Wang XJ, et,al. Measurable residual disease testing by next generation sequencing is more accurate compared with multiparameter flow cytometry in adults with B-cell acute lymphoblastic leukemia. Cancer Lett. 2024 Jul 4;598:217104. doi: 10.1016/j.canlet.2024.217104.

获得国际市场认可
2023年DelveInsight公司发布的MRD国际市场研究报告中,艾沐蒽/Seq-MRD®是中国唯一一家公司/产品进入国际调研市场报告。DelveInsight是一家领先的医疗保健市场研究和商业咨询公司,以其现成的联合市场研究报告以及为医疗保健行业的公司提供的定制解决方案而闻名。

杭州艾沐蒽生物科技有限公司成立于2016年,是国际前沿的专注于免疫驱动医学技术的国家高新技术企业和专精特新企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组基因高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® 免疫力测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®肿瘤早筛、单细胞测序、TCR-T和抗体发现等平台管线。目前为止发表了数十篇论文,其中包括:The New England Journal of Medicine(IF:158.5), Nature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24), Nature Communications (IF:17)等多篇高分杂志。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。


