ињСеєіжЭ•пЉМеЕНзЦЂж£АжЯ•зВєжКСеИґеЙВпЉИICIsпЉЙе¶ВеЄХеНЪеИ©зП†еНХжКЧпЉИpembrolizumabпЉЙеЈ≤жИРдЄЇе§ЪзІНзЩМзЧЗзЪДйЗНи¶Бж≤їзЦЧжЙЛжЃµгАВзДґиАМпЉМеНХзЛђдљњзФ®ињЩдЇЫиНѓзЙ©зЪДжХИжЮЬеЬ®иЃЄе§ЪжВ£иАЕдЄ≠еєґдЄНзРЖжГ≥гАВдЄЇдЇЖеЕЛжЬНињЩдЄАжМСжИШпЉМз†Фз©ґдЇЇеСШеЉАеІЛжΥ糥е∞Же±АйГ®жФЊе∞Дж≤їзЦЧпЉИе¶ВSBRTпЉЙдЄОеЕНзЦЂж≤їзЦЧзЫЄзїУеРИзЪДжЦ∞жЦєж≥ХгАВжЬђжЬЯеИЖдЇЂдЄАзѓЗеПСи°®дЇОгАКnature cancerгАЛпЉИIF:28.5пЉЙзЪДз†Фз©ґгАВиѓ•з†Фз©ґжОҐиЃ®дЇЖзЂЛдљУеЃЪеРСдљУйГ®жФЊзЦЧ(SBRT)иБФеРИеЕНзЦЂж£АжЯ•зВєжКСеИґеЄХеНЪеИ©зП†еНХжКЧеЬ®иљђзІїжАІйЭЮе∞ПзїЖиГЮиВЇзЩМ(NSCLC)жВ£иАЕдЄ≠зЪДз≥їзїЯжАІеЕНзЦЂи∞ГиКВжХИеЇФпЉМзЙєеИЂжШѓйТИеѓє”еЕНзЦЂеЖЈеЮЛ”иВњзШ§(еЃЪдєЙдЄЇдљОиВњзШ§з™БеПШиіЯиНЈ[TMB]гАБPD-L1йШіжАІи°®иЊЊжИЦWntйАЪиЈѓз™БеПШ)гАВ

жФЊзЦЧиБФеРИеЕНзЦЂж≤їзЦЧйЗНе°СиВњзШ§еЕНзЦЂеЊЃзОѓеҐГ
з†Фз©ґеЫҐйШЯеБЗиЃЊжФЊзЦЧиБФеРИеЕНзЦЂж≤їзЦЧзЪДдЄіеЇКеПНеЇФдЉЪеЬ®дЄНеРМиВњзШ§з™БеПШиіЯиНЈпЉИTMBпЉЙеТМPD-L1и°®иЊЊж∞іеє≥зЪДжВ£иАЕдЄ≠жЩЃйБНе≠ШеЬ®гАВеЫ†ж≠§пЉМдїЦдїђиѓДдЉ∞дЇЖињЩдЇЫзФЯзЙ©ж†ЗењЧзЙ©пЉИзФ®дЇОжМЗз§Ї”еЕНзЦЂзГ≠еЮЛ”иВњзШ§пЉЙеЬ®зЂЛдљУеЃЪеРСжФЊе∞Дж≤їзЦЧпЉИSBRTпЉЙзїДеТМеѓєзЕІзїДдЄ≠дЄОдЄіеЇКзЦЧжХИзЪДеЈЃеЉВзЫЄеЕ≥жАІгАВзїУжЮЬеПСзО∞пЉЪ
-
SBRTзїДдЄ≠пЉМKRASеЕ±з™БеПШеПКSTK11иЗізЩМз™БеПШеЭЗдЄОж≤їзЦЧеПНеЇФжЧ†жШЊиСЧеЕ≥иБФпЉМдљЖеЬ®еѓєзЕІзїДдЄ≠пЉМKRAS-TP53еЕ±з™БеПШеЬ®еЇФз≠ФиВњзШ§дЄ≠жШЊиСЧеѓМйЫЖгАВж≠§е§ЦпЉМWnt-ќ≤-cateninйАЪиЈѓеЯЇеЫ†з™БеПШйҐСзОЗеЬ®SBRTзїДеЇФз≠ФиВњзШ§дЄ≠жЫійЂШпЉМжПРз§ЇSBRTеПѓиГљжњАжіїдЇЖжЦ∞зЪДеЕНзЦЂиЈѓеЊДгАВ
-
жФЊзЦЧжШЊиСЧдЄКи∞ГдЇЖйЭЮзЕІе∞ДиВњзШ§йГ®дљНзЪДеє≤жЙ∞зі†дњ°еПЈйАЪиЈѓпЉИIFNќ≥/IFNќ±пЉЙгАБжКЧеОЯеСИйАТгАБNKзїЖиГЮжѓТжАІеТМBзїЖиГЮеПЧдљУдњ°еПЈз≠ЙеЕНзЦЂзЫЄеЕ≥йАЪиЈѓпЉМеРМжЧґдЄЛи∞ГдЇЖзїЖиГЮеС®жЬЯгАБDNAдњЃе§НеТМдї£и∞ҐзЫЄеЕ≥йАЪиЈѓгАВж≠§е§ЦпЉМеЬ®SBRTзїДиІВеѓЯеИ∞CD8+ TзїЖиГЮеТМM1еЈ®еЩђзїЖиГЮзЪДжШЊиСЧеҐЮеК†пЉМдї•еПКжіїеМЦCD4иЃ∞ењЖTзїЖиГЮеТМNKзїЖиГЮзЪДеҐЮеК†иґЛеКњпЉМиАМеѓєзЕІзїДжЬ™иІБз±їдЉЉеПШеМЦгАВ
з†Фз©ґз≥їзїЯиѓДдЉ∞дЇЖSBRTиБФеРИеЕНзЦЂж≤їзЦЧеЬ®еЕНзЦЂвАЬеЖЈиВњзШ§вАЭжВ£иАЕдЄ≠зЪДзЦЧжХИпЉМзїУжЮЬеПСзО∞пЉЪ
-
еИЖе≠РзЙєеЊБдЄОеЕНзЦЂжњАжіїпЉЪз†Фз©ґеПСзО∞йХњжЬЯзФЯе≠ШжВ£иАЕеЬ®ж≤їзЦЧеЙНеН≥и°®зО∞еЗЇеє≤жЙ∞зі†дњ°еПЈйАЪиЈѓзЪДжШЊиСЧжњАжіїзЙєеЊБпЉМзЙєеИЂжШѓIFNќ≥еТМIFNќ±йАЪиЈѓзЪДжіїеМЦпЉМињЩдЄАзЙєеЊБеПѓдљЬдЄЇжљЬеЬ®зЪДзЦЧжХИйҐДжµЛж†ЗењЧзЙ©гАВж≠§е§ЦпЉМеЬ®ж≤їзЦЧињЗз®ЛдЄ≠пЉМиІВеѓЯеИ∞жЫіеєњж≥ЫзЪДеЕНзЦЂйАЪ裃襀жњАжіїдї•еПКжШЊиСЧдЄКи∞ГдЄЙзЇІжЈЛеЈізїУжЮДпЉИTLSпЉЙеЯЇеЫ†зЙєеЊБгАВ
-
иВњзШ§зФЯзЙ©е≠¶иљђеПШпЉЪдїОиВњзШ§зФЯзЙ©е≠¶иІТеЇ¶жЭ•зЬЛпЉМж≤їзЦЧжИРеКЯйАЖиљђдЇЖиВњзШ§зЪДйЂШеҐЮжЃЦи°®еЮЛпЉМи°®зО∞дЄЇE2FйЭґеЯЇеЫ†зЪДжШЊиСЧдЄЛи∞ГгАВеРМжЧґпЉМиВњзШ§зїЖиГЮзЪДDNAдњЃе§НиГљеКЫжШОжШЊеЗПеЉ±гАВиѓБеЃЮдЇЖжФЊзЦЧиѓ±еѓЉзЪД“еЖЈиВњзШ§еРСзГ≠иВњзШ§иљђеМЦ”пЉИcold-to-hot conversionпЉЙзО∞и±°гАВ
-
дЄіеЇКиОЈзЫКй™МиѓБпЉЪељ±еГПе≠¶зїУжЮЬжШЊз§ЇSBRTзїДйЭЮзЕІе∞ДзЧЕзБґжШЊиСЧзЉ©е∞ПпЉИеє≥еЭЗзЫіеЊД45.52вЖТ30.44mmпЉМP=0.05пЉЙпЉМиАМеѓєзЕІзїДжЧ†жШЊиСЧеПШеМЦгАВдЄФдЄНеРМеЕНзЦЂеЖЈеЮЛиВњзШ§дЇЪзїДеЭЗжШЊз§ЇеЗЇжШОжШЊзЪДдЄіеЇКиОЈзЫКпЉЪTMBдљОзЪДжВ£иАЕжЧ†ињЫе±ХзФЯе≠ШжЬЯпЉИPFSпЉЙеїґйХњиЗ≥5.21дЄ™жЬИпЉМжШѓеѓєзЕІзїД1.81дЄ™жЬИзЪД2.9еАНпЉИP=0.029пЉЙпЉЫиАМеЕЈжЬЙWntз™БеПШзЪДжВ£иАЕжАїзФЯе≠ШжЬЯпЉИOSпЉЙжЫіжШѓжШЊиСЧжФєеЦДпЉМдЄ≠дљНOSжЬ™иЊЊеИ∞пЉМињЬдЉШдЇОеѓєзЕІзїДзЪД9.92дЄ™жЬИгАВ
жФЊе∞ДеЕНзЦЂж≤їзЦЧеѓєTзїЖиГЮеЇУзЪДељ±еУН
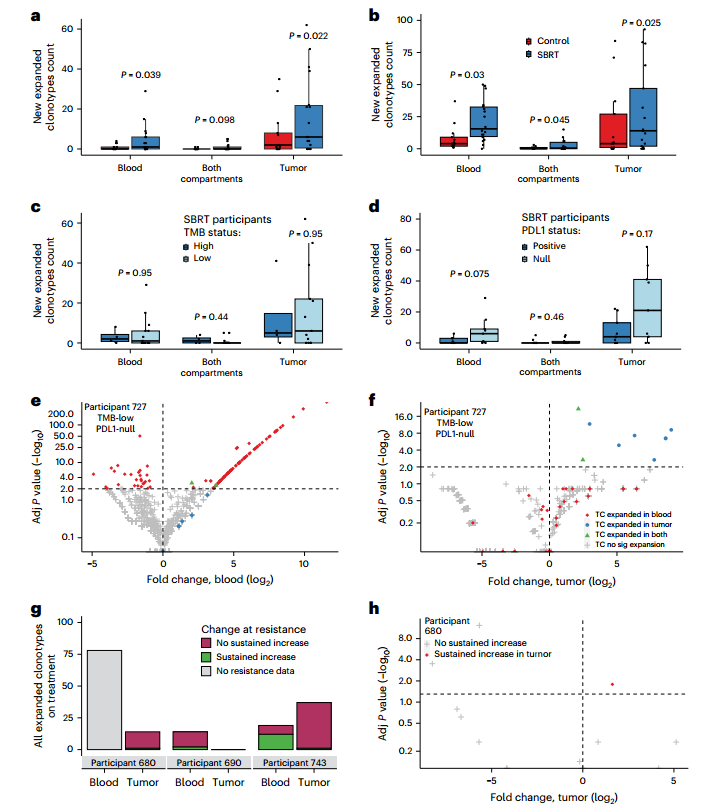
дЄЇиѓДдЉ∞SBRTжШѓеР¶еҐЮеЉЇеЕНзЦЂж≤їзЦЧиѓ±еѓЉзЪДTзїЖиГЮеПНеЇФеєњеЇ¶дЄОжЈ±еЇ¶пЉМз†Фз©ґеЫҐйШЯйАЪињЗNGSйЂШйАЪйЗПжµЛеЇПеѓєйЭЮзЕІе∞ДиВњзШ§зЧЕзБґеПКе§ЦеС®и°Аж†ЈжЬђTCR Vќ≤ CDR3еЈ≤жЬЙеЕЛйЪЖдЄОжЦ∞еЗЇзО∞зЪДеЕЛйЪЖињЫи°МдЇЖеИЖжЮРпЉМеПСзО∞жЧ†иЃЇжШѓйЭЮзЕІе∞ДиВњзШ§ињШжШѓе§ЦеС®и°АдЄ≠зЪДSBRTзїДзЪДTCRеЕЛйЪЖеѓЖеЇ¶еЭЗжШЊиСЧйЂШдЇОеѓєзЕІзїДпЉИеЫЊ1a,bпЉЙгАВ
ињЫдЄАж≠•еИЖе±ВеИЖжЮРжШЊз§ЇпЉМеЬ®SBRTзїДдЄ≠пЉМжЧ†иЃЇжШѓTMBдљО vs TMBйЂШиВњзШ§дєЛйЧіжЙ©еҐЮеЕЛйЪЖиЃ°жХ∞пЉМињШжШѓPD-L1йШіжАІдЄОPD-L1йШ≥жАІиВњзШ§дєЛйЧіеЭЗдЄЇеПСзО∞жШЊиСЧеЈЃеЉВпЉМињЩдЇЫеПСзО∞и°®жШОжФЊзЦЧиБФеРИеЕНзЦЂж≤їзЦЧиѓ±еѓЉдЇЖеЈ≤жЬЙеТМжЦ∞зЪДTзїЖиГЮеЕЛйЪЖжЙ©еҐЮпЉМињЩдЄАжХИеЇФзЛђзЂЛдЇОTMBзКґжАБеТМPD-L1и°®иЊЊгАВпЉИеЫЊ1c,dпЉЙгАВеЕЄеЮЛзЧЕдЊЛCGLU727е∞љзЃ°TMBдљОдЄФPD-L1йШіжАІпЉМдљЖеЬ®жО•еПЧSBRTиБФеРИжіЊеІЖеНХжКЧеРОиОЈеЊЧйГ®еИЖзЉУиІ£пЉМеЕґиВњзШ§еТМи°Ажґ≤дЄ≠еЭЗж£АжµЛеИ∞жШЊиСЧзЪДTCRеЕЛйЪЖжЙ©еҐЮдЄОе§Ъж†ЈжАІжПРеНЗгАВињЩдЇЫзїУжЮЬи°®жШОиБФеРИжФЊзЦЧеЕНзЦЂж≤їзЦЧеПѓиГљиѓ±еѓЉе§ЦеС®TзїЖиГЮеЇУзЪДйЗНе°Сдї•еПКйЭЮзЕІе∞ДиВњзШ§йГ®дљНзЪДињЬйЪФеПНеЇФпЉМињЩеПѓдї•й©±еК®иВњзШ§жґИйЩ§еТМдЄіеЇКеЇФз≠ФгАВ
еЫЊ1
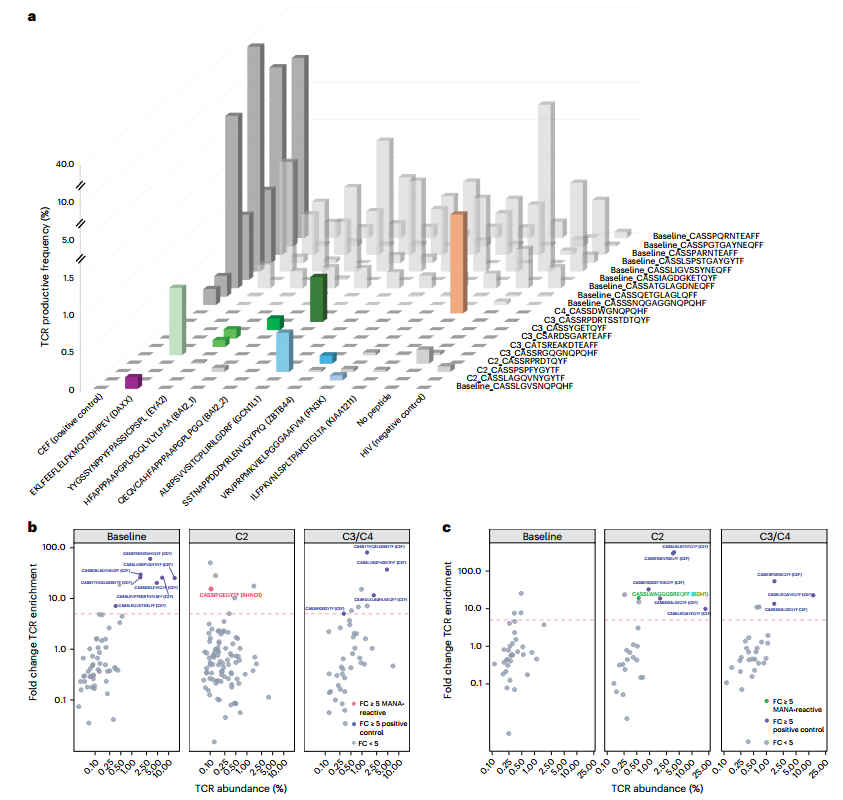
дЄЇй™МиѓБжФЊзЦЧзЪДз≥їзїЯжАІжХИеЇФдЉЪеПНжШ†еЬ®йТИеѓєеЕЛйЪЖжАІи°®иЊЊз™БеПШзЪДжЦ∞жКЧеОЯеПНеЇФжАІTзїЖиГЮеЇФз≠ФзЪДж£АжµЛдЄКпЉМињЩдЇЫз™БеПШдЉЪеЬ®еОЯеПСзБґгАБзЕІе∞ДйГ®дљНеТМињЬйЪФпЉИжіїж£АпЉЙиВњзШ§йГ®дљНеЕ±дЇЂињЩдЄАеБЗиЃЊпЉМз†Фз©ґеИ©зФ®жѓПдљНжВ£иАЕзЪДеЕ®е§ЦжШЊе≠РжµЛеЇПжХ∞жНЃеРИжИРжЦ∞иВљпЉМйЪПеРОзФ®иЗ™дљУTзїЖиГЮињЫи°МиВљеИЇжњАпЉМеєґйАЪињЗTCRжµЛеЇПйЙіеЃЪжЦ∞жКЧеОЯзЙєеЉВжАІеЕЛйЪЖеЮЛжЙ©еҐЮпЉМзїУжЮЬжШЊз§ЇеЬ®йХњжЬЯзФЯе≠ШзЪДSBRTзїДжВ£иАЕдЄ≠йЙіеЃЪеЗЇ10дЄ™йТИеѓєDAXXгАБFN3KгАБGCN1L1гАБZBTB44гАБEYA2еТМKIAA1211еЕЛйЪЖжАІи°®иЊЊз™БеПШзЪДжЦ∞жКЧеОЯеПНеЇФжАІTзїЖиГЮпЉМеЕґдЄ≠DAXXжЦ∞иВљеПНеЇФжАІеЕЛйЪЖеЬ®жФЊзЦЧиБФеРИеЕНзЦЂж≤їзЦЧеЯЇзЇњжЬЯеТМзђђдЄЙеС®жЬЯжЧґжЙ©еҐЮзЪДTзїЖиГЮеЯєеЕїзЙ©дЄ≠襀ж£АжµЛеИ∞пЉМиАМеЕґдљЩжЦ∞жКЧеОЯеПНеЇФжАІеЕЛйЪЖеЮЛжЙ©еҐЮжШѓеЬ®жФЊзЦЧиБФеРИеЕНзЦЂж≤їзЦЧеЉАеІЛеРОпЉИжіЊеІЖеНХжКЧзђђ2гАБ3гАБ4еС®жЬЯпЉЙиОЈеПЦзЪДиЗ™дљУTзїЖиГЮеЯєеЕїзЙ©ж£АжµЛдЄ≠еПСзО∞пЉИеЫЊ2b,cпЉЙгАВ
ињЩдЇЫеПСзО∞жФѓжМБеЬ®жО•еПЧеЇПиіѓжФЊзЦЧеТМжКЧPD-1ж≤їзЦЧзЪДйХњжЬЯзФЯе≠ШиАЕдЄ≠е≠ШеЬ®MANAеПНеЇФжАІTзїЖиГЮеЇФз≠ФпЉМеєґдЄЇињЫдЄАж≠•иѓБжШОжФЊзЦЧиБФеРИеЕНзЦЂж≤їзЦЧиѓ±еѓЉз≥їзїЯжАІжКЧиВњзШ§еЕНзЦЂеПНеЇФжПРдЊЫдЇЖиѓБжНЃгАВ
еЫЊ2
ињЩй°єе§ЪзїДе≠¶з†Фз©ґиѓБеЃЮпЉМSBRTиБФеРИеЄХеНЪеИ©зП†еНХжКЧиГље§ЯеЬ®еЕНзЦЂеЖЈеЮЛNSCLCжВ£иАЕдЄ≠иѓ±еѓЉз≥їзїЯжАІжКЧиВњзШ§еЕНзЦЂеПНеЇФпЉМи°®зО∞дЄЇйЭЮзЕІе∞ДйГ®дљНеЕНзЦЂеЯЇеЫ†и°®иЊЊдЄКи∞ГгАБTзїЖиГЮеЕЛйЪЖжЙ©еҐЮеТМжЦ∞жКЧеОЯзЙєеЉВжАІTзїЖиГЮеЇФз≠ФгАВзЙєеИЂжШѓеѓєдЇОйВ£дЇЫеЕЈжЬЙзЙєеЃЪеИЖе≠РзЙєеЊБпЉИе¶ВдљОTMBгАБPD-L1йШіжАІеТМWntз™БеПШпЉЙзЪДжВ£иАЕпЉМSBRTеПѓиГљжПРдЊЫйҐЭе§ЦзЪДж≤їзЦЧжХИзЫКгАВињЩдЇЫеПСзО∞дЄЇеЕЛжЬНеЕНзЦЂж≤їзЦЧиАРиНѓжАІжПРдЊЫдЇЖжЦ∞зЪДжАЭиЈѓпЉМжФѓжМБеЬ®зЙєеЃЪжВ£иАЕзЊ§дљУдЄ≠ињЫдЄАж≠•жΥ糥жФЊзЦЧиБФеРИеЕНзЦЂж≤їзЦЧзЪДдЄіеЇКдїЈеАЉгАВ
иЙЊж≤РиТљдЄУж≥®дЇОеЕНзЦЂзїДжµЛеЇПйҐЖеЯЯе§ЪеєіпЉМеЉАеПСзЪДImmuHub¬ЃжКАжЬѓеє≥еП∞жЦєж≥ХеЕ®йЭҐпЉМж£АжµЛзЙ©зІНе§Ъж†ЈпЉМеїЇеЇУжЦєж≥ХеЕЈжЬЙзБµжіїжАІпЉМиЗіеКЫдЇОдЄЇеРДе§ІйЂШж†°гАБеМїйЩҐгАБзІСз†ФжЬЇжЮДгАБдЉБдЄЪз≠ЙжПРдЊЫдЉШиЙѓзЪДзІСз†ФжЬНеК°гАВ

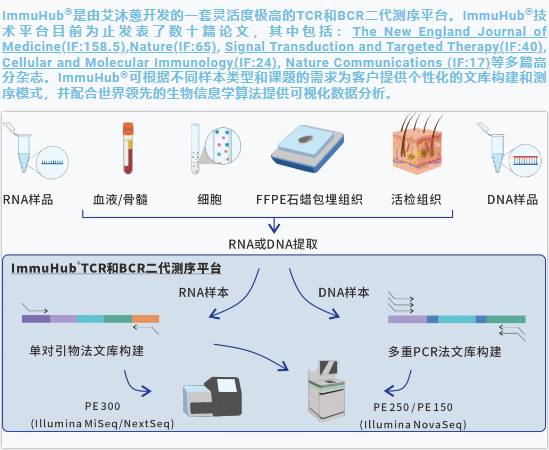
ImmuHub¬ЃйГ®еИЖзІСз†ФжЦєеРС

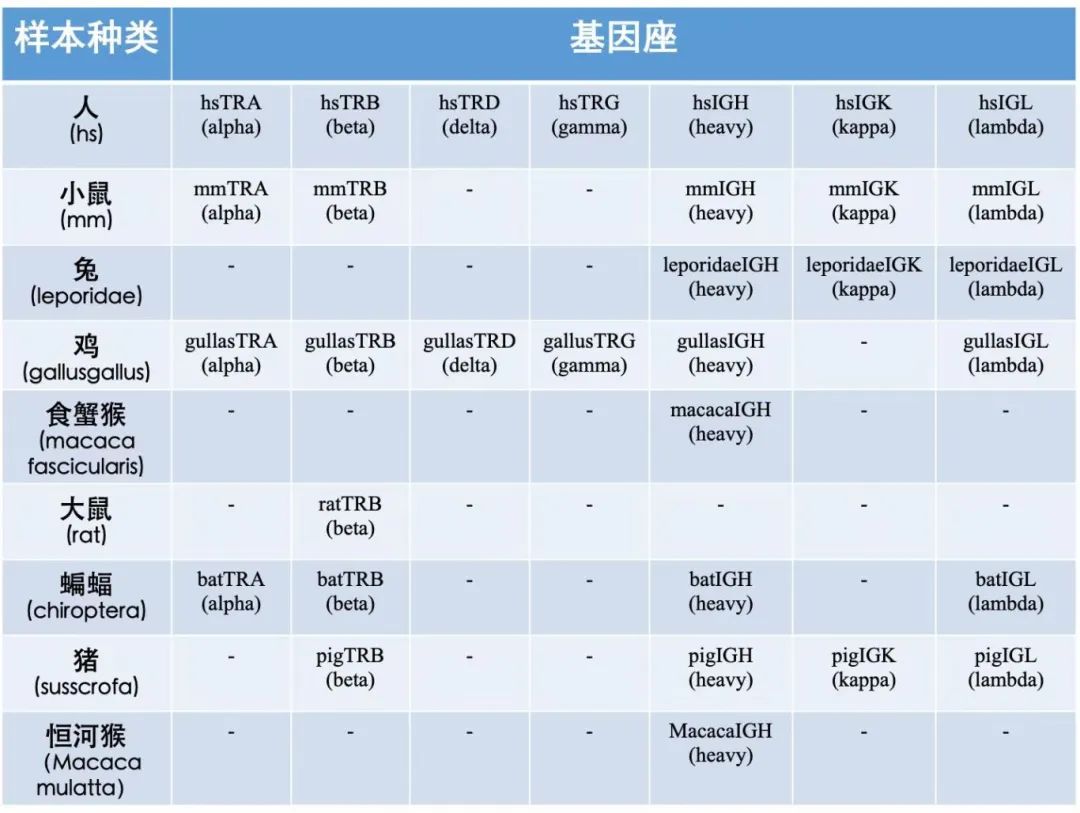
ImmuHub¬ЃйАВзФ®еЯЇеЫ†еЇІ
йГ®еИЖжХ∞жНЃеИЖжЮРзїУжЮЬе±Хз§Ї
жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪеТМдЄУз≤ЊзЙєжЦ∞дЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†еЕНзЦЂеКЫжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБжЦ∞жКЧеОЯгАБTCRеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВзЫЃеЙНдЄЇж≠ҐеПСи°®дЇЖ50дљЩзѓЗиЃЇжЦЗпЉМеЕґдЄ≠еМЕжЛђпЉЪThe New England Journal of Medicine(IF:158.5), Nature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24), Nature Communications (IF:17)з≠Йе§ЪзѓЗйЂШеИЖжЭВењЧгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ


