зВОзЧЗжАІиВ†зЧЕпЉИIBDпЉЙжВ£иАЕзЪДж≤їзЦЧдєЛиЈѓпЉМеЄЄеЫ∞дЇО вАЬиѓХйФЩеЊ™зОѓвАЭвАФвАФ зФЯзЙ©еИґеЙВиЩљиГљзЉУиІ£зЧЗзКґпЉМдљЖдїЕйГ®еИЖдЇЇеУНеЇФпЉМжЧ†жХИж≤їзЦЧдЄНдїЕеїґиѓѓзЧЕжГЕпЉМињШеК†йЗНзїПжµОиіЯжЛЕгАВ
2025еєі2жЬИеПСи°®еЬ®¬†GastroenterologyпЉИељ±еУНеЫ†е≠Р 25.1пЉЙзЪДдЄАй°єз†Фз©ґпЉМдЄЇ IBD ж≤їзЦЧеЄ¶жЭ•еЕ≥йФЃз™Бз†іпЉЪйАЪињЗе§ЦеС®и°Ае§ЪзїДе≠¶еИЖжЮРпЉМй¶Цжђ°йФБеЃЪеҐЮжЃЦзЪДеЊ™зОѓжХИеЇФ CD4+T зїЖиГЮпЉМеПѓз≤ЊеЗЖйҐДжµЛжХіеРИзі†ќ±4ќ≤7йШїжЦ≠зЦЧж≥ХпЉИдї£и°®иНѓзЙ©пЉЪзїіе§ЪзП†еНХжКЧпЉЙзЪДзЦЧжХИпЉМдЄЇ IBD з≤ЊеЗЖж≤їзЦЧжМЙдЄЛ вАЬењЂињЫйФЃвАЭгАВ

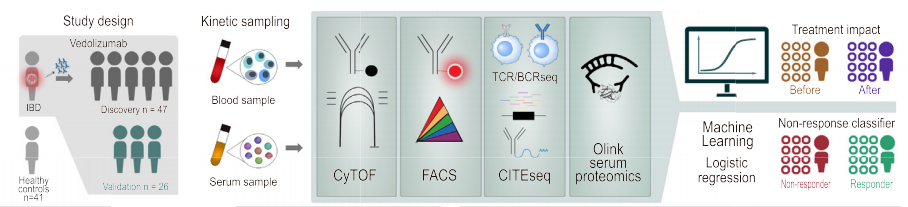
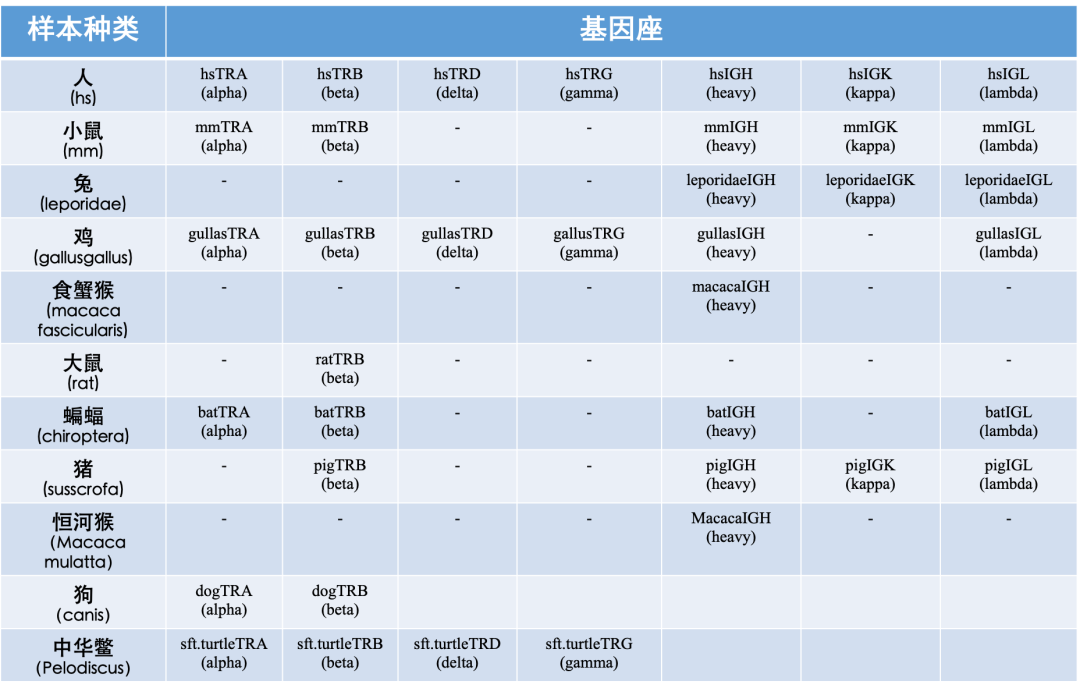
иѓ•з†Фз©ґйАЪињЗжХіеРИиі®и∞±жµБеЉПпЉИCyTOFпЉЙгАБеНХзїЖиГЮжµЛеЇПпЉИscRNA-seq+CITE-seqгАБscTCR-seq+scBCR-seqпЉЙгАБе§ЪеПВжХ∞жµБеЉПпЉИFACSпЉЙгАБи°АжЄЕиЫЛзЩљиі®зїДпЉИOlinkпЉЙз≠Йе§Ъй°єжКАжЬѓеЕ®йЭҐеИЖжЮРе§ЦеС®и°Аж†ЈжЬђпЉМеєґйАЪињЗжЬЇеЩ®е≠¶дє†зЃЧж≥ХжХіеРИе§ЪзїДе≠¶жХ∞жНЃз≠ЫйАЙйҐДжµЛзЙєеЊБгАВињЩзІНе§ЪзїДе≠¶жКАжЬѓ+дЇЇеЈ•жЩЇиГљзЃЧж≥ХзЪДж®°еЉПеПѓдї•дЄЇеєње§ІзІСз†ФеЈ•дљЬиАЕжПРдЊЫжАЭиЈѓгАВ

зїіе§ЪзП†еНХжКЧжШѓ IBD ж≤їзЦЧзЪДж†ЄењГзФЯзЙ©еИґеЙВпЉМйАЪињЗйШїжЦ≠жХіеРИзі† ќ±4ќ≤7 дЄОиВ†йБУи°АзЃ°йїПйЩДеИЖе≠Р MAdCAM-1 зЪДзїУеРИпЉМйШїж≠ҐжЈЛеЈізїЖиГЮ вАЬељТеЈҐвАЭ еИ∞иВ†йБУеЉХеПСзВОзЧЗпЉМиГљжЬЙжХИиѓ±еѓЉеТМзїіжМБеЕЛзљЧжБ©зЧЕпЉИCDпЉЙгАБжЇГзЦ°жАІзїУиВ†зВОпЉИUCпЉЙжВ£иАЕзЪДдЄіеЇКзЉУиІ£гАВ
дљЖиѓ•ж≤їзЦЧе≠ШеЬ®еУНеЇФзОЗжЬЙйЩРгАБзЉЇдєПйҐДжµЛжЙЛжЃµгАБжЧҐеЊАж†ЗењЧзЙ©пЉИе¶ВCеПНеЇФиЫЛзЩљгАБз≤™дЊњиПМзЊ§гАБиВ†йБУйїПиЖЬиљђељХзїДз≠ЙпЉЙ姱жХИз≠ЙзО∞еЃЮйЪЊйҐШгАВдЄЇиІ£еЖ≥ињЩдЄАеЫ∞еҐГпЉМз†Фз©ґеЫҐйШЯеЉАе±ХдЇЖињЩй°єеЙНзЮїжАІйШЯеИЧз†Фз©ґпЉМиБЪзД¶е§ЦеС®и°АеЕНзЦЂжЩѓиІВпЉМиѓХеЫЊжЙЊеИ∞ вАЬйҐДеИ§зЦЧжХИвАЭ зЪДеЕ≥йԁ篜糥гАВ

1гАБз†Фз©ґйШЯеИЧпЉЪзЇ≥еЕ•47дЊЛжО•еПЧзїіе§ЪзП†еНХжКЧж≤їзЦЧзЪДIBDжВ£иАЕпЉИеРЂCDеТМUCпЉЙеТМ41дЊЛеєійЊДгАБжАІеИЂеМєйЕНзЪДеБ•еЇЈеѓєзЕІдљЬдЄЇжЬЇеЩ®е≠¶дє†иЃ≠зїГйШЯеИЧпЉМеП¶жЬЙ26дЊЛзЫЄеРМж≤їзЦЧжЦєж°ИзЪДIBDжВ£иАЕдљЬдЄЇй™МиѓБйШЯеИЧгАВ
2гАБе§ЪзїДе≠¶жКАжЬѓпЉЪйАЪињЗиі®и∞±жµБеЉПиІ£жЮРеЕНзЦЂзїЖиГЮдЇЪзЊ§зїДжИРеПКжХіеРИзі†ќ±4ќ≤7 и°®иЊЊеИЖеЄГпЉЫscRNA-seq+CITE-seqжМЦжОШзїЖиГЮиљђељХзЙєеЊБпЉЫеЕ≥иБФеЯЇеЫ†дЄОиЫЛзЩљи°®иЊЊпЉЫscTCR+BCR-seqеИЖжЮРжЈЛеЈізїЖиГЮеЕЛйЪЖеК®жАБеПШеМЦпЉЫе§ЪеПВжХ∞жµБеЉПзїЖиГЮжЬѓйЗПеМЦеЕ≥йФЃзїЖиГЮдЇЪзЊ§пЉМй™МиѓБж†ЗењЧзЙ©пЉЫOlinkж£АжµЛеИЖжЮРз≥їзїЯжАІзВОзЧЗеЫ†е≠РеПШеМЦгАВ
3гАБжХ∞жНЃеИЖжЮРз≠ЦзХ•пЉЪйЗЗзФ®йАїиЊСеЫЮељТгАБLasso ж≠£еИЩеМЦз≠ЙжЬЇеЩ®е≠¶дє†ж®°еЮЛпЉМжХіеРИе§ЪзїДе≠¶жХ∞жНЃз≠ЫйАЙйҐДжµЛзЙєеЊБгАВйАЪињЗдЇ§еПЙй™МиѓБиѓДдЉ∞ж®°еЮЛжАІиГљпЉИAUC еАЉпЉЙпЉМдЉШеЕИйАЙжЛ©вАЬзЃАеНХгАБдљОжИРжЬђгАБжШУдЄіеЇКжО®еєњвАЭзЪДж†ЗењЧзЙ©зїДеРИгАВ


-
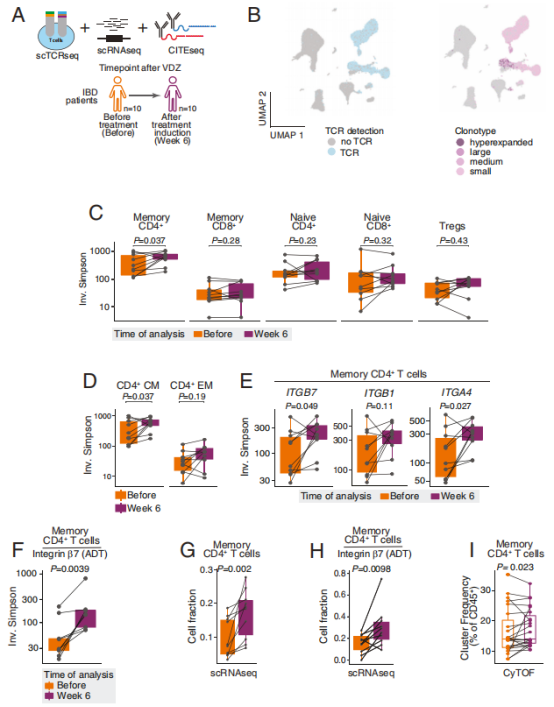
жХіеРИзі† ќ±4ќ≤7 зЪДи°®иЊЊеИЖеЄГпЉЪќ±4ќ≤7дЄНдїЕи°®иЊЊдЇО T зїЖиГЮгАБеНХж†ЄзїЖиГЮпЉМз†Фз©ґеПСзО∞еЃГињШеєњж≥Ые≠ШеЬ®дЇОеЧЬйЕЄжАІз≤ТзїЖиГЮгАБж†Сз™БзКґзїЖиГЮз≠ЙпЉМдЄФ IBD жВ£иАЕж≤їзЦЧеЙН ќ±4ќ≤7 + зїЖиГЮжѓФдЊЛжШЊиСЧдљОдЇОеБ•еЇЈеѓєзЕІзїДпЉМж≤їзЦЧеРОжЙАжЬЙзїЖиГЮдЇЪзЊ§зЪД ќ≤7и°®иЊЊдЄКи∞ГпЉИќ±4жЧ†жШОжШЊеПШеМЦпЉЙ вАФвАФ ињЩжПРз§Їзїіе§ЪзП†еНХжКЧеПѓиГљйАЪињЗи∞ГжОІ ќ≤7 и°®иЊЊеПСжМ•дљЬзФ®гАВ
-
TзїЖиГЮеЕЛйЪЖе§Ъж†ЈжАІпЉЪеНХзїЖиГЮжµЛеЇПзїУеРИCITE-seqиѓДдЉ∞ж≤їзЦЧеЙНеРОеЊ™зОѓTзїЖиГЮеТМBзїЖиГЮзЪДе§Ъж†ЈжАІгАВж≤їзЦЧеРОеЊ™зОѓиЃ∞ењЖ CD4+T зїЖиГЮпЉИзЙєеИЂжШѓдЄ≠е§ЃиЃ∞ењЖCD4+TзїЖиГЮпЉЙзЪД TCR е§Ъж†ЈжАІжШЊиСЧеҐЮеК†пЉМи°®иЊЊ ITGA4пЉИжХіеРИзі†ќ±4пЉЙеТМ ITGB7пЉИжХіеРИзі†ќ≤7пЉЙ зЪД CD4+ T зїЖиГЮзЪД TCR е§Ъж†ЈжАІжШЊиСЧеҐЮеК†пЉИеЫЊ1пЉЙгАВжПРз§ЇиВ†йБУељТеЈҐ T зїЖиГЮ襀 вАЬжїЮзХЩвАЭ дЇОе§ЦеС®и°АпЉМжЧ†ж≥ХеЖНињЫеЕ•иВ†йБУеЉХеПСзВОзЧЗпЉМињЩжШѓиНѓзЙ©иµЈжХИзЪДеЕ≥йФЃжЬЇеИґдєЛдЄАгАВ
еЫЊ1
-
зВОзЧЗеЫ†е≠РеПШеМЦпЉЪж≤їзЦЧ 6 еС®еРОпЉМи°АжЄЕдЄ≠е§ЪзІНзВОзЧЗеЫ†е≠РпЉИе¶В CCL11гАБCX3CL1гАБTNF-ќ≤пЉЙж∞іеє≥еНЗйЂШпЉМдЄФдЄОе§ЦеС®и°АдЄ≠ ќ±4ќ≤7 + зїЖиГЮеѓМйЫЖеСИж≠£зЫЄеЕ≥пЉМжО®жµЛдЄЇеЕНзЦЂзїЖиГЮжїЮзХЩеѓЉиЗізЪДвАЬеЊ™зОѓзВОзЧЗеЫ†е≠РиУДзІѓвАЭгАВ

иѓ•з†Фз©ґжХіеРИOlinkпЉИи°АжЄЕиЫЛзЩљпЉЙгАБFACSпЉИзїЖиГЮи°®еЮЛпЉЙгАБCyTOFпЉИзїЖиГЮзїДжИРпЉЙжХ∞жНЃйЫЖжИРеИ∞жЬЇеЩ®е≠¶дє†ж®°еЮЛдЄ≠пЉМеЇФзФ®зЇњжАІеТМйЭЮзЇњжАІеИЖз±їжЦєж≥ХпЉМдї•з°ЃеЃЪдЄОзїіе§ЪзП†еНХжКЧжЧ†еПНеЇФзЫЄеЕ≥зЪДзЙєеЊБгАВжЬАзїИйФБеЃЪдЇЖж≤їзЦЧеЙНе§ЦеС®и°АдЄ≠Ki67+иЃ∞ењЖCD4+TзїЖиГЮвАФвАФ ињЩжШѓеМЇеИЖеУНеЇФиАЕдЄОжЧ†еУНеЇФиАЕзЪД вАЬйїДйЗСжМЗж†ЗвАЭпЉМеЃГеЕЈжЬЙдї•дЄЛзЙєзВєпЉЪ
пЉИ1пЉЙжХ∞жНЃйЗПеЈЃеЉВжШЊиСЧ
жЬ™еУНеЇФиАЕж≤їзЦЧеЙНпЉМе§ЦеС®и°АдЄ≠ Ki67 + иЃ∞ењЖ CD4+T зїЖиГЮжѓФдЊЛињЬйЂШдЇОеУНеЇФиАЕпЉМдЄФиѓ•еЈЃеЉВеЬ®ж≤їзЦЧеРОдїНжМБзї≠е≠ШеЬ®пЉМдЄНеПЧиНѓзЙ©ељ±еУНгАВ
пЉИ2пЉЙвАЬиАРиНѓи°®еЮЛвАЭ жШОз°Ѓ
иѓ•з±їзїЖиГЮжЬЙ3дЄ™ж†ЄењГзЙєеЊБпЉМдљњеЕґиГљвАЬйАГйБњвАЭзїіе§ЪзП†еНХжКЧзЪДдљЬзФ®пЉЪ
-
жњАжіїзКґжАБпЉЪйЂШи°®иЊЊ HLA-DRгАБCD38 з≠ЙжњАжіїж†ЗењЧзЙ©пЉМеИЖж≥М IL-17AгАБIFN-ќ≥ з≠ЙдњГзВОзїЖиГЮеЫ†е≠РпЉМжМБзї≠жО®еК®иВ†йБУзВОзЧЗпЉЫ
-
жЫњдї£ељТеЈҐйАФеЊДпЉЪдЄНдЊЭиµЦ ќ±4ќ≤7пЉМиАМжШѓйАЪињЗи°®иЊЊ ќ±4ќ≤1 жХіеРИзі†пЉИзїУеРИ VCAM-1пЉЙињЫеЕ•иВ†йБУ вАФвАФ зїіе§ЪзП†еНХжКЧдїЕйЭґеРС ќ±4ќ≤7пЉМеѓє ќ±4ќ≤1 жЧ†жХИпЉМеЫ†ж≠§ињЩз±їзїЖиГЮдїНиГљ вАЬзХЕйАЪжЧ†йШївАЭ еЬ∞еЉХеПСзВОзЧЗпЉЫ
-
Th1/Th17 е±ЮжАІпЉЪйЂШи°®иЊЊ T-betгАБRORќ≥t з≠ЙиљђељХеЫ†е≠РпЉМе±ЮдЇОиЗізЧЕжАІ T зїЖиГЮдЇЪзЊ§пЉМжШѓ IBD зВОзЧЗзЪДж†ЄењГй©±еК®иАЕгАВ
пЉИ3пЉЙйҐДжµЛжАІиГљдЉШеЉВ
еНХзЛђж£АжµЛKi67+иЃ∞ењЖCD4+TзїЖиГЮпЉМйҐДжµЛзЦЧжХИзЪДAUCеАЉиЊЊ0.93пЉЫжХіеРИ OlinkпЉИи°АжЄЕиЫЛзЩљпЉЙгАБFACSпЉИзїЖиГЮи°®еЮЛпЉЙгАБCyTOFпЉИзїЖиГЮзїДжИРпЉЙжХ∞жНЃзЪДж®°еЮЛAUCиЊЊ0.98пЉЫдљЖдїЕиБФеРИFACSзЪДдЄЙдЄ™жМЗж†ЗпЉИKi67+CXCR3+IL-4пЉЙеН≥еПѓеЃЮзО∞еРМз≠ЙйҐДжµЛз≤ЊеЇ¶пЉИеЬ®й™МиѓБйШЯеИЧдЄ≠ AUC еАЉйЂШиЊЊ 0.99пЉЙвАФвАФ дїЕйЬАе§ЦеС®и°Аж†ЈжЬђпЉМзФ®еЄЄиІДжµБеЉПзїЖиГЮжЬѓеН≥еПѓж£АжµЛпЉМжЧ†йЬАдЊµеЕ•жАІиВ†йБУжіїж£АпЉМжЫійАВеРИдЄіеЇКжО®еєњгАВ
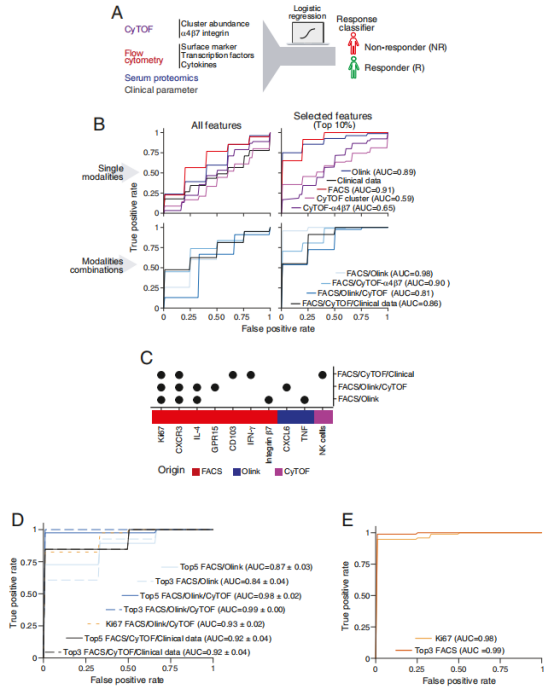

иѓ•з†Фз©ґйАЪињЗе§ЦеС®и°Ае§ЪзїДе≠¶еИЖжЮРпЉМдЄНдїЕжЙЊеИ∞дЇЖвАЬйҐДеИ§зїіе§ЪзП†еНХжКЧзЦЧжХИвАЭзЪДеЕ≥йФЃжМЗж†ЗпЉМжЫіжП≠з§ЇдЇЖиАРиНѓжЬЇеИґпЉМдЄЇеРОзї≠ж≤їзЦЧжЦєж°ИдЉШеМЦжПРдЊЫдЇЖжШОз°ЃжЦєеРСгАВжЬ™жЭ•йЬАйАЪињЗжЫіе§ІиІДж®°йШЯеИЧй™МиѓБж†ЗењЧзЙ©пЉМKi67+иЃ∞ењЖCD4+TзїЖиГЮж£АжµЛжЬЙжЬЫжИРдЄЇ IBD дЄіеЇКиѓКзЦЧзЪД вАЬеЄЄиІДй°єзЫЃвАЭпЉМиЃ©жЫіе§ЪжВ£иАЕеСКеИЂ вАЬиѓХйФЩж≤їзЦЧвАЭпЉМиµ∞еРСдЄ™дљУеМЦеЇЈе§НдєЛиЈѓгАВ
еПВиАГжЦЗзМЃ
Horn V, Cancino CA, Steinheuer LM, et al. Multimodal Profiling of Peripheral Blood Identifies Proliferating Circulating Effector CD4+ T Cells as Predictors for Response to Integrin ќ±4ќ≤7-Blocking Therapy in Inflammatory Bowel Disease. Gastroenterology. 2025;168(2):327-343. doi:10.1053/j.gastro.2024.09.021
иЙЊж≤РиТљдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯе§ЪеєіпЉМеЉАеПСзЪДImmuHub¬ЃжКАжЬѓеє≥еП∞жЦєж≥ХеЕ®йЭҐпЉМж£АжµЛзЙ©зІНе§Ъж†ЈпЉМеїЇеЇУжЦєж≥ХеЕЈжЬЙзБµжіїжАІпЉМиЗіеКЫдЇОдЄЇеРДе§ІйЂШж†°гАБеМїйЩҐгАБзІСз†ФжЬЇжЮДгАБдЉБдЄЪз≠ЙжПРдЊЫдЉШиЙѓзЪДзІСз†ФжЬНеК°гАВ

ImmuHub¬ЃйГ®еИЖзІСз†ФжЦєеРС

ImmuHub¬ЃйАВзФ®еЯЇеЫ†еЇІ
йГ®еИЖжХ∞жНЃеИЖжЮРзїУжЮЬе±Хз§Ї
жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪеТМдЄУз≤ЊзЙєжЦ∞дЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†еЕНзЦЂеКЫжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБжЦ∞жКЧеОЯгАБTCRеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВзЫЃеЙНдЄЇж≠ҐеПСи°®дЇЖ50дљЩзѓЗиЃЇжЦЗпЉМеЕґдЄ≠еМЕжЛђпЉЪThe New England Journal of Medicine(IF:158.5), The Lancet(IF:98.4), Nature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24),¬†Nature Communications¬†(IF:17)з≠Йе§ЪзѓЗйЂШеИЖжЭВењЧгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ


