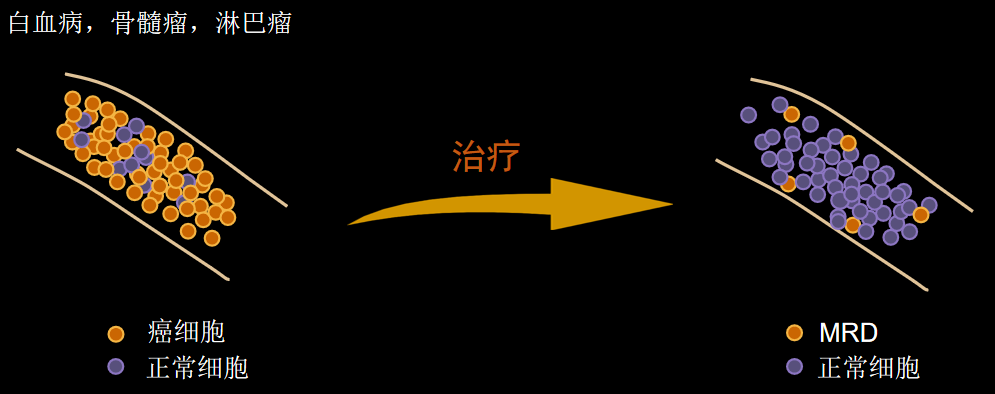
и°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛзЪДжДПдєЙ襀иґКжЭ•иґКе§ЪзЪДз†Фз©ґжЙАиѓБеЃЮпЉМжѓФе¶ВMRDж£АжµЛеПѓзФ®дЇОеН±йЩ©еЇ¶еИЖе±ВгАБжМЗеѓЉж≤їзЦЧжЦєж°ИзЪДйАЙжЛ©гАБиѓДдЉ∞ж≤їзЦЧжХИжЮЬгАБйҐДжµЛе§НеПСгАБдљЬдЄЇдЄіеЇКиѓХй™МзЪДзїИзВєз≠Йз≠ЙпЉМеЬ®дЄіеЇКиѓХй™МеТМеЃЮиЈµдЄ≠еЭЗеПСжМ•дЇЖйЗНи¶БдљЬзФ®гАВ
еЯЇдЇОдЇМдї£жµЛеЇПпЉИNGSпЉЙжКАжЬѓзЪДMRDж£АжµЛиГљиЊЊеИ∞10-6зЪДзБµжХПеЇ¶пЉМзЫЄжѓФдЉ†зїЯзЪДжµБеЉПж£АжµЛжЦєж≥ХйЂШеЗЇиЗ≥е∞С100еАНпЉМдЄФзЙєеЉВжАІгАБеЗЖз°ЃжАІжЫійЂШпЉМеЈ≤襀зЇ≥еЕ•еЫљеЖЕе§ЦжМЗеНЧжО®иНРдЄ≠гАВ
NGS-MRDж£АжµЛйАЪињЗеѓєжЈЛз≥їи°Ажґ≤иВњзШ§жВ£иАЕзЪДеИЭиѓКж†ЈжЬђжИЦиВњзШ§йЂШиіЯиНЈж†ЈжЬђињЫи°МеЕЛйЪЖжАІж£АжµЛпЉМйЙіеЃЪеЗЇжШЊиСЧжАІеЕЛйЪЖпЉМеН≥жЙЊеИ∞зЩМзїЖиГЮпЉМиАМеРОеПѓдї•ињљиЄ™ж≤їзЦЧеРОж†ЈжЬђдЄ≠зЪДзЩМзїЖиГЮеПЧдљУеЯЇеЫ†еЇПеИЧпЉМжµЛйЗПMRDж∞іеє≥гАВMRDињљиЄ™ж£АжµЛеПѓдї•иіѓз©њиВњзШ§ж≤їзЦЧзЪДжХідЄ™ињЗз®ЛпЉМеЬ®дЄНеРМйШґжЃµжЬЙдЄНеРМзЪДжМЗеѓЉжДПдєЙгАВзДґиАМеЕ≥дЇОMRDж£АжµЛзЪДжЬАдљ≥жЧґжЬЇе∞ЪжЧ†зїЯдЄАзїУиЃЇпЉМзїЩеМїзФЯзЪДиІДиМГдЄіеЇКеЃЮиЈµйА†жИРдЇЖдЄАеЃЪеЫ∞жЙ∞гАВ
жЬђжЦЗйАЪињЗжАїзїУеЫљеЖЕе§ЦеРДдЄіеЇКеЃЮиЈµжМЗеНЧгАБдЄУеЃґеЕ±иѓЖгАБжЭГе®БжЬЇжЮДеПСи°®зЪДжЦЗзМЃз≠ЙеЕ≥дЇОMRDж£АжµЛжЧґжЬЇзЪДеїЇиЃЃпЉМеЄМжЬЫдЄЇдЄіеЇКеЃЮиЈµжПРдЊЫдЄАеЃЪеПВиАГдїЈеАЉгАВ
National Comprehensive Cancer NetworkпЉИNCCNпЉЙвАЬжА•жАІжЈЛеЈізїЖиГЮзЩљи°АзЧЕдЄіеЇКеЃЮиЈµжМЗеНЧпЉИ2022.V1пЉЙвАЭеТМвАЬеДњзЂ•жА•жАІжЈЛеЈізїЖиГЮзЩљи°АзЧЕдЄіеЇКеЃЮиЈµжМЗеНЧпЉИ2023.V2пЉЙвАЭеѓєMRDиѓДдЉ∞жЧґжЬЇзЪДеїЇиЃЃе¶ВдЄЛпЉЪпЉИ1пЉЙиѓ±еѓЉж≤їзЦЧзїУжЭЯжЧґпЉИеИЭж≤їжИЦе§НеПСпЉЙпЉЫпЉИ2пЉЙеЈ©еЫЇж≤їзЦЧзїУжЭЯжЧґпЉЫпЉИ3пЉЙеЕґеЃГжЧґйЧізВєеЇФж†єжНЃжЙАзФ®жЦєж°Из°ЃеЃЪпЉЫпЉИ4пЉЙеИЖе≠Ре≠¶е§НеПСжИЦжМБзї≠дљОж∞іеє≥зЦЊзЧЕиіЯиНЈжВ£иАЕеПѓеҐЮеК†ињЮзї≠зЫСжµЛйҐСзОЗгАВ
йЬАи¶Бж≥®жДПзЪДжШѓпЉМвАЬNCCNеДњзЂ•жА•жАІжЈЛеЈізїЖиГЮзЩљи°АзЧЕдЄіеЇКеЃЮиЈµжМЗеНЧпЉИ2023.V2пЉЙвАЭдЄ≠ињШжПРеИ∞пЉЪй™®йЂУеҐЮзФЯдЄНиЙѓеПѓиГљдЉЪељ±еУНMRDеЃЪйЗПж£АжµЛпЉМжЬЙдЇЫж£АжµЛжЦєж°ИйЬАи¶БеЬ®и°АзїЖиГЮиЃ°жХ∞жБҐе§Нж≠£еЄЄдєЛеРОеЖНйАБж£АMRDгАВ

дЄУеЃґеЕ±иѓЖеїЇиЃЃпЉЪеѓєдЇОеЫЇеЃЪжМБзї≠жЧґйЧізЪДж≤їзЦЧпЉМMRDж£АжµЛеЇФдЄОжЬАеРОдЄАжђ°ж≤їзЦЧеЃМжИРеРОиЗ≥е∞С2дЄ™жЬИзЪДеПНеЇФиѓДдЉ∞зЫЄдЄАиЗігАВеѓєдЇОжМБзї≠ж≤їзЦЧпЉМеЇФеЬ®иЊЊеИ∞жЬАдљ≥дЄіеЇКеПНеЇФжЧґж£АжµЛMRDзКґжАБгАВеїЇиЃЃдЄЇдЄіеЇКиѓХй™МиЃЊиЃ°жПРдЊЫеЫЇеЃЪзЪДиѓХй™МжЧґйЧізВєгАВ

вАЬжА•жАІжЈЛеЈізїЖиГЮзЩљи°АзЧЕеЊЃе∞ПжЃЛзХЩзЧЕж£АжµЛдЄОдЄіеЇКиІ£иѓїдЄ≠еЫљдЄУеЃґеЕ±иѓЖпЉИ2023еєізЙИпЉЙвАЭдЄ≠еѓєжА•жАІжЈЛеЈізїЖиГЮзЩљи°АзЧЕпЉИALLпЉЙжВ£иАЕMRDиѓДдЉ∞жЧґйЧізВєеїЇиЃЃе¶ВдЄЛпЉЪ

вАЬдЄ≠еЫљжИРдЇЇжА•жАІжЈЛеЈізїЖиГЮзЩљи°АзЧЕиѓКжЦ≠дЄОж≤їзЦЧжМЗеНЧпЉИ2021еєізЙИпЉЙвАЭдЄ≠еѓєеїЇиЃЃALLжВ£иАЕжХідЄ™ж≤їзЦЧжЬЯйЧійГљеЇФињЫиІДиМГзЪДMRDзЫСжµЛпЉМеєґж†єжНЃзЫСжµЛзїУжЮЬињЫи°МеК®жАБзЪДеН±йЩ©еЇ¶еИЖе±ВеТМж≤їзЦЧжЦєж°Ии∞ГжХігАВжЧ©жЬЯеЬ®иѓ±еѓЉж≤їзЦЧжЬЯйЧіпЉИзђђ14姩пЉЙеТМпЉИжИЦпЉЙзїУжЭЯжЧґпЉИзђђ28姩壶еП≥пЉЙи°МMRDж£АжµЛпЉЫзЉУиІ£еРОеЃЪжЬЯзЫСжµЛпЉМе∞§еЕґеЇФдњЭиѓБж≤їзЦЧзђђ3дЄ™жЬИпЉИ12-16еС®пЉЙгАБзђђ6дЄ™жЬИпЉИ18-22еС®пЉЙзЪДMRDзЫСжµЛгАВ

вАЬеµМеРИжКЧеОЯеПЧдљУTзїЖиГЮж≤їзЦЧжИРдЇЇжА•жАІBжЈЛеЈізїЖиГЮзЩљи°АзЧЕдЄ≠еЫљдЄУеЃґеЕ±иѓЖпЉИ2022еєізЙИпЉЙвАЭдЄ≠еїЇиЃЃеµМеРИжКЧеОЯеПЧдљУTзїЖиГЮпЉИCAR-TпЉЙж≤їзЦЧеРОеЙНеНКеєіжѓП1-2дЄ™жЬИгАБеНКеєіеРОжѓП3-6дЄ™жЬИињЫи°Мй™®йЂУMRDзЫСжµЛгАВдЄФжО®иНРйАЪињЗжЫіжХПжДЯзЪДжЙЛжЃµе¶ВIgйЂШйАЪйЗПжµЛеЇПз≠ЙињЫи°МMRDж£АжµЛгАВ

2020еєі8жЬИеЫљеЃґиНѓзЫСе±АиНѓеЃ°дЄ≠ењГеПСеЄГзЪДвАЬжА•жАІжЈЛеЈізїЖиГЮзЩљи°АзЧЕиНѓзЙ©дЄіеЇКиѓХй™МдЄ≠ж£АжµЛеЊЃе∞ПжЃЛзХЩзЧЕзЪДжКАжЬѓжМЗеѓЉеОЯеИЩвАЭдЄ≠жПРеЗЇпЉЪеЬ®дЄіеЇКиѓХй™МдЄ≠пЉМеѓєдЇОжЦ∞иѓКжЦ≠еТМе§НеПСйЪЊж≤їжВ£иАЕиЗ≥е∞СеЇФеЬ®й¶Цжђ°иОЈеЊЧи°Ажґ≤е≠¶еЃМеЕ®зЉУиІ£пЉИCRпЉЙжЧґеЉАеІЛMRDж∞іеє≥зЫСжµЛпЉЫеѓєеЈ≤иОЈеЊЧи°Ажґ≤е≠¶CRиАМдїНйЬАжО•еПЧзїіжМБж≤їзЦЧжИЦйА†и°Аеє≤зїЖиГЮзІїж§НзЪДжВ£иАЕеЇФеЬ®зїіжМБж≤їзЦЧжЬЯйЧігАБзІїж§НеЙНгАБжО•еПЧжЦ∞ж≤їзЦЧеЙНз°ЃеЃЪMRDзКґжАБпЉМзїіжМБж≤їзЦЧжЬЯйЧіиЗ≥е∞СжѓП3дЄ™жЬИж£АжµЛдЄАжђ°MRDпЉМзІїж§НжВ£иАЕиЗ≥е∞СеЬ®зІїж§НеРОзђђ100姩ж£АжµЛдЄАжђ°MRDгАВ




MRDж£АжµЛеЬ®жЈЛеЈізШ§дЄ≠зЪДеЇФзФ®з†Фз©ґеТМдЄіеЇКеЃЮиЈµзЫЄеѓєиЊГе∞СгАВжИСеЫљеЫљеЃґеНЂеБ•еІФеПСеЄГзЪДвАЬжЈЛеЈізШ§иѓКзЦЧжМЗеНЧпЉИ2022еєізЙИпЉЙвАЭдЄ≠жПРеИ∞пЉЪиѓ±еѓЉж≤їзЦЧиЊЊеИ∞CRзЪДжЈЛеЈіжѓНзїЖиГЮжЈЛеЈізШ§пЉИLBLпЉЙжВ£иАЕйЬАињЫдЄАж≠•ж£АжµЛMRDпЉМе¶ВжЮЬMRDйШ≥жАІеИЩжО®иНРеЉВеЯЇеЫ†йА†и°Аеє≤зїЖиГЮзІїж§НпЉИallo-HSCTпЉЙпЉМMRDйШіжАІеИЩжО®иНРзїіжМБж≤їзЦЧжИЦеѓєйЂШеН±жВ£иАЕињЫи°Мallo-HSCTгАВ

зФ±дї•дЄКжМЗеНЧеТМдЄУеЃґеЕ±иѓЖжЦЗдїґдЄ≠еПѓдї•еПСзО∞пЉЪеЫљеЖЕе§ЦдЄУеЃґеЭЗжО®иНРеЬ®и°Ажґ≤иВњзШ§еРДдЄ™ж≤їзЦЧйШґжЃµзїУжЭЯеРОиЊЊеИ∞жЬАдљ≥дЄіеЇКеПНеЇФжЧґињЫи°МMRDж£АжµЛпЉЫзїіжМБж≤їзЦЧжЬЯеТМйЪПиЃњжЬЯйЧіж†єжНЃзЦЊзЧЕзЉУиІ£жГЕеЖµеИґеЃЪMRDзЫСжµЛжЦєж°ИпЉМзЉУиІ£еРОеЙНеНКеєізЪДMRDзЫСжµЛе∞§дЄЇйЗНи¶БгАВ
-
NCCN Guidelines Version 1.2022 Acute Lymphoblastic Leukemia.
-
NCCN Guidelines Version 2.2023
Pediatric Acute Lymphoblastic Leukemia. -
Wierda WG, Rawstron A, et al. Measurable residual disease in chronic lymphocytic leukemia: expert review and consensus recommendations. Leukemia. 2021 Nov;35(11):3059-3072. doi: 10.1038/s41375-021-01241-1. 
-
дЄ≠еНОеМїе≠¶дЉЪи°Ажґ≤е≠¶еИЖдЉЪеЃЮй™МиѓКжЦ≠е≠¶зїД. жА•жАІжЈЛеЈізїЖиГЮзЩљи°АзЧЕеЊЃе∞ПжЃЛзХЩзЧЕж£АжµЛдЄОдЄіеЇКиІ£иѓїдЄ≠еЫљдЄУеЃґеЕ±иѓЖпЉИ2023еєізЙИпЉЙ [J] . дЄ≠еНОи°Ажґ≤е≠¶жЭВењЧ, 2023, 44(4) : 267-275. DOI: 10.3760/cma.j.issn.0253-2727.2023.04.002.
-
дЄ≠еЫљжКЧзЩМеНПдЉЪи°Ажґ≤иВњзШ§дЄУдЄЪеІФеСШдЉЪ, дЄ≠еНОеМїе≠¶дЉЪи°Ажґ≤е≠¶еИЖдЉЪзЩљи°АзЧЕжЈЛеЈізШ§е≠¶зїД. дЄ≠еЫљжИРдЇЇжА•жАІжЈЛеЈізїЖиГЮзЩљи°АзЧЕиѓКжЦ≠дЄОж≤їзЦЧжМЗеНЧпЉИ2021еєізЙИпЉЙ [J] . дЄ≠еНОи°Ажґ≤е≠¶жЭВењЧ, 2021, 42(9) : 705-716. DOI: 10.3760/cma.j.issn.0253-2727.2021.09.001.
-
дЄ≠еНОеМїе≠¶дЉЪи°Ажґ≤е≠¶еИЖдЉЪзЩљи°АзЧЕжЈЛеЈізШ§е≠¶зїД, дЄ≠еЫљжКЧзЩМеНПдЉЪи°Ажґ≤иВњзШ§дЄУдЄЪеІФеСШдЉЪйА†и°Аеє≤зїЖиГЮзІїж§НдЄОзїЖиГЮж≤їзЦЧе≠¶зїД. еµМеРИжКЧеОЯеПЧдљУTзїЖиГЮж≤їзЦЧжИРдЇЇжА•жАІBжЈЛеЈізїЖиГЮзЩљи°АзЧЕдЄ≠еЫљдЄУеЃґеЕ±иѓЖпЉИ2022еєізЙИпЉЙ [J] . дЄ≠еНОи°Ажґ≤е≠¶жЭВењЧ, 2022, 43(2) : 89-95. DOI: 10.3760/cma.j.issn.0253-2727.2022.02.001.
-
еЫљеЃґиНѓзЫСе±А.¬†жА•жАІжЈЛеЈізїЖиГЮзЩљи°АзЧЕиНѓзЙ©дЄіеЇКиѓХй™МдЄ≠ж£АжµЛеЊЃе∞ПжЃЛзХЩзЧЕзЪДжКАжЬѓжМЗеѓЉеОЯеИЩ. 2020еєі8жЬИ.
-
NCCN Guidelines Version 5.2022 Multiple Myeloma.
-
дЄ≠еЫљеМїеЄИеНПдЉЪи°Ажґ≤зІСеМїеЄИеИЖдЉЪ, дЄ≠еНОеМїе≠¶дЉЪи°Ажґ≤е≠¶еИЖдЉЪ. еµМеРИжКЧеОЯеПЧдљУTзїЖиГЮж≤їзЦЧе§ЪеПСжАІй™®йЂУзШ§дЄ≠еЫљи°Ажґ≤дЄіеЇКдЄУеЃґеЕ±иѓЖпЉИ2022еєізЙИпЉЙ [J] . дЄ≠еНОи°Ажґ≤е≠¶жЭВењЧ, 2022, 43(4) : 265-271. DOI: 10.3760/cma.j.issn.0253-2727.2022.04.001.
-
еЫљеЃґиНѓзЫСе±А. е§ЪеПСжАІй™®йЂУзШ§иНѓзЙ©дЄіеЇКиѓХй™МдЄ≠еЇФзФ®еЊЃе∞ПжЃЛзХЩзЧЕзЪДжКАжЬѓжМЗеѓЉеОЯеИЩ.2021еєі11жЬИ.
-
еЫљеЃґеНЂеБ•еІФ. жЈЛеЈізШ§иѓКзЦЧжМЗеНЧпЉИ2022еєізЙИпЉЙ.
жКАжЬѓеОЯзРЖ
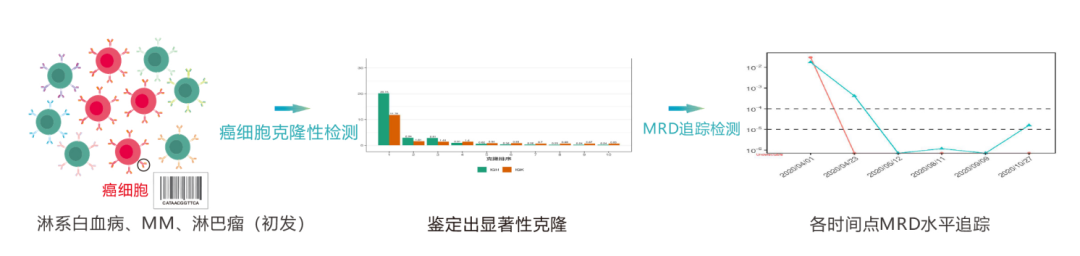
жѓПзІНB/TжЈЛеЈізїЖиГЮи°®йЭҐеЭЗе≠ШеЬ®дЄАзІНзЙєеЉВжАІBзїЖиГЮеПЧдљУ B cell receptor,BCR/la)TзїЖиГЮеПЧдљУ (T cell receptor,TCR)пЉМзФ±дЇОBCR/TCRеЫ†дЄ≠VгАБDгАБJеЯЇеЫ†зЙЗжЃµйЗНзїДдЄО祱еЯЇзЪДйЪПжЬЇжПТеЕ•гАБеИ†еЗПпЉМеѓЉиЗіBCR/TCRеЕЈжЬЙйЂШеЇ¶е§Ъж†ЈжАІзЪДзЙєзВєпЉМдїОиАМBCR/TCRеПѓдљЬдЄЇжѓПдЄ™BTжЈЛеЈізїЖиГЮеФѓдЄАзЪДеИЖе≠Рж†Зз≠ЊгАВ
жЈЛз≥їи°Ажґ≤зЩМзЧЗжВ£иАЕеЫ†BTжЈЛеЈізїЖиГЮеПСзФЯзЩМеПШпЉМзЩМзїЖиГЮзїІиАМиЗ™жИСе§Неȴ嚥жИРеЕЛйЪЖжАІеҐЮжЃЦпЉМеЫ†ж≠§пЉМйАЪињЗж£АжµЛB/TжЈЛеЈізїЖиГЮи°®йЭҐеПЧдљУBCR/TCRеПѓдї•йЙіеЃЪзЩМзїЖиГЮеєґињљиЄ™ж£АжµЛзЩМзїЖиГЮзЪДеК®жАБеПШеМЦгАВ
ж£АжµЛз±їеЮЛ
1.зЩМзїЖиГЮеЕЛйЪЖжАІж£АжµЛ
йАЪињЗжВ£иАЕеИЭиѓКжИЦзЩМзїЖиГЮйЂШиіЯиНЈжЧґзЪДй™®йЂУж†ЈжЬђпЉМжЙЊеИ∞зЩМзїЖиГЮзЙєжЬЙзЪДDNAвАЬж†Зз≠ЊвАЭеЇПеИЧгАВ
2.MRDињљиЄ™ж£АжµЛ
еИ©зФ®з≠ЫжЯ•еЗЇзЪДDNAвАЬж†Зз≠ЊвАЭеЇПеИЧпЉМеЬ®ж≤їзЦЧжЬЯйЧіжИЦж≤їзЦЧеРОиѓДдЉ∞MRDж∞іеє≥пЉМзЫСжµЛзЩМзїЖиГЮеРЂйЗПпЉМеРМжЧґж£АжµЛиѓЖеИЂжЦ∞еЗЇзО∞зЪДзЩМзїЖиГЮеЇПеИЧгАВ
йАВзФ®дЇЇзЊ§
1. Bз≥їи°Ажґ≤з≥їзїЯзЩМзЧЗ
жА•жАІ/жЕҐжАІBжЈЛеЈізїЖиГЮзЩљи°АзЧЕгАБе§ЪеПСжАІй™®йЂУзШ§гАБBеЮЛжЈЛеЈізШ§гАВ
2. Tз≥їи°Ажґ≤з≥їзїЯзЩМзЧЗ
жА•жАІ/жЕҐжАІTжЈЛеЈізїЖиГЮзЩљи°АзЧЕгАБTеЮЛжЈЛеЈізШ§гАВ
жДПдєЙ
Seq-MRD¬ЃиГљжПРдЊЫйЂШз≤ЊеЇ¶гАБйЂШзБµжХПеЇ¶зЪДMRDж£АжµЛиІ£еЖ≥жЦєж°ИпЉМеПѓеЄЃеК©еМїзФЯжЫіеЗЖз°ЃеЬ∞иѓДдЉ∞зЩМзЧЗжВ£иАЕзЪДж≤їзЦЧеПНеЇФеТМйҐДеРОгАВињЩдЇЫжКАжЬѓеЬ®зО∞дї£иВњзШ§ж≤їзЦЧдЄ≠жЙЃжЉФзЭАиґКжЭ•иґКйЗНи¶БзЪДиІТиЙ≤пЉМеЫ†дЄЇеЃГдїђиГље§ЯеЄЃеК©еМїзФЯиѓЖеИЂйВ£дЇЫжВ£зЧЕе§НеПСй£ОйЩ©йЂШзЪДжВ£иАЕпЉМеєґдЄЇдїЦдїђжПРдЊЫжЫідЄ™жАІеМЦгАБжЫіжЬЙйТИеѓєжАІзЪДж≤їзЦЧжЦєж°ИгАВ

жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљеЖЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂеЯЇеЫ†зїДе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДйЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РпЉИзЇ≥жЦѓиЊЊеЕЛдї£з†БпЉЪGTHпЉЙдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†|TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃзЦЊзЧЕжЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TиНѓзЙ©еЉАеПСз≠Йеє≥еП∞зЃ°зЇњгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВ
иЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ


