
标题:Effect of neoadjuvant chemotherapy on the immune microenvironment in gastric cancer as determined by multiplex immunofluorescence and T cell receptor repertoire analysis
通过多重免疫荧光和T细胞受体库分析,确定NAC治疗对胃癌患者免疫微环境的影响
发表期刊:Journal for ImmunoTherapy of Cancer
发表日期:2022年3月
影响因子:12.469
采集1416例在胃或食管-胃交界处行胃切除术的胃癌患者的手术标本,这些患者被分为两个队列:1075例未经术前治疗的患者(队列1)和341例接受NAC治疗的患者(队列2)。NAC队列接受基于氟尿嘧啶的治疗方案:卡培他滨/S-1+奥沙利铂(XELOX或SOX)。另一个独立队列(队列3)是30例接受NAC治疗的II/ III期胃癌患者。获得他们NAC前的活检肿瘤组织和术后组织,进行多重免疫荧光和TCR测序分析。
(2) 多重免疫荧光
(3) TCR β链测序分析:对TCRβ链的CDR3区域进行免疫测序。
(4) 统计分析
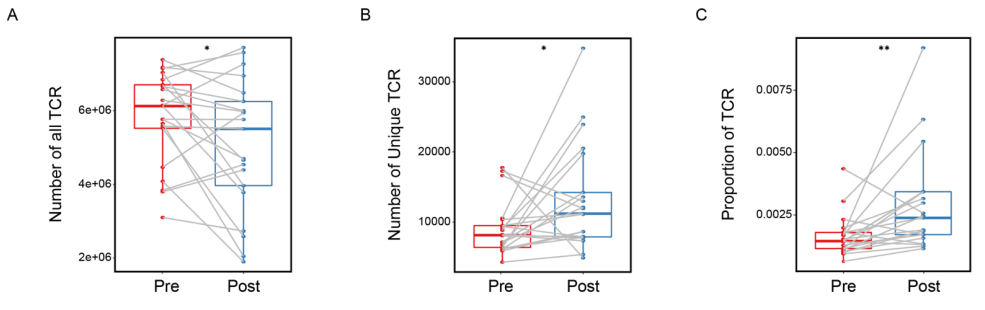
与NAC前样本相比,NAC后样本中TCR计数显著更低,但独特的TCR数量更高(图A.B)。NAC后TCR的比例显著升高,提示治疗后T细胞的多样性增加(图C)。
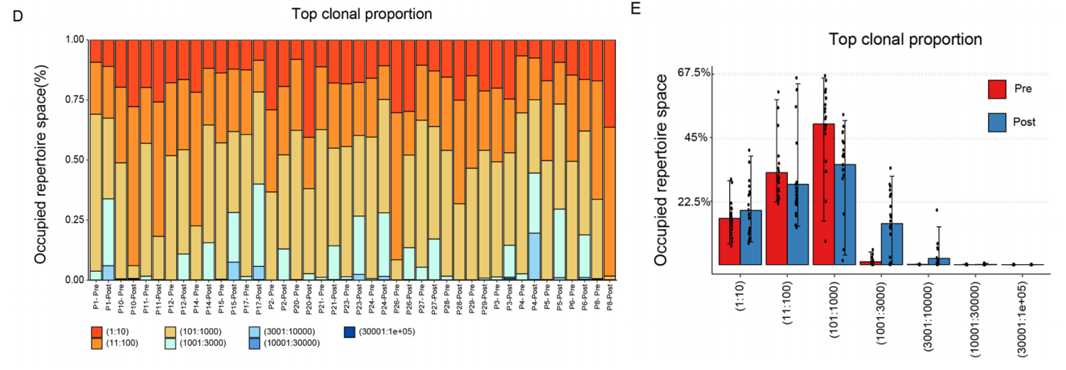
比较NAC前后TCR的分布表明,克隆扩增的T细胞有助于增加在NAC后样本中T细胞的多样性,这些细胞在化疗后被消除(图D,E)。
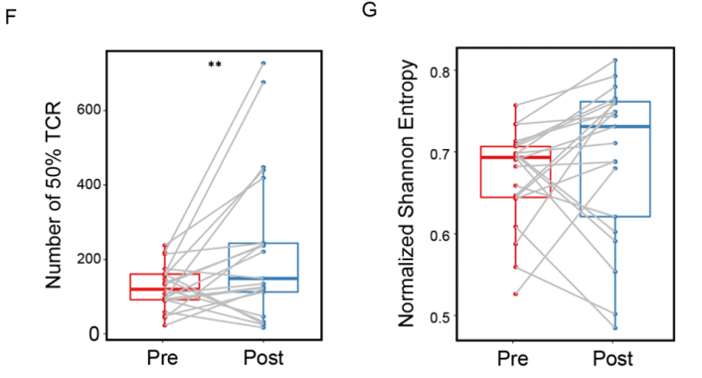
NAC后的D50指数显著高于NAC前,同时归一化Shannon熵的中位数也高于NAC前(图F,G)。
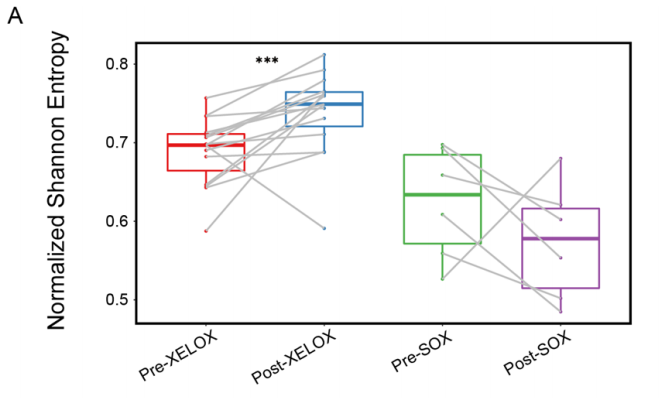
在NAC后,XELOX方案患者的归一化Shannon熵显著增加,而SOX组的TCR序列的多样性降低(如上图)。

标题:Diversity index of mucosal resident T lymphocyte repertoire predicts clinical prognosis in gastric cancer
黏膜T淋巴细胞库多样性指数预测胃癌的临床预后
发表期刊:Oncoimmunology
发表日期:2015年4月
影响因子:8.11
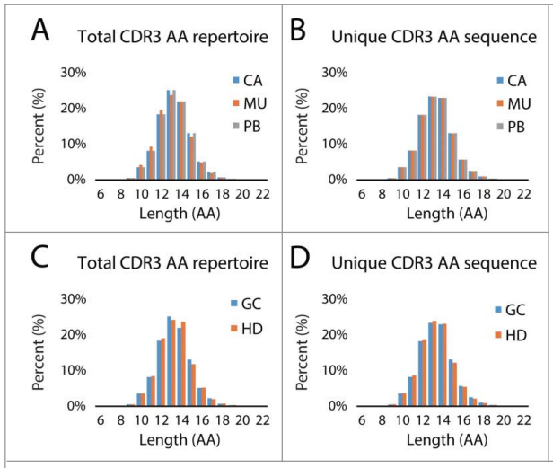
无论是考虑CDR3 AA序列的总数(图A)还是独特性(图B),胃癌患者的肿瘤组织、正常黏膜、外周血中CDR3长度分布均无显著差异。比较肿瘤患者和健康供体之间PBMC样本的CDR3长度分布,发现CDR3 AA克隆序列总数(图C)和独特性(图D)也均无显著差异。
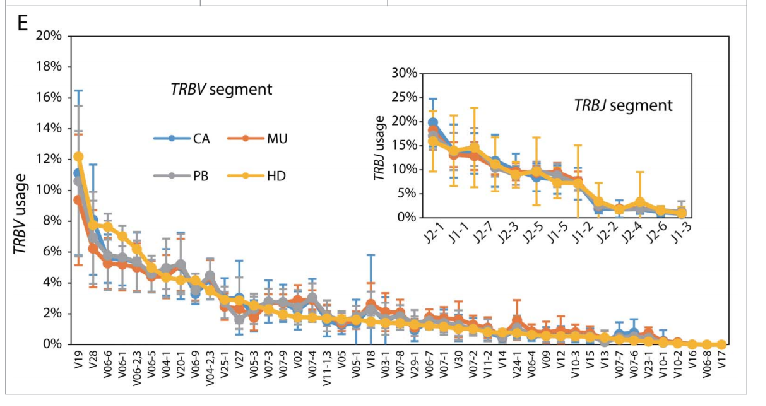
对每个样本组的V和J使用情况的详细分析发现健康供体PBMC与肿瘤患者PBMC、肿瘤浸润淋巴细胞(TIL)和粘膜t细胞之间没有特定的偏倚(图E)。
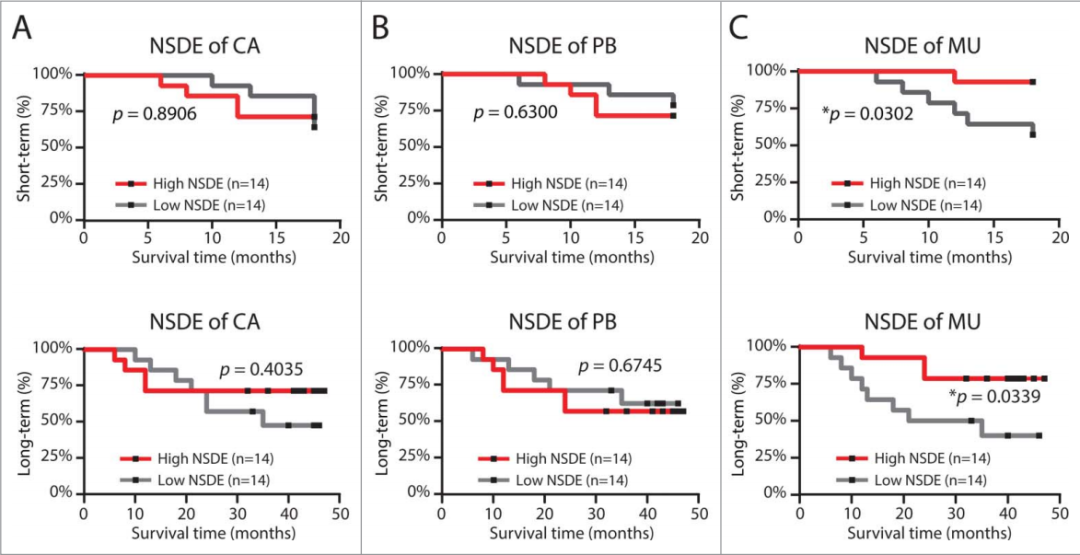
根据28例患者的随访期和TIL、外周血T细胞、黏膜T细胞的多样性对其进行了分组。以归一化的香农多样性熵NSDE的中位数作为截止值,将这28例患者分为高组和低组。发现TIL和外周血T细胞的NSDE既不影响短期(18个月随访),也不影响长期(48个月随访)的生存率(图A、B)。然而,黏膜库TCR多样性指数可以清楚地预测癌症患者的短期和长期预后:多样性指标偏低,与患者临床预后较差相关(图C)。

标题:Heterogeneity and evolution of tumour immune microenvironment in metastatic gastroesophageal adenocarcinoma
转移性胃食管腺癌中肿瘤免疫微环境的异质性和演变
发表期刊:Gastric Cancer
发表日期:2022年7月
影响因子:7.701
(2)体细胞突变检测
(3)转移性seeding分析
(4)T细胞受体测序
(5)生物信息学分析
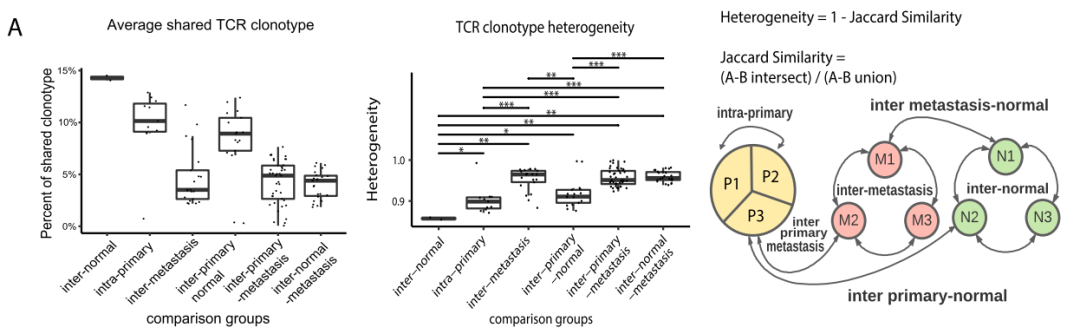
在TCR异质性方面,转移组织样本中TCR异质性最高,共享克隆最少,原发肿瘤样本之间的TCR异质性较低,平均有10%的TCR克隆型共享。共进行113项两两比较,如何进行比较的示意图如图所示(图A)。
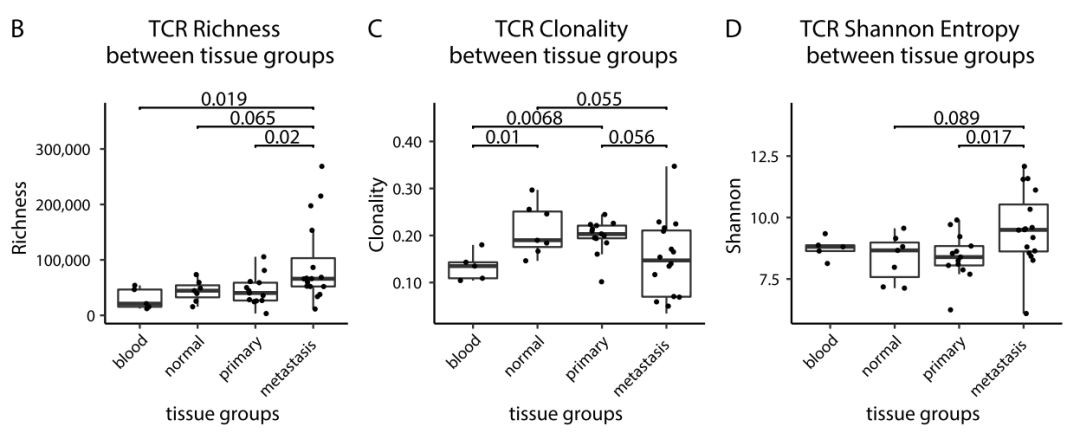
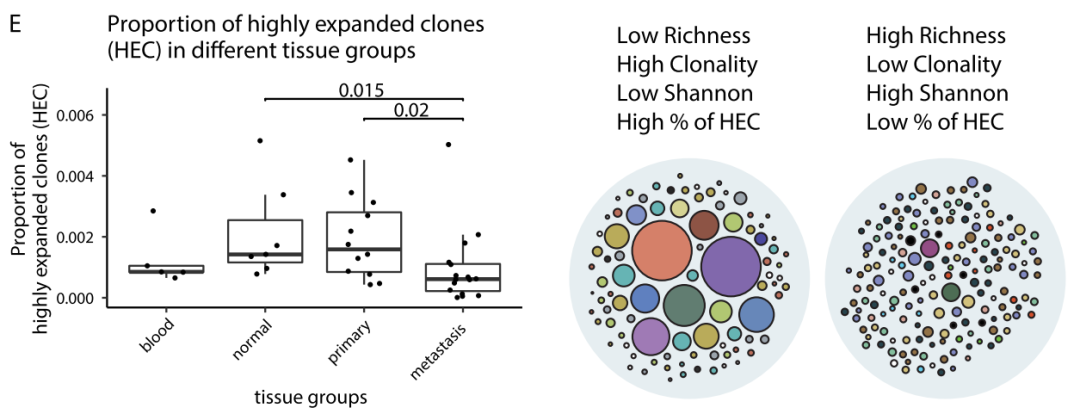
与原发肿瘤和正常胃组织相比,转移性样本具有更高的TCR丰富度(图B)和较低的克隆性(图C)、较高的Shannon熵(图D)。转移肿瘤组织样本中高扩增克隆(在一个样本中,>总TCR序列的0.1%)的比例较低(图E)。
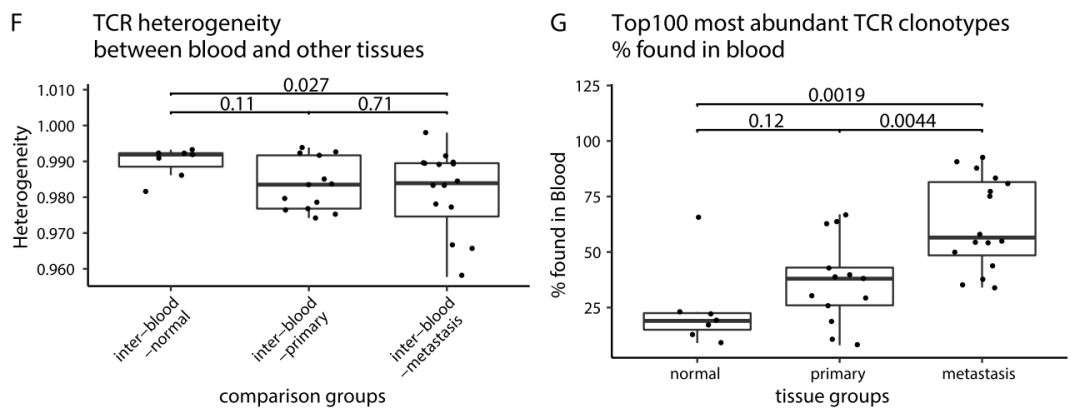
血液与正常组织、原发肿瘤组织或转移性组织之间很少有TCR克隆型共享(图F)。然而,在不同的组织样本中的TOP100 TCR克隆,转移组织与血液的共享为56.5%,高于血液和原发肿瘤、正常组织的克隆共享(图G)。

标题:Expansion of CD3+CD8+PD1+ T lymphocytes andTCR repertoire diversity predict clinical responses to adoptive cell therapy in advanced gastric cancer
CD3+CD8+PD1+ T淋巴细胞的扩增和TCR库多样性预测晚期胃癌过继性细胞疗法(ACT)临床反应的研究
发表期刊:American Journal of Cancer Research
发表日期:2022年12月
影响因子:5.942
(2)制备DC-CIK产品
(3)生成CD8+PD-1+ T细胞
(4)流式细胞仪分析和分类
(5)肿瘤识别和细胞毒性分析
(6)TCR测序:将扩增第15天的TCR V和CDR3序列多样性与初始的TCR多样性进行比较。
(7)外周血免疫细胞的表型分析
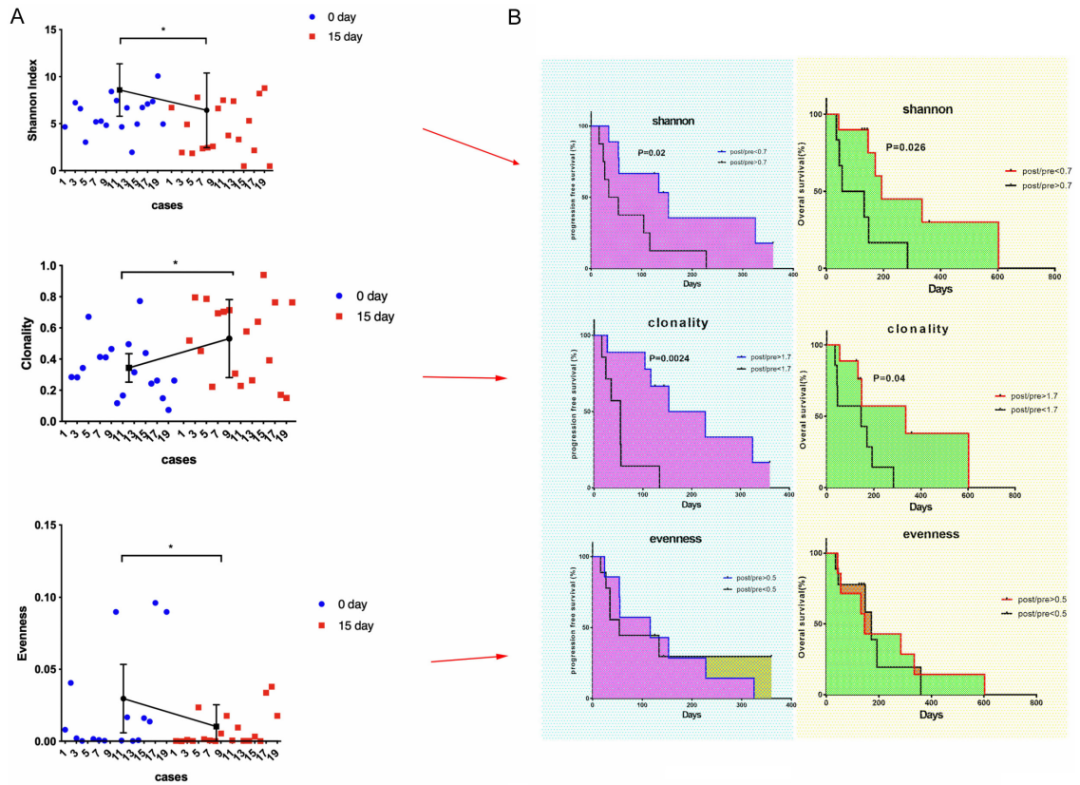
细胞培养第15天的Shannon指数较第0天显著降低,第15天的克隆性值显著增加,表明物种数量减少(图A)。在均匀度方面,第15天显著减少,表明TCR种群在第15天的异质性高于第0天(图A)。通过ROC分析得到了三个不同的截断值。后/前香农指数值<0.7的患者与≥0.7相比OS和PFS显著良好;后/前克隆值>1.7的患者OS和PFS显著良好;后/前均匀值>0.5的患者与≤0.5的患者OS或PFS无显著差异。(图B)
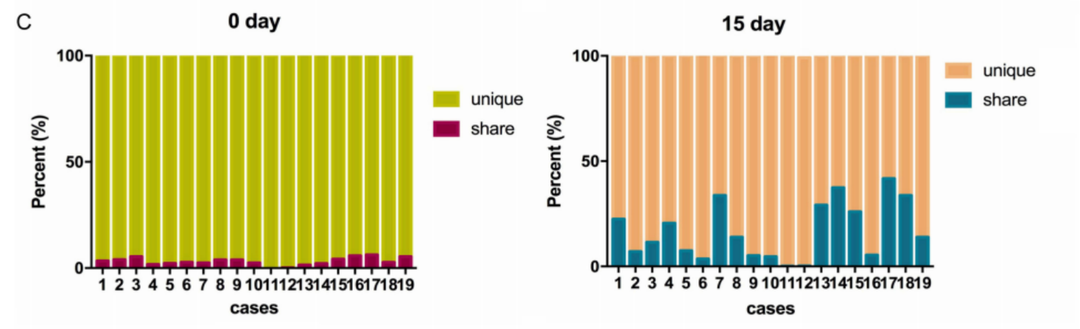
在培养15天后,共享序列的百分比显著增加(图C)。因此,能够杀死肿瘤的TCR序列是共享序列。
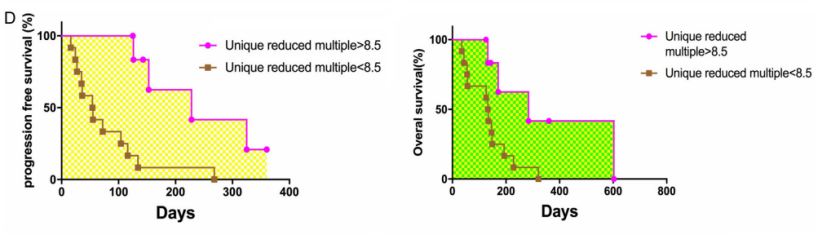
通过比较培养前后独特序列的比例和ROC曲线分析得到截止值。比较患者的PFS和OS(图D),发现独特序列减少,患者生存期改善。

标题:A novel signature for stratifying the molecular heterogeneity of the tissue-infltrating T-cell receptor repertoire refects gastric cancer prognosis
组织浸润性TCR分子异质性分层的新特征可反映胃癌的预后
发表期刊:Scientific Reports
发表日期:2017年8月
影响因子:4.996
(2)对TCRβ CDR3区域测序和数据分析
(3)基因表达微阵列
(4)识别TVI相关基因的预后价值
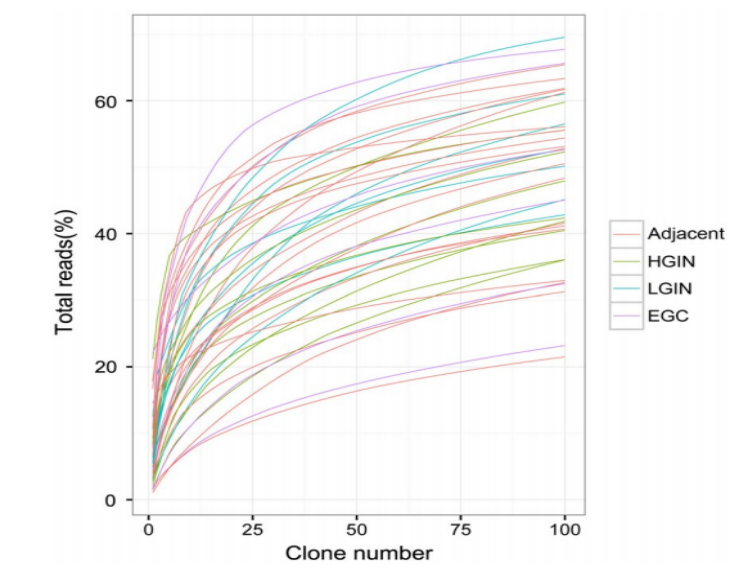
相邻粘膜、LGIN、HGIN和EGC组织的TOP100克隆的累积频率均急剧增加,所有样本的TOP100的平均累积频率几乎为50%,这表明整个TCR库主要由一小部分克隆所主导。
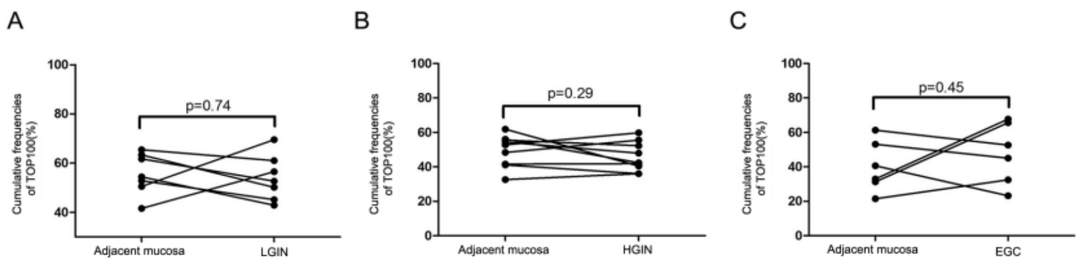
TOP100克隆的累积频率在胃病变和相邻组织之间没有明显的差异。说明在胃肿瘤发生过程中,TCR库的频率分布没有明显的变化。
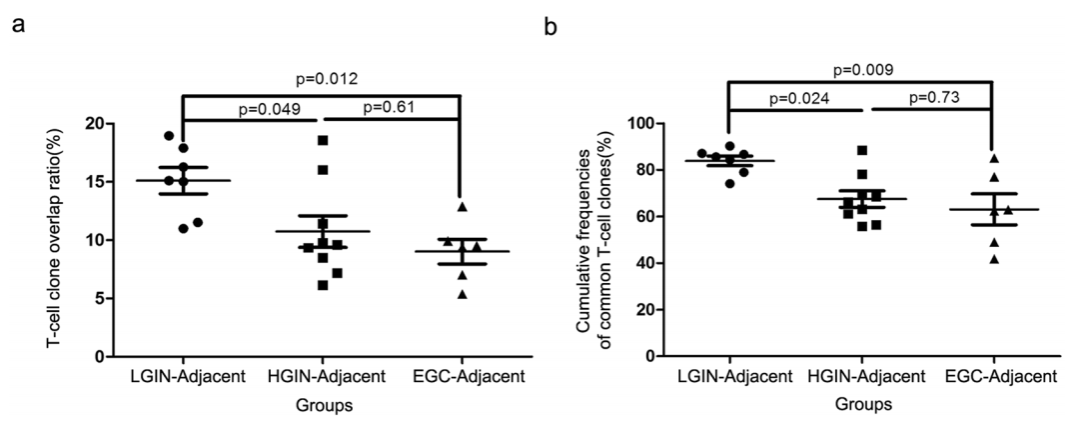
LGIN与相邻组织的t细胞克隆重叠率高于HGIN与相邻组织和EGC与相邻组织的比率(上图a)。LGIN相邻粘膜对、HGIN相邻粘膜对和EGC相邻粘膜对共享克隆的累积频率呈下降趋势(上图b)。表明在胃肿瘤发生过程中,胃病变与邻近组织之间TCR库的相似性逐渐降低。
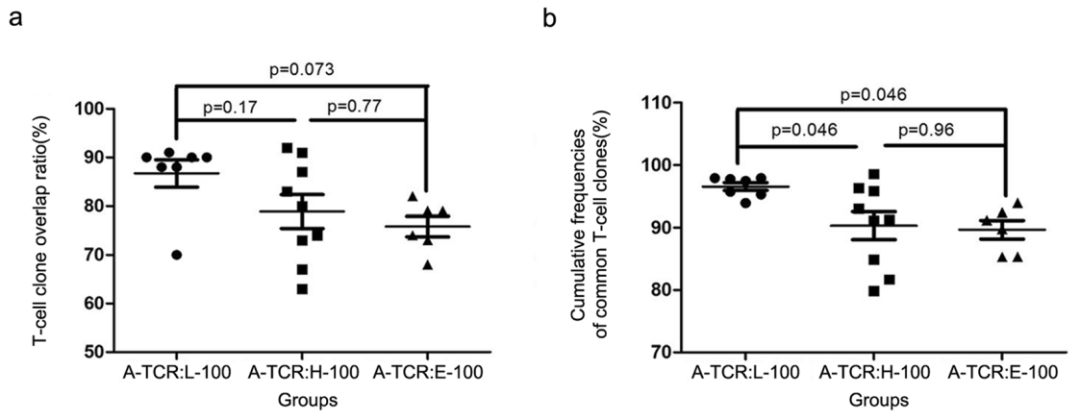
作者分析了LGIN、HGIN和EGC亚群的TOP100克隆(分别命名为L-100、H-100和E-100)与相应相邻组织的TCR库(称为A-TCR)之间的重叠率。L-100与A-TCR的平均重叠比率高于H-100与A-TCR和E-100与A-TCR的重叠比率(上图a)。随着肿瘤的疾病进展,共享克隆的平均累积频率逐渐降低。(上图b)
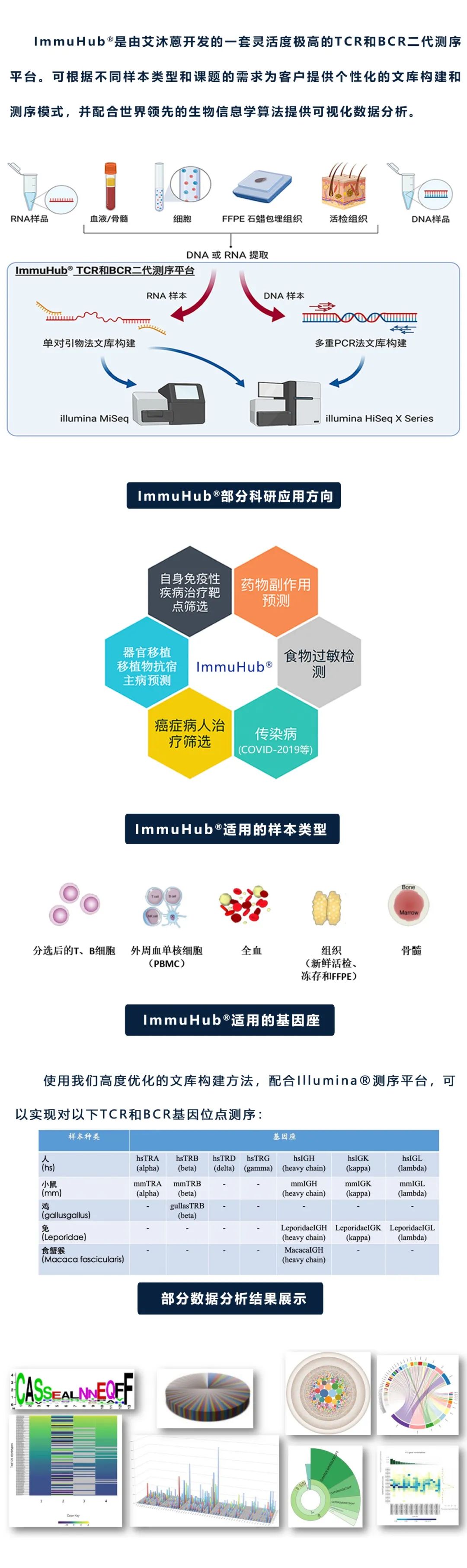
ImmuHub®技术平台是基于第二代高通量基因测序(NGS)平台利用5’RACE或多重PCR技术,使我们能直接从基因组RNA或DNA来扩增TCR/BCR的全长序列或CDR3区序列,从而进行高通量测序和数据分析。是艾沐蒽开发的一套灵活度极高的TCR/BCR二代测序平台。
ImmuHub®提供了真正捕获免疫系统所需要的深度和广度。TCR/BCR作为T/B细胞克隆的一个独特性标记,能够随着时间的变化来跟踪T细胞和B细胞,表征免疫系统的多样性,并评估反应疾病和治疗的动态情况,如免疫组测序提供的一个有价值的指标是克隆性,这是一种检测受体序列在群体中分别均匀程度的方法,可以量化免疫系统对一组特定抗原的集中程度。

什么是ImmuHub®技术?
杭州艾沐蒽生物科技有限公司由美国芝加哥大学科研团队回国创办,是一家专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展的国家高新技术企业。艾沐蒽站在适应性免疫系统研究的最前沿,自主研发的免疫医学平台可揭示和翻译适应性免疫系统的遗传密码,并能应用于癌症、自身免疫性疾病、传染性疾病等免疫介导性疾病的诊断、监测和治疗中。
