2025еєі5жЬИ5жЧ•пЉМеЬ®дЄАеЬЇиБЪзД¶и°Ажґ≤иВњзШ§з≤ЊеЗЖеМїзЦЧзЪДеЫљйЩЕе≠¶жЬѓдЇ§жµБжіїеК®дЄ≠пЉМиЙЊж≤РиТљеЫҐйШЯдЄОи•њзП≠зЙЩзЇ≥зУ¶жЛЙе§Іе≠¶ Bruno Paiva жХЩжОИе∞±е§ЪеПСжАІй™®йЂУзШ§пЉИMMпЉЙзЪДеЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛжЦєж≥ХдЄОдЄіеЇКж≤їзЦЧжХИжЮЬз≠ЙеЙНж≤њиѓЭйҐШе±ХеЉАдЇЖжЈ±еЕ•дЄФеѓМжЬЙжИРжХИзЪДдЇ§жµБгАВ


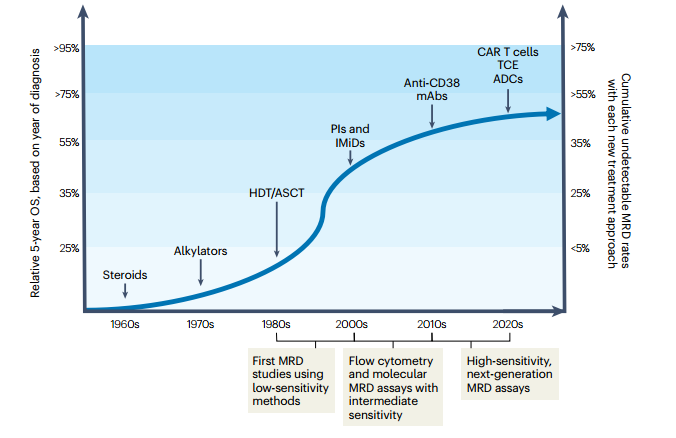
еЬ®MMдЄ≠пЉМдљњзФ®е§ІеЙВйЗПж≤їзЦЧеРОињЫи°МиЗ™дљУжИЦеЉВдљУйА†и°Аеє≤зїЖиГЮзІїж§НпЉИHSCTпЉЙиГље§ЯеЃЮзО∞жЫійЂШзЪДCRзОЗпЉМдїОиАМдњГдљњдЇЖеЬ®йАВеРИзІїж§НзЪДжВ£иАЕдЄ≠еѓєMRDињЫи°Мз†Фз©ґпЉМдї•и°®еЊБCRзЪДиі®йЗПпЉМзФ®дЇОйҐДжµЛйҐДеРОпЉИеЫЊ1пЉЙгАВжЬАеИЭпЉМMRDиѓДдЉ∞дЊЭиµЦдЇОдљОжХПжДЯжАІзЪДжКАжЬѓе¶ВдЄЙиЙ≤жИЦеЫЫиЙ≤жµБеЉПзїЖиГЮжЬѓпЉМеЕґж£АжµЛйЩРзЇ¶дЄЇ10-4гАВйЪПзЭАйЂШеЙВйЗПзЦЧж≥ХеПКиЗ™дљУйА†и°Аеє≤зїЖиГЮзІїж§НпЉИHDT/ASCTпЉЙзЪДеЉХеЕ•пЉМеЃМеЕ®зЉУиІ£зОЗжШЊиСЧжПРйЂШпЉМдњГдљњдЇЖеѓєйАВеРИзІїж§НжВ£иАЕзЪДMRDињЫи°МжЫіжЈ±еЕ•зЪДи∞ГжЯ•пЉМдї•жЫіе•љеЬ∞жППињ∞еЃМеЕ®зЉУиІ£зЪДиі®йЗПеєґзФ®дЇОйҐДеРОеИ§жЦ≠гАВињЫеЕ•21дЄЦзЇ™пЉМеЕНзЦЂи∞ГиКВиНѓзЙ©еТМиЫЛзЩљйЕґдљУжКСеИґеЙВзЪДеЇФзФ®ињЫдЄАж≠•жПРеНЗдЇЖеЃМеЕ®зЉУиІ£зОЗпЉМжО®еК®дЇЖMRDз†Фз©ґеЬ®дЄНйАВеРИзІїж§НжВ£иАЕдЄ≠зЪДжЙ©е±ХгАВињЗеОїзЪДеЗ†еНБеєіпЉМйЪПзЭАжЦ∞еЮЛж≤їзЦЧжЦєж≥Хе¶ВжКЧCD38еНХеЕЛйЪЖжКЧдљУгАБжКЧBCMAжКЧдљУ-иНѓзЙ©еБґиБФзЙ©дї•еПКйЭґеРСBCMAзЪДCAR-TзїЖиГЮз≠ЙзЪДеПСе±ХпЉМMRDж£АжµЛжКАжЬѓдєЯеЊЧеИ∞дЇЖйЭ©жЦ∞пЉМзЙєеИЂжШѓдЄЛдЄАдї£жµБеЉПзїЖиГЮжЬѓпЉИNGFпЉЙеТМдЄЛдЄАдї£жµЛеЇПпЉИNGSпЉЙпЉМињЩдЇЫжКАжЬѓиГље§ЯеЃЮзО∞вЙ§10-5зЪДж£АжµЛйЩРпЉМеЬ®иґЕињЗ90%зЪДж†ЈжЬђдЄ≠иЊЊеИ∞жЧ†ж≥Хж£АжµЛзЪДMRDж∞іеє≥гАВ
 еЫЊ1
еЫЊ1
ељУеЙНзЪДиґЛеКњжШѓеИ©зФ®ињЩдЇЫйЂШзБµжХПеЇ¶зЪДMRDж£АжµЛжЦєж≥ХдљЬдЄЇеК†йАЯж≤їзЦЧжЙєеЗЖзЪДзїИзВєдєЛдЄАпЉМеєґдЄФиґКжЭ•иґКе§ЪзЪДз†Фз©ґи°®жШОпЉМжМБдєЕзЪДMRDйШіжАІзКґжАБдЄОMMжВ£иАЕзФЯе≠ШжЬЯеїґйХњжШЊиСЧзЫЄеЕ≥пЉИи°®1пЉЙгАВ
MMдЄ≠MRDж£АжµЛзЪДжЦєж≥Х

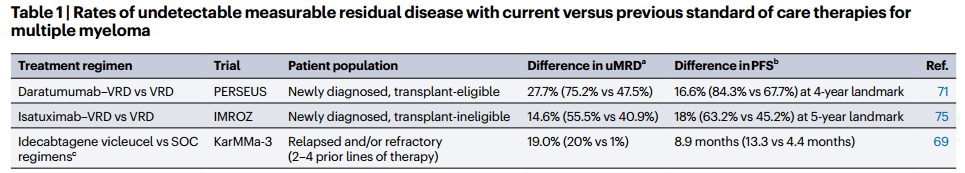
еЯЇдЇОNGSзЪДMRDж£АжµЛйАЪињЗиѓЖеИЂеТМеЃЪйЗПеЕНзЦЂзРГиЫЛзЩљйЗНйУЊеТМиљїйУЊеЯЇеЫ†йЗНжОТжЭ•ињљиЄ™жЃЛзХЩиВњзШ§зїЖиГЮгАВж£АжµЛеЙНйЬАйЗЗйЫЖйЂШиВњзШ§иіЯиНЈж†ЈжЬђдї•з°ЃеЃЪеЕЛйЪЖзЙєеЉВжАІеЇПеИЧпЉМзФ®дЇОеРОзї≠зЫСжµЛгАВзЇ¶95%зЪДжВ£иАЕеЬ®ж≤їзЦЧеЙНеПѓиОЈеЊЧжШОз°ЃзЪДеЕЛйЪЖеЇПеИЧгАВеЉАеПСNGSдЄЇеЯЇз°АзЪДж£АжµЛжЦєж≥ХжШѓдЄЇдЇЖеЕЛжЬНдЉ†зїЯPCRжЦєж≥ХзЪДеЇФзФ®е±АйЩРпЉМе¶ВиЊГдљОзЪДйАВзФ®жАІпЉМеєґеЃЮзО∞дЇЖеЗ†дєОеЬ®жЙАжЬЙж†ЈжЬђдЄ≠зЪДйЂШзБµжХПеЇ¶пЉИеПѓиЊЊ10-5жИЦжЫійЂШпЉЙгАВж≠§е§ЦпЉМзЊОеЫљFDAеЈ≤жЙєеЗЖclonoSEQ NGSж£АжµЛзФ®дЇОBзїЖиГЮжБґжАІиВњзШ§пЉИеМЕжЛђе§ЪеПСжАІй™®йЂУзШ§пЉЙзЪДMRDиѓДдЉ∞гАВNGSзЪДдЄАдЄ™йЗНи¶БдЉШеКњеЬ®дЇОеЃГжЧҐеПѓдї•дљњзФ®жЦ∞й≤Ьж†ЈжЬђдєЯеПѓдї•дљњзФ®еЖїе≠Шж†ЈжЬђињЫи°МеИЖжЮРпЉМдљњеЕґжИРдЄЇе§ІиІДж®°гАБеЫљйЩЕжИЦе§ЪдЄ≠ењГдЄіеЇКиѓХй™МдЄ≠MRDеИЖжЮРзЪДзРЖжГ≥йАЙжЛ©гАВињЩдЇЫз†Фз©ґдЊЭиµЦдЇОж†ЈжЬђе≠ШеВ®еТМжЙєйЗПе§ДзРЖпЉМиАМйЂШиі®йЗПгАБж†ЗеЗЖеМЦзЪДMRDжХ∞жНЃзЪДзФЯжИРеѓєMRDйШіжАІдљЬдЄЇжЧ©жЬЯиѓХй™МзїИзВєзЪДиЃ§еПѓиЗ≥еЕ≥йЗНи¶БпЉМиѓ•зїИзВєжФѓжМБжЦ∞зЦЧж≥ХеК†йАЯеЃ°жЙєињЗз®ЛдЄ≠зЪДеЇФзФ®гАВ
жµБеЉПзїЖиГЮжЬѓпЉИFlow CytometryпЉЙжШѓжЬАжЧ©зФ®дЇОеЊЃе∞ПжЃЛзХЩзЧЕзБґпЉИMRDпЉЙиѓДдЉ∞зЪДжКАжЬѓдєЛдЄАпЉМеєґдЄАзЫіж≤њзФ®иЗ≥дїКгАВйЪПзЭАжКАжЬѓзЪДеПСе±ХпЉМиѓ•жЦєж≥ХдїОжЧ©жЬЯзЪДDNAеАНдљУеИЖжЮРеТМдЄЙиЙ≤жИЦеЫЫиЙ≤иНІеЕЙж†ЗиЃ∞пЉМйАРж≠•жЉФињЫдЄЇдљњзФ®еЕ≠иЙ≤гАБеЕЂиЙ≤зФЪиЗ≥еНБиЙ≤жКЧдљУзїДеРИзЪДе§ЪеПВжХ∞еЕНзЦЂи°®еЮЛеИЖжЮРпЉМеРМжЧґдЉійЪПзЭАдї™еЩ®дЄОиѓХеЙВзЪДдЄНжЦ≠дЉШеМЦгАВе∞љзЃ°PCRеТМNGSеЬ®зБµжХПеЇ¶жЦєйЭҐйАЪеЄЄдЉШдЇОдЉ†зїЯзЪДе∞СиЙ≤жµБеЉПж£АжµЛжЦєж≥ХпЉМдљЖжЦ∞дЄАдї£зЪДж†ЗеЗЖеМЦжµБеЉПжКАжЬѓвАФвАФе¶ВEuroFlowиБФзЫЯеЉАеПСзЪДеЕЂиЙ≤дЄ§зЃ°вАЬж†ЗеЗЖеМЦдЄЛдЄАдї£жµБеЉПпЉИNGFпЉЙвАЭжЦєж≥ХпЉМеЈ≤е∞ЖзБµжХПеЇ¶жПРеНЗиЗ≥ 2√Ч10-6пЉМдЄОNGSзЫЄељУпЉМеЕЈе§ЗдЇЖеЬ®дЄіеЇКиѓХй™МеТМеЄЄиІДеЃЮиЈµдЄ≠еєњж≥ЫеЇФзФ®зЪДжљЬеКЫпЉМеєґж≠£еЬ®жО®ињЫзЫСзЃ°еЃ°жЙєгАВеЕґдЉШеКњпЉЪ
-
ж£АжµЛеС®жЬЯзЯ≠пЉИзЇ¶24е∞ПжЧґпЉЙпЉЫ
-
еПѓиѓДдЉ∞й™®йЂУз®АйЗКз®ЛеЇ¶пЉМйБњеЕНеЫ†ж†ЈжЬђдЄНеЕЈдї£и°®жАІиАМеѓЉиЗізЪДеБЗйШіжАІзїУжЮЬпЉЫ
-
жЧ†йЬАж≤їзЦЧеЙНж†ЈжЬђеН≥еПѓиѓЖеИЂеЉВеЄЄи°®еЮЛзЪДеЕЛйЪЖжАІжµЖзїЖиГЮпЉМжПРйЂШдЇЖеЃЮзФ®жАІгАВ
е§ЦеС®жЃЛзХЩзЦЊзЧЕзЪДеИЖжЮР

MRDпЉИеЊЃе∞ПжЃЛзХЩзЧЕзБґпЉЙеК®жАБеПШеМЦеѓєе§ЪеПСжАІй™®йЂУзШ§пЉИMMпЉЙжВ£иАЕзЪДзФЯе≠ШзїУе±АеЕЈжЬЙжШОз°ЃдЄФжШЊиСЧзЪДељ±еУНгАВе∞љзЃ°жМБзї≠зЪДMRDзЉУиІ£зКґжАБеЬ®йАїиЊСдЄК襀聧䪯еЕЈжЬЙйЗНи¶БжДПдєЙпЉМзФ±дЇОжЧ©жЬЯзЪДз†Фз©ґдїЕйЩРдЇОињЫи°МдЄАеИ∞дЄ§жђ°зЪДMRDиѓДдЉ∞пЉМжЙАдї•еЕґдїЈеАЉзЫіеИ∞ињСжЬЯжЙН襀ж≠£еЉПз°ЃзЂЛгАВзЫЃеЙНеПСзО∞пЉМдЄОжЬАжЬЙжДПдєЙзЪДеПШеМЦжШѓеЬ®зїіжМБж≤їзЦЧжЬЯйЧіпЉИдЊЛе¶ВдїОMRDжЧ†ж≥Хж£АжµЛзКґжАБиљђеПШдЄЇеПѓж£АжµЛзКґжАБпЉЙгАВињЩи°®жШОдЄОдЉ†зїЯзЪДзЦЧжХИиѓДдЉ∞ж†ЗеЗЖз±їдЉЉпЉМMRDдєЯйЬАи¶БеЃЪжЬЯзЫСжµЛпЉМжЙНиГљжЫіеЗЖз°ЃеЬ∞йҐДжµЛжВ£иАЕзЪДзФЯе≠ШзїУжЮЬгАВеЬ®дЄіеЇКиѓХй™МдЄ≠пЉМйҐСзєБзЪДMRDж£АжµЛеЈ≤жИРдЄЇеЄЄиІДпЉЫдљЖеЬ®жЧ•еЄЄдЄіеЇКеЃЮиЈµдЄ≠пЉМзФ±дЇОйЬАи¶БеПНе§НињЫи°Мй™®йЂУз©њеИЇпЉМе∞§еЕґеѓєдЇОеєіиАБдљУеЉ±зЪДжВ£иАЕиАМи®АпЉМињЩзІНжЦєеЉПеЊАеЊАеЄ¶жЭ•дЄНйАВгАВеЫ†ж≠§пЉМдЇЇдїђиґКжЭ•иґКеЕ≥ж≥®йАЪињЗиЊГеЊЃеИЫзЪДжЦєеЉПеЬ®е§ЦеС®и°АдЄ≠иѓДдЉ∞жЃЛзХЩзЦЊзЧЕгАВе§ЦеС®и°АдЄ≠зЪДжЃЛзХЩзЦЊзЧЕеЬ®зФЯзЙ©е≠¶еТМдЄіеЇКжДПдєЙдЄКеПѓиГљдЄОй™®йЂУдЄ≠зЪДMRDжЬЙжЙАдЄНеРМпЉМеЫ†ж≠§еЇФдЇИдї•еМЇеИЖпЉМ庴襀зІ∞дЄЇвАЬPRDвАЭгАВ
еЯЇдЇОж£АжµЛеЕЛйЪЖеЮЛV(D)JйЗНжОТжИЦдљУзїЖиГЮз™БеПШпЉМе§ЦеС®и°АDNAзЪДNGSеПѓзФ®дЇОжЭ•зЫСжµЛPRDпЉМеПѓеПНжШ†CTCsеТМ/жИЦй™®йЂУзШ§зїЖиГЮжЭ•жЇРзЪДеЊ™зОѓжЄЄз¶їDNAпЉИcfDNAпЉЙзЪДе≠ШеЬ®гАВеЬ®дЄАй°єе§ЪдЄ≠ењГгАБеЙНзЮїжАІгАБиІВеѓЯжАІз†Фз©ґдЄ≠пЉМз†Фз©ґдЇЇеСШиѓДдЉ∞дЇЖеЬ®жО•еПЧIxazomibпЉИдЉКж≤ЩдљРз±≥пЉЙгАБжЭ•йВ£еЇ¶иГЇеТМеЬ∞е°Юз±≥жЭЊиБФеРИж≤їзЦЧзЪДе§НеПС/йЪЊж≤їжАІе§ЪеПСжАІй™®йЂУзШ§пЉИRRMMпЉЙжВ£иАЕдЄ≠пЉМдљњзФ®cfDNAзЪДNGSзЫСжµЛдЄОMMеЄЄиІБзЫЄеЕ≥еЯЇеЫ†з™БеПШзЪДдїЈеАЉгАВз†Фз©ґеПСзО∞пЉМеЬ®еНХеЫ†зі†еИЖжЮРдЄ≠иѓЖеИЂеЗЇзЪДеЕ≠дЄ™жЬАеЕ≥йФЃеЯЇеЫ†пЉИKRASгАБTP53гАБDIS3гАБBRAFгАБNRASеТМATMпЉЙдЄ≠жЙАж£АжµЛеИ∞зЪДз™БеПШжАїжХ∞пЉМдЄОиЊГеЈЃзЪДжЧ†ињЫе±ХзФЯе≠ШжЬЯпЉИPFSпЉЙжШЊиСЧзЫЄеЕ≥пЉЪжЬ™ж£АжµЛеИ∞з™БеПШгАБ1дЄ™з™БеПШгАБдї•еПК2дЄ™еПКдї•дЄКз™БеПШжВ£иАЕзЪД2еєіPFSеИЖеИЂдЄЇ57.3%гАБ22.7%еТМ0%пЉМињЩдЄАйҐДеРОеЈЃеЉВзЛђзЂЛдЇОдЄіеЇКеЫ†зі†еТМcfDNAжµУеЇ¶гАВзДґиАМпЉМе∞ЪдЄНжЄЕж•ЪеЬ®дЄАзЇњж≤їзЦЧдЄ≠пЉИжЃЛзХЩзЦЊзЧЕиіЯжЛЕйАЪеЄЄиЊГдљОпЉЙжШѓеР¶иГљйАЪињЗиѓ•жЦєж≥ХиОЈеЊЧзЫЄеРМзЪДйҐДеРОдїЈеАЉгАВ
жМСжИШеТМжЬЇйБЗ

еѓєдЇОе§ЪеПСжАІй™®йЂУзШ§пЉИMMпЉЙжВ£иАЕпЉМжМБзї≠е≠ШеЬ®еЊЃе∞ПжЃЛзХЩзЧЕзБґпЉИMRDпЉЙиАМе§ЦеС®и°АдЄ≠жЧ†ж≥Хж£АжµЛеИ∞еПѓжµЛйЗПжЃЛзХЩзЦЊзЧЕпЉИPRDпЉЙзЪДжГЕеЖµпЉМеЕґжЧ†ињЫе±ХзФЯе≠ШжЬЯпЉИPFSпЉЙиЊГеПМйШіжАІзїУжЮЬзЪДжВ£иАЕжЫіеЈЃгАВињЩжДПеС≥зЭАеЬ®й™®йЂУдЄ≠жМБзї≠е≠ШеЬ®MRDзЪДжВ£иАЕдЄ≠пЉМзЇ¶20%-30%еПѓиГљдЉЪеЗЇзО∞еБЗйШіжАІзЪДPRDзїУжЮЬгАВ
1.жМСжИШ
-
еБЗйШіжАІзїУжЮЬпЉЪељУеЙНжКАжЬѓжЭ°дїґдЄЛпЉМеѓєдЇОйВ£дЇЫеЬ®й™®йЂУдЄ≠дїНиГљж£АжµЛеИ∞MRDзЪДжВ£иАЕпЉМе¶ВжЮЬдїЕдЊЭиµЦдЇОPRDж£АжµЛпЉМеИЩеПѓиГљеѓЉиЗійФЩиѓѓзЪДеЃЙеЕ®жДЯпЉМеЫ†дЄЇињЩдЇЫжВ£иАЕзЪДйҐДеРОеЃЮйЩЕдЄКеєґдЄНдєРиІВгАВ
-
ж£АжµЛзБµжХПеЇ¶пЉЪдЄЇдЇЖеЗПе∞СеБЗйШіжАІPRDзїУжЮЬзЪДеПСзФЯпЉМйЬАи¶БеЉАеПСжЫіеК†жХПжДЯзЪДжЦєж≥ХжЭ•зЫСжµЛе§ЦеС®и°АдЄ≠зЪДжЃЛзХЩзЦЊзЧЕгАВ
-
ж†ЈжЬђз±їеЮЛзЪДйАЙжЛ©пЉЪе∞љзЃ°й™®йЂУз©њеИЇжШѓзЫЃеЙНиѓДдЉ∞зЦЧжХИзЪДйЗСж†ЗеЗЖпЉМдљЖињЩзІНжЦєж≥ХеѓєжВ£иАЕжЭ•иѓіиЊГдЄЇзєБзРРдЄФдЄНйАВпЉМзЙєеИЂжШѓеЬ®ж≤їзЦЧзЪДжЧ©жЬЯжИЦеЉЇеМЦйШґжЃµгАВ
2.жЬЇйБЗ
-
жЫіжХПжДЯзЪДжКАжЬѓпЉЪйЪПзЭАе¶ВйАЪињЗBloodFlowињЫи°МзЪДеЊ™зОѓиВњзШ§зїЖиГЮпЉИCTCпЉЙеИЖжЮРгАБе§Ъж®°еЉПPRDиѓДдЉ∞пЉИдЊЛе¶ВNGFжИЦBloodFlowиБФеРИиі®и∞±ж£АжµЛпЉЙзЪДеПСе±ХпЉМдї•еПКеѓєеЕґдїЦеЊ™зОѓиВњзШ§зФЯзЙ©ж†ЗењЧзЙ©пЉИеМЕжЛђеПѓжЇґжАІBCMAпЉЙзЪДз†Фз©ґпЉМжЬЙжЬЫжШЊиСЧжПРйЂШPRDж£АжµЛзЪДеЗЖз°ЃжАІпЉМеЗПе∞СеБЗйШіжАІзїУжЮЬзЪДеПСзФЯгАВ
-
еК®жАБзЫСжµЛзЪДеПѓиГљжАІпЉЪPRDиѓДдЉ∞еПѓиГљдљњMMж≤їзЦЧзЦЧжХИзЪДзЫСжµЛеПШеЊЧжЫіеК†еК®жАБеТМдЄНйВ£дєИзєБзРРпЉМе∞§еЕґжШѓеЬ®зїіжМБж≤їзЦЧжЬЯйЧіжИЦиІВеѓЯжЬЯеЖЕпЉМеПѓдї•йАЪињЗжЫійҐСзєБзЪДPRDж£АжµЛйГ®еИЖжЫњдї£й™®йЂУз©њеИЇгАВ
-
жЧ©жЬЯеє≤йҐДзЪДжЬЇдЉЪпЉЪз†Фз©ґи°®жШОпЉМеЬ®й™®йЂУдЄ≠ж£АжµЛеИ∞MRDзЪДжВ£иАЕдЄ≠пЉМиЛ•еРМжЧґеЬ®е§ЦеС®и°АдЄ≠еПСзО∞PRDпЉМињЩеПѓиГљжШѓеН≥е∞ЖеПСзФЯзЦЊзЧЕињЫе±ХзЪДдЄАдЄ™йҐДи≠¶дњ°еПЈгАВеЫ†ж≠§пЉМеЬ®иАГиЩСеѓєињЩз±їжВ£иАЕињЫи°МжЧ©жЬЯеє≤йҐДжЧґпЉМињЫдЄАж≠•жΥ糥PRDзЪДзФЯзЙ©е≠¶жДПдєЙжШЊеЊЧе∞§дЄЇйЗНи¶БгАВ
MRDеТМPRDж£АжµЛзЪДзЃЧж≥Х

йЙідЇОйАВеРИзІїж§НзЪДNDMMжВ£иАЕзЪДжЦ∞ж†ЗеЗЖж≤їзЦЧжЦєж°ИзЪД4еєіPFSзЇ¶дЄЇ85%пЉМдЄ≠дљНPFSеПѓиГљиЊЊеИ∞10еєіжИЦжЫідєЕпЉМзРЖжГ≥жГЕеЖµзЪДж≤їзЦЧеЇФдЄЇеЫЇеЃЪжЬЯйЩРпЉМе∞§еЕґжШѓеѓєдЇОиЊЊеИ∞MRDжМБзї≠жЧ†ж≥Хж£АжµЛдЄФж≤°жЬЙMRDиљђйШ≥йХњжЬЯй£ОйЩ©еЫ†зі†зЪДжВ£иАЕгАВеЫ†ж≠§йЬАи¶БйҐСзєБињЫи°МMRDж£АжµЛпЉМзДґиАМпЉМйҐСзєБињЫи°МMRDж£АжµЛзЪДеЃЮйЩЕжУНдљЬе≠ШеЬ®жМСжИШпЉМзЙєеИЂжШѓеЬ®йХњжЧґйЧіеЖЕйЪЊдї•йҐСзєБиОЈеПЦй™®йЂУж†ЈжЬђзЪДжГЕеЖµдЄЛгАВеЫ†ж≠§пЉМзїУеРИй™®йЂУдЄ≠зЪДMRDиѓДдЉ∞дЄОйЂШзБµжХПеЇ¶гАБеК®жАБеТМеЊЃеИЫзЪДе§ЦеС®и°АеПѓжµЛйЗПжЃЛзХЩзЦЊзЧЕпЉИPRDпЉЙиѓДдЉ∞жШЊеЊЧе∞§дЄЇйЗНи¶БгАВдЄЇж≠§пЉМз†Фз©ґжПРеЗЇдЇЖдЄАзІНиѓДдЉ∞зЃЧж≥ХпЉЪ
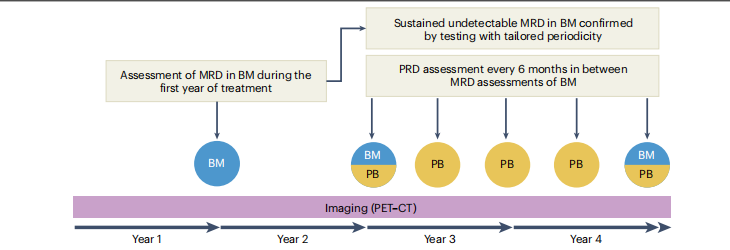
еЬ®ж≤їзЦЧзЪДзђђдЄАеєіеЖЕпЉМдї•й™®йЂУз©њеИЇж†ЈжЬђдЄ≠зЪДMRDиѓДдЉ∞дљЬдЄЇж†ЗеЗЖжЦєж≥ХпЉМињЩзђ¶еРИељУеЙНзФ®дЇОжФѓжМБжЦ∞зЦЧж≥ХеК†йАЯеЃ°жЙєзЪДвАЬMRDйШіжАІеЃМеЕ®зЉУиІ£вАЭзїИзВєгАВеЬ®ж≤їзЦЧзђђдЄАеєіеЖЕпЉМзФ±дЇОе§Іе§ЪжХ∞жВ£иАЕзЪДMRDзКґжАБдЄЇйШіжАІпЉМPRDиѓДдЉ∞зЪДдїЈеАЉзЫЄеѓєжЬЙйЩРпЉМдљЖеПѓдї•иАГиЩСдљњзФ®иі®и∞±ж≥ХпЉИMSпЉЙпЉМеРМжЧґж≥®жДПйБњеЕНеБЗйШ≥жАІзїУжЮЬгАВ
еѓєдЇОеЬ®ж≤їзЦЧеИЭжЬЯеЃЮзО∞MRDйШіжАІзЪДжВ£иАЕпЉМеїЇиЃЃеЃЪжЬЯпЉИдЊЛе¶ВпЉМеЬ®й¶Цжђ°MRDйШіжАІзїУжЮЬеРОзЪДжѓП24дЄ™жЬИпЉЙз°ЃиЃ§еЕґMRDзКґжАБпЉМпЉМдЄЇдЇЖйБњеЕНеЬ®иЊГзЯ≠жЧґйЧіеЖЕињЫи°Ме§Ъжђ°й™®йЂУз©њеИЇпЉМеїЇиЃЃжѓПдЄ§еєіињЫи°МдЄАжђ°й™®йЂУMRDиѓДдЉ∞еєґзїУеРИжѓП6дЄ™жЬИдЄАжђ°зЪДе§ЦеС®и°АPRDиѓДдЉ∞пЉИйАЪињЗMSгАБNGFжИЦNGSпЉЙгАВе¶ВжЮЬPRDжМБзї≠йШіжАІпЉМеИЩеПѓиГљжДПеС≥зЭАMRDдїНе§ДдЇОйШіжАІзКґжАБпЉЫиЛ•PRDеЗЇзО∞еЫЮеНЗпЉМеИЩиЗ™еК®иІЖдЄЇMRDйШіжАІдЄІе§±зЪДж†ЗењЧпЉМжЧ†йЬАеЖНжђ°й™®йЂУз©њеИЇз°ЃиЃ§гАВ
ељУеЙНеТМжЬ™жЭ•MRDзЦЧжХИж†ЗеЗЖ

зЫЃеЙНдЄ•ж†ЉеЃМеЕ®зЉУиІ£пЉИsCRпЉЙзЪДдїЈеАЉе≠ШеЬ®дЇЙиЃЃгАВ2016еєіеЫљйЩЕй™®йЂУзШ§еЈ•дљЬзїДпЉИIMWGпЉЙжПРеЗЇдЇЖеЕ≥дЇОеУНеЇФеТМMRDиѓДдЉ∞зЪДжЦ∞ж†ЗеЗЖпЉМеЃЪдєЙдЇЖеПВиАГжЦєж≥ХеПКжЬАдљОзБµжХПеЇ¶йШИеАЉпЉМдљњMRDиѓДдЉ∞ж†ЗеЗЖеМЦеєґжИРдЄЇдЄіеЇКиѓХй™МзЪДйЗНи¶БзїИзВєгАВж≠§е§ЦпЉМињШеИґеЃЪдЇЖеЫљйЩЕеЕ±иѓЖеїЇиЃЃдї•иІДиМГMRDжХ∞жНЃзЪДиѓДдЉ∞еТМжК•еСКгАВжЬАињСпЉМMRDйШіжАІCRдљЬдЄЇжФѓжМБеК†йАЯжЙєеЗЖMMж≤їзЦЧзЪДдЄАдЄ™жЧ©жЬЯзїИзВєпЉМеЉЇи∞ГдЇЖйЂШиі®йЗПж†ЗеЗЖеМЦMRDжХ∞жНЃзЪДйЗНи¶БжАІгАВе∞љзЃ°жЫіжЈ±зЪДеПНеЇФйАЪеЄЄдЄОжЫійХњзЪДзФЯе≠ШжЬЯзЫЄеЕ≥пЉМдљЖеЬ®еИЭж≤їзОѓеҐГдЄ≠пЉМдЄАдЇЫжЬ™иЊЊеИ∞CRдљЖж£АжµЛдЄНеИ∞MRDзЪДжВ£иАЕпЉМеЕґзФЯе≠ШзїУжЮЬдЄОMRDйШіжАІCRжВ£иАЕзЫЄдЉЉгАВиАМеЬ®е§НеПС/йЪЊж≤їжАІMMпЉИRRMMпЉЙжВ£иАЕдЄ≠пЉМCRзКґжАБеѓєзФЯе≠ШзїУжЮЬзЪДељ±еУНжЫідЄЇжШЊиСЧгАВеЫ†ж≠§пЉМжЬ™жЭ•зЪДеУНеЇФж†ЗеЗЖеЇФзїіжМБCRи¶Бж±ВжЭ•еЃЪдєЙMRDйШіжАІпЉМеРМжЧґзБµжіїеЬ∞жК•еСКжЧ†иЃЇCRзКґжАБе¶ВдљХзЪДMRDйШіжАІеУНеЇФзОЗгАВ

2016еєіIMWGеЕ±иѓЖж†ЗеЗЖдЄ≠еѓєMRDйШіжАІеПНеЇФзЪДзБµжХПеЇ¶и¶Бж±ВеЄЄиҐЂиѓѓиІ£гАВеЃЮйЩЕдЄКпЉМжЧ†иЃЇжШѓжµБеЉПзїЖиГЮжЬѓињШжШѓжµЛеЇПжЦєж≥ХпЉМеЃЪдєЙMRDйШіжАІеЭЗи¶Бж±ВеЬ®вЙ•105дЄ™жЬЙж†ЄзїЖиГЮдЄ≠жЬ™ж£АеЗЇеЕЛйЪЖжАІжµЖзїЖиГЮпЉМеН≥жЬАдљОзБµжХПеЇ¶дЄЇ10-5пЉМдљЖињЩеєґдЄНжДПеС≥зЭАеП™иГљдљњзФ®иѓ•зБµжХПеЇ¶пЉМжЫійЂШзЪДзБµжХПеЇ¶пЉИе¶В10-6пЉЙдєЯеПѓзФ®дЇОиѓДдЉ∞гАВ
з†Фз©ґиѓБжНЃи°®жШОпЉМеЬ®е§ЪеПСжАІй™®йЂУзШ§пЉИMMпЉЙжВ£иАЕдЄ≠пЉМдїїдљХж∞іеє≥зЪДжМБзї≠MRDпЉИеН≥дљњдљОдЇО10-5жИЦ10-6пЉЙйГљдЄОиЊГеЈЃзЪДжЧ†ињЫе±ХзФЯе≠ШжЬЯпЉИPFSпЉЙзЫЄеЕ≥гАВеЫ†ж≠§пЉМдїОйҐДеРОзЪДиІТеЇ¶зЬЛпЉМжЬ™жЭ•еЬ®еИґеЃЪж≤їзЦЧеЖ≥з≠ЦжЧґеЇФдљњзФ®жЬАйЂШеПѓиЊЊзЪДзБµжХПеЇ¶пЉИе¶ВNGFжИЦNGSзЪД10-6пЉЙжЭ•еЃЪдєЙMRDжЧ†ж≥Хж£АжµЛгАВдљЖдЄіеЇКиѓХй™МдЄ≠дљЬдЄЇжЧ©жЬЯзїИзВєзЪДMRDйШіжАІCRдїНйЬАйЗЗзФ®10-5йШИеАЉпЉМеЫ†дЄЇеЃГеЗ†дєОйАВзФ®дЇОжЙАжЬЙж†ЈжЬђпЉМдЊњдЇОеРДж≤їзЦЧзїДеПКз†Фз©ґдєЛйЧізЪДжѓФиЊГгАВ
еЃЮжЦљMRDиѓДдЉ∞жЧґйЬАж≥®жДПдї•дЄЛеЃЮжУНи¶БзВєпЉЪ1. йЬАдЄ•ж†ЉйБµеЊ™IMWGж†ЗеЗЖпЉМеєґжМЙеЫљйЩЕеЕ±иѓЖиІДиМГжК•еСКжХ∞жНЃпЉЫ2. жК•еСКMRDйШіжАІзОЗжЧґеЇФдї•жДПеРСж≤їзЦЧдЇЇзЊ§дЄЇеИЖжѓНпЉМеєґйҐДиЃЊиѓДдЉ∞жЧґйЧізВєдї•еЗПе∞СжХ∞ж́犯姱пЉЫ3. дљњзФ®й¶Цжђ°й™®йЂУз©њеИЇж†ЈжЬђдї•йБњеЕНи°Ажґ≤з®АйЗКеѓЉиЗізЪДеБЗйШіжАІзїУжЮЬпЉМдЄФжЧ†иЃЇйЗЗзФ®еУ™жђ°й™®йЂУж†ЈжЬђпЉМеЭЗйЬАиѓДдЉ∞и°Ажґ≤з®АйЗКз®ЛеЇ¶пЉМиЛ•ж†ЈжЬђдЄ•йЗНз®АйЗКдЄФMRDйШіжАІеИЩдЄНеЇФиЃ°еЕ•зїУжЮЬпЉЫ4. MRDйШіжАІеЇФж†єжНЃжѓПдїљж†ЈжЬђзЪДж£АжµЛйЩРпЉИLODпЉЙеЃЪдєЙпЉМжХідљУжК•еСКзБµжХПеЇ¶йЬАи¶ЖзЫЦ>90%зЪДж†ЈжЬђпЉЫ5. MRDеК®жАБзЫСжµЛпЉИе¶В12жИЦ24дЄ™жЬИжМБзї≠йШіжАІпЉЙжѓФеНХжђ°иѓДдЉ∞жЫіеЕЈйҐДеРОжДПдєЙпЉМеЇФдљЬдЄЇеЄЄиІДжК•еСКеЖЕеЃєгАВ

еЬ®йЪПзЭАињЗеОї20еєідЄ≠19зІНжЦ∞иНѓиОЈжЙєпЉМе§ЪеПСжАІй™®йЂУзШ§пЉИMMпЉЙжВ£иАЕзЪДзФЯе≠ШжЬЯжШЊиСЧеїґйХњпЉМйГ®еИЖжВ£иАЕзФЪиЗ≥жЬЙжЬЫеЃЮзО∞йХњжЬЯзЉУиІ£жИЦжљЬеЬ®ж≤їжДИгАВзДґиАМпЉМдЄіеЇКиѓХй™МдєЯеЫ†ж≠§еПШеЊЧжЫіеК†е§НжЭВпЉЪйЬАи¶БжЫіе§Іж†ЈжЬђйЗПгАБжЫійХњйЪПиЃњжЧґйЧіпЉМжЙНиГљиІВеѓЯеИ∞жЧ†ињЫе±ХзФЯе≠ШжЬЯпЉИPFSпЉЙжИЦжАїзФЯе≠ШжЬЯпЉИOSпЉЙзЪДжШЊиСЧжФєеЦДгАВдЄЇеК†ењЂжЬЙжХИж≤їзЦЧжЦєж°ИзЪДз†ФеПСеєґдЉШеЕИиѓДдЉ∞жЬАжЬЙеЙНжЩѓзЪДжЦєж≥ХпЉМдЇЯйЬАдЄАдЄ™еПѓйЭ†зЪДжЧ©жЬЯжЫњдї£зїИзВєгАВ
еЊЃе∞ПжЃЛзХЩзЧЕзБґпЉИMRDпЉЙйШіжАІеЃМеЕ®зЉУиІ£пЉИCRпЉЙпЉМеН≥еЬ®иЊЊеИ∞дЉ†зїЯCRж†ЗеЗЖзЪДеЯЇз°АдЄКпЉМйАЪињЗйЂШзБµжХПеЇ¶жЦєж≥ХпЉИзБµжХПеЇ¶вЙ•10вБївБµпЉЙж£АжµЛдЄНеИ∞жЃЛзХЩиВњзШ§зїЖиГЮпЉМеЈ≤襀е§Ъй°єе§ІеЮЛиНЯиРГеИЖжЮРиѓБеЃЮдЄОиЙѓе•љйҐДеРОйЂШеЇ¶зЫЄеЕ≥пЉЪ
i2TEAMMз†Фз©ґеИЖжЮРдЇЖ20й°єиѓХй™МеЕ±12,926дЊЛжВ£иАЕжХ∞жНЃпЉМеПСзО∞ж≤їзЦЧеЙН9вАУ12дЄ™жЬИеЖЕиЊЊеИ∞MRDйШіжАІCRиАЕпЉМеЕґжЧ†ињЫе±ХзФЯе≠ШзОЗжѓФжЬ™иЊЊиѓ•зКґжАБиАЕйЂШеЗЇ3вАУ16еАНгАВеЬ®иѓХй™Ме±ВйЭҐпЉМMRDйШіжАІCRзОЗдЄОPFSдєЛйЧіеЕЈжЬЙиЊГеЉЇзЫЄеЕ≥жАІпЉИR¬≤=0.61вАУ0.70пЉЙпЉМеЬ®жЦ∞иѓКжЦ≠MMпЉИNDMMпЉЙдЇЇзЊ§е∞§дЄЇжШОжШЊпЉИR¬≤=0.67вАУ0.78пЉЙгАВ
EVIDENCEз†Фз©ґеѓє4907дЊЛNDMMжВ£иАЕињЫи°МеИЖжЮРпЉМдєЯжШЊз§ЇеЗЇзЫЄдЉЉзїУжЮЬпЉМеЕґдЄ≠12дЄ™жЬИжЧґMRDйШіжАІдЄОPFSдЄ™дљУж∞іеє≥зЪДжѓФеАЉжѓФдЄЇ4.02пЉЫе§НеПС/йЪЊж≤їжАІMMпЉИRRMMпЉЙжВ£иАЕдЄ≠ињЩдЄАжѓФеАЉжѓФйЂШиЊЊ7.67гАВ
FDAеЯЇдЇОдЄКињ∞жХ∞жНЃеЉАе±ХзЪДзїЉеРИеИЖжЮРдєЯеЊЧеЗЇдЄАиЗізїУиЃЇгАВ
еЯЇдЇОињЩдЇЫжХ∞жНЃпЉМFDAиВњзШ§иНѓзЙ©еҮ胥еІФеСШдЉЪпЉИODACпЉЙдЇО2024еєі4жЬИ12жЧ•еЕ®з•®йАЪињЗе∞ЖMRDйШіжАІCRдљЬдЄЇжФѓжМБMMжЦ∞зЦЧж≥ХеК†йАЯжЙєеЗЖзЪДдЄ≠йЧізїИзВєгАВ

MRDйШіжАІCRдЄНдїЕжШѓдЄАдЄ™еЉЇжЬЙеКЫзЪДйҐДеРОжМЗж†ЗпЉМдєЯж≠£еЬ®жИРдЄЇиѓДдЉ∞жЦ∞зЦЧж≥ХзЦЧжХИзЪДйЗНи¶БдЄіеЇКиѓХй™МзїИзВєгАВе§Ъй°єиНЯиРГеИЖжЮРи°®жШОпЉМеЬ®йЪПжЬЇдЄіеЇКиѓХй™МдЄ≠пЉМељУж≤їзЦЧзїДйЧіMRDйШіжАІCRзОЗеЈЃеЉВиЊЊеИ∞жИЦиґЕињЗ20%жЧґпЉМйАЪеЄЄйҐДз§ЇзЭАжЧ†ињЫе±ХзФЯе≠ШжЬЯпЉИPFSпЉЙзЪДжШЊиСЧжФєеЦДпЉИеН≥PFSй£ОйЩ©жѓФгАВиАМеѓєдЇОжЬ™еЄ¶жЭ•жШОжШЊPFSиОЈзЫКзЪДз†Фз©ґпЉИй£ОйЩ©жѓФвЙ•0.60пЉЙпЉМеЕґMRDйШіжАІCRзОЗеЈЃеЉВйАЪеЄЄдїЕдЄЇ2.5%еЈ¶еП≥гАВињЩдЄАеПСзО∞жФѓжМБе∞ЖMRDйШіжАІCRзОЗеЈЃеЉВдљЬдЄЇйҐДжµЛдЄіеЇКиОЈзЫКзЪДйЗНи¶БеПВиАГгАВ
еѓєдЇОеНХиЗВиѓХй™МпЉИе¶ВзФ®дЇОе§НеПС/йЪЊж≤їжАІе§ЪеПСжАІй™®йЂУзШ§RRMMзЪДиѓХй™МпЉЙпЉМжШОз°ЃдЄАдЄ™еЕЈжЬЙйҐДжµЛдїЈеАЉзЪДcut-offеАЉе∞§дЄЇеЕ≥йФЃпЉМжЬЙеК©дЇОеИ§жЦ≠ж≤їзЦЧжШѓеР¶еПѓиГљеЄ¶жЭ•йХњжЬЯзФЯе≠ШиОЈзЫКгАВж≠§е§ЦпЉМдїОеЃЮйЩЕжУНдљЬиІТеЇ¶зЬЛпЉМдљњзФ®MRDйШіжАІCRдљЬдЄЇзїИзВєеПѓе§ІеєЕеЇ¶зЉ©зЯ≠иѓХй™МеС®жЬЯгАВдЊЛе¶ВпЉЪдЄАй°єеЕЄеЮЛзЪДеПМиЗВNDMMиѓХй™МиЛ•йЬАжЬАзїИеИЖжЮР331дЄ™PFSдЇЛдїґпЉМйЬАйЪПиЃњ7иЗ≥12еєіпЉМиАМе¶ВжЮЬйЗЗзФ®MRDйШіжАІCRзїИзВєпЉМеПѓеЬ®еЕ•зїДеЃМжИРеРОзЇ¶12дЄ™жЬИеЊЧеЗЇзїУжЮЬпЉМжХідљУжХ∞жНЃжИ™ж≠ҐжЧґйЧізЇ¶дЄЇ3.7еєіпЉМеЬ®зРЖиЃЇдЄКжѓФPFSзЪДдЄ≠жЬЯеИЖжЮРжПРеЙН>3еєіпЉМжѓФPFSзЪДжЬАзїИеИЖжЮРжПРеЙН>8еєіпЉМињЩдЄНдїЕеК†йАЯдЇЖжЬЙжХИзЦЧж≥ХзЪДеЉАеПСињЫз®ЛпЉМдєЯдЄЇжЧ©жЬЯиѓЖеИЂжЧ†жХИзЦЧж≥ХжПРдЊЫдЊЭжНЃпЉМдїОиАМйБњеЕНдЄНењЕи¶БзЪДиµДжЇРжµ™иієеТМжВ£иАЕжЪійЬ≤дЇОжЧ†жХИж≤їзЦЧгАВ
ж≠§е§Ц,еЬ®OSзїИзВєеЫ†зЦЊзЧЕињЫе±ХеРОж≤їзЦЧдЇ§еПЙиАМ襀з®АйЗКзЪДжГЕеЖµдЄЛпЉМе∞ЖMRDйШіжАІCRдЄОPFSиЃЊдЄЇеЕ±еРМдЄїи¶БзїИзВєпЉМжЬЙеК©дЇОжЫіеЗЖз°ЃеЬ∞еИ§жЦ≠дЄАзІНжЦ∞зЦЧж≥ХжШѓеР¶еПѓиГљеЄ¶жЭ•зФЯе≠ШиОЈзЫКгАВ

е∞љзЃ°иґКжЭ•иґКе§ЪзЪДз†Фз©ґжФѓжМБеЊЃе∞ПжЃЛзХЩзЧЕзБґпЉИMRDпЉЙиѓДдЉ∞еЬ®жМЗеѓЉе§ЪеПСжАІй™®йЂУзШ§пЉИMMпЉЙжВ£иАЕзЪДж≤їзЦЧеЖ≥з≠ЦдЄ≠зЪДдїЈеАЉпЉМдљЖеЬ®жЧ•еЄЄеЃЮиЈµдЄ≠еЃЮжЦљMRDиѓДдЉ∞дїНйЭҐдЄіе§ЪдЄ™жМСжИШеТМдЇЙиЃЃгАВдї•дЄЛжШѓдЇФдЄ™дЄїи¶БзЪДиі®зЦСзВєеПКеЕґеЇФеѓєз≠ЦзХ•пЉЪ
зЫЃеЙНе∞ЪжЧ†жШОз°ЃжМЗеНЧиѓіжШОе¶ВдљХж†єжНЃMRDзїУжЮЬињЫи°МдЄ™жАІеМЦж≤їзЦЧгАВзДґиАМпЉМиАГиЩСеИ∞MRDжШѓMMдЄ≠жЬАйЗНи¶БзЪДйҐДеРОеЫ†зі†дєЛдЄАпЉМеЬ®иЊЊеИ∞еЃМеЕ®зЉУиІ£пЉИCRпЉЙзЪДжВ£иАЕдЄ≠дЄНиѓДдЉ∞еЕґзКґжАБжШѓдЄНеПѓжГ≥и±°зЪДгАВж≠£еЬ®ињЫи°МзЪДе§Ъй°єдЄіеЇКиѓХй™МпЉИе¶ВDRAMMATICгАБGEM2017FITз≠ЙпЉЙж≠£еЬ®жΥ糥MRDдљЬдЄЇзФЯзЙ©ж†ЗењЧзЙ©жИЦж≤їзЦЧеИЖе±ВеЈ•еЕЈпЉМйҐДиЃ°ињЩдЇЫз†Фз©ґзЪДзїУжЮЬе∞ЖдЄЇжЧ•еЄЄеЃЮиЈµжПРдЊЫеЕ≥йФЃжМЗеѓЉгАВ
йҐСзєБзЪДй™®йЂУз©њеИЇеПѓиГљеѓєжВ£иАЕйА†жИРиіЯжЛЕпЉМдљЖеАЯйЙізЩљи°АзЧЕйҐЖеЯЯзЪДзїПй™МпЉМйАВељУзЪДй™®йЂУж£АжЯ•йАЪеЄЄдЉЪ襀жВ£иАЕжО•еПЧгАВеїЇиЃЃеЬ®ж≤їзЦЧеИЭжЬЯиЗ≥е∞СжѓПеєіињЫи°МдЄАжђ°MRDиѓДдЉ∞пЉМеєґеПѓж†єжНЃдЄ™дљУжГЕеЖµињЫи°Ми∞ГжХігАВжЦ∞дЄАдї£ж£АжµЛжЦєж≥ХпЉМжЬЙжЬЫеЗПе∞СеѓєйҐСзєБй™®йЂУз©њеИЇзЪДйЬАж±ВгАВж≠§е§ЦпЉМеПѓдї•йҐДиЃ°PRDиѓДдЉ∞зЪДйАРж≠•еЃЮжЦље∞ЖжФєеПШеѓєMMзЪДзЫСжµЛжЦєеЉПгАВ
еЬ®дЄіеЇКеЃЮиЈµдЄ≠пЉМMRDйШіжАІзЪДжВ£иАЕзФЯе≠ШзїУе±АйАЪеЄЄдЄНе¶ВдЄіеЇКиѓХй™МдЄ≠зЪДжВ£иАЕпЉМињЩеПНжШ†дЇЖдЄ§зІНзОѓеҐГдєЛйЧіж≤їзЦЧжЦєж°ИеТМжЦєж≥Хе≠¶дЄКзЪДеЈЃеЉВгАВеЇФеЬ®жЧ•еЄЄеЃЮиЈµдЄ≠еЇФзФ®еЫљйЩЕй™®йЂУзШ§еЈ•дљЬзїДпЉИIMWGпЉЙзЪДMRDиѓДдЉ∞еЕ±иѓЖж†ЗеЗЖпЉМдї•з°ЃдњЭжЬАдљ≥зїУжЮЬгАВ
е∞љзЃ°MRDжЧ†ж≥Хж£АжµЛеєґдЄНжДПеС≥зЭАж≤їжДИпЉМдљЖеЃГеПНжШ†дЇЖиВњзШ§зФЯзЙ©е≠¶зЪДжХідљУжГЕеЖµеПКеѓєж≤їзЦЧзЪДжХПжДЯжАІгАВеѓєдЇОиЊЊеИ∞CRзЪДжВ£иАЕпЉМйАЪињЗMRDеПНеЇФеТМеК®жАБеПШеМЦжЭ•жЫіе•љеЬ∞зРЖиІ£еРОзї≠ж≤їзЦЧжХИжЮЬжШѓиѓДдЉ∞MRDзЪДйЗНи¶БзРЖзФ±гАВжЈ±еЇ¶еТМжМБзї≠зЪДMRDеПНеЇФеПѓиГљжШѓйГ®еИЖжВ£иАЕеЃЙеЕ®еБЬж≠Ґж≤їзЦЧзЪДзФЯзЙ©ж†ЗењЧзЙ©гАВ
е∞љзЃ°жЬЙдЇЫжМБзї≠е≠ШеЬ®MRDзЪДжВ£иАЕеПѓдї•жЬЙиЊГйХњзЪДзФЯе≠ШжЬЯпЉМдљЖињЩдЄНеЇФжО©зЫЦе§Іе§ЪжХ∞жВ£иАЕзЦЊзЧЕињЫе±Хй£ОйЩ©еҐЮеК†зЪДдЇЛеЃЮгАВиѓКжЦ≠жЧґзЪДжЦ∞зФЯзЙ©ж†ЗењЧзЙ©пЉИе¶ВMGUSж†ЈзЙєеЊБеТМдЄНеПѓж£АжµЛзЪДCTCsпЉЙдї•еПКMRDиѓДдЉ∞жЧґзЪДзФЯзЙ©ж†ЗењЧзЙ©пЉИе¶ВеҐЮеЉЇзЪДйЭЮжБґжАІжµЖзїЖиГЮжБҐе§НпЉЙжЬЙеК©дЇОиѓЖеИЂеПѓиГљжЬЙиЙѓе•љзїУе±АзЪДMRDйШ≥жАІжВ£иАЕгАВж≠§е§ЦпЉМMRDеК®жАБеПШеМЦдєЯеПѓиГљеЄЃеК©еМЇеИЖдЄНеРМзФЯе≠ШзїУе±АзЪДжВ£иАЕзЊ§дљУгАВ
еЬ®MMжВ£иАЕдЄ≠иѓДдЉ∞ж≤їзЦЧеПНеЇФдЄїи¶БжЬЙдЄЙдЄ™зЫЃж†ЗпЉЪпЉИ1пЉЙиѓЖеИЂеѓєж≤їзЦЧеОЯеПСиАРиНѓзЪДжВ£иАЕпЉМињЩдЇЫжВ£иАЕзЦЊзЧЕињЫе±ХеТМзФЯе≠ШйҐДеРОиЊГеЈЃзЪДй£ОйЩ©жЮБйЂШпЉЫпЉИ2пЉЙж†єжНЃж≤їзЦЧеПНеЇФзЪДжЈ±еЇ¶ињЫдЄАж≠•зїЖеМЦжВ£иАЕзЪДйҐДеРОеИ§жЦ≠пЉЫпЉИ3пЉЙеЬ®дЄіеЇКиѓХй™МдЄ≠жѓФиЊГдЄНеРМзЦЧж≥ХзЪДжЬЙжХИжАІгАВзФ±дЇОељУеЙНж≤їзЦЧжЦєж°ИжЙАеЄ¶жЭ•зЪДеЃМеЕ®зЉУиІ£пЉИCRпЉЙзОЗйЭЮеЄЄйЂШпЉМжМБзї≠е≠ШеЬ®зЪДеЊЃе∞ПжЃЛзХЩзЧЕзБґпЉИMRDпЉЙеЊИеПѓиГљдЉЪеПЦдї£MиЫЛзЩљзЪДж£АжµЛпЉМжИРдЄЇеОЯеПСиАРиНѓзЪДдЄАдЄ™зФЯзЙ©ж†ЗењЧзЙ©гАВеЃЮйЩЕдЄКпЉМMRDзКґжАБжШѓMMжВ£иАЕжЬАеЉЇе§ІзЪДйҐДеРОеЫ†зі†дєЛдЄАпЉМзФЪиЗ≥жШѓжЬАеЉЇе§ІзЪДйҐДеРОеЫ†зі†пЉМеЕґеЬ®дЄіеЇКиѓХй™МдЄ≠зЪДеЇФзФ®дљЬдЄЇзїИзВєжМЗж†Зж≠£еЬ®ињЕйАЯжЙ©е±ХгАВж≠§е§ЦпЉМиЃЄе§Ъз†Фз©ґж≠£еЬ®жΥ糥MRDеЬ®дЄ™жАІеМЦж≤їзЦЧжЦєж°ИдЄ≠зЪДдљЬзФ®гАВињЩдЇЫз†Фз©ґзїУжЮЬзЪДеЕђеЄГе∞ЖжЬЙеК©дЇОжЫіе•љеЬ∞дЇЖиІ£MRDе¶ВдљХжФєеЦДжВ£иАЕйҐДеРОеТМQOLпЉМиАМMRDеТМPRDиѓДдЉ∞зЪДзїУеРИеПѓиГљжШѓеЃЮзО∞ињЩдЄАзЫЃж†ЗзЪДеЕ≥йФЃгАВ
еЬ®жΥ糥е¶ВдљХжЫіе•љеЬ∞еИ©зФ®MRDжЭ•жФєеЦДе§ЪеПСжАІй™®йЂУзШ§пЉИMMпЉЙжВ£иАЕзЪДж≤їзЦЧзїУе±АеТМзФЯжіїиі®йЗПзЪДињЗз®ЛдЄ≠пЉМйАЙжЛ©йЂШжХИгАБеЗЖз°ЃзЪДж£АжµЛеЈ•еЕЈжШЊеЊЧе∞§дЄЇйЗНи¶БгАВеЬ®ж≠§иГМжЩѓдЄЛпЉМиЙЊж≤РиТљзФЯзЙ©зЪДSeq-MRD¬ЃдЇІеУБжПРдЊЫдЇЖдЄАдЄ™жЮБеЕЈжљЬеКЫзЪДйАЙжЛ©гАВеЯЇдЇОйЂШйАЪйЗПжµЛеЇПжКАжЬѓпЉМSeq-MRD¬ЃиГље§Ядї•жЮБйЂШзЪДзБµжХПеЇ¶пЉИиЊЊеИ∞10-6зФЪиЗ≥жЫійЂШпЉЙеѓєMRDињЫи°Мз≤Њз°ЃиѓДдЉ∞пЉМз°ЃдњЭеН≥дљњеЬ®еЊЃйЗПжЃЛзХЩзЧЕзБґе≠ШеЬ®зЪДжГЕеЖµдЄЛдєЯиÚ襀еПКжЧґеПСзО∞гАВ
Seq-MRD¬ЃдЄНдїЕжПРйЂШдЇЖж£АжµЛзЪДеЗЖз°ЃжАІпЉМињШеЫ†еЕґж†ЗеЗЖеМЦжµБз®ЛеЗПе∞СдЇЖжУНдљЬиѓѓеЈЃпЉМдљњеЊЧзїУжЮЬжЫіеК†еПѓйЭ†гАВж≠§е§ЦпЉМйЪПзЭАдЄіеЇКеЃЮиЈµдЄ≠еѓєдЄ™жАІеМЦж≤їзЦЧйЬАж±ВзЪДеҐЮйХњпЉМSeq-MRD¬ЃжЙАжПРдЊЫзЪДжЈ±еЇ¶жіЮеѓЯе∞ЖжЬЙеК©дЇОеМїзФЯж†єжНЃжВ£иАЕзЪДеЕЈдљУжГЕеЖµи∞ГжХіж≤їзЦЧз≠ЦзХ•пЉМдїОиАМеПѓиГљеЃЮзО∞жЫідљ≥зЪДж≤їзЦЧжХИжЮЬеТМжЫійЂШзЪДзФЯе≠Шиі®йЗПгАВ
Bruno Paiva

Bruno Paiva жХЩжОИеЬ®зІСз†ФйҐЖеЯЯжЛ•жЬЙеНУиґКжИРе∞±гАВдїЦжЫЊжЛЕдїї12дЄ™зФ±еЕђеЕ±жИЦзІБдЇЇжЬЇжЮДиµДеК©зЪДз†ФеПСй°єзЫЃзЪДй¶ЦеЄ≠з†Фз©ґеСШпЉИPIпЉЙжИЦиБФеРИй¶ЦеЄ≠з†Фз©ґеСШпЉИCo-PIпЉЙпЉМеєґеЬ®дЇІе≠¶з†ФеРИдљЬжЦєйЭҐзїПй™МдЄ∞еѓМпЉМеЈ≤дЄОеЃЙињЫгАБ祲蜙гАБBMS-CelgeneгАБзЊО姩жЧОгАБжЭ®ж£ЃгАБзљЧж∞ПгАБиµЫиѓЇиП≤еТМж≠¶зФ∞з≠Йе§ЪеЃґеЫљйЩЕзЯ•еРНеИґиНѓдЉБдЄЪеїЇзЂЛдЇЖиґЕињЗ15й°єз†ФеПСеРИдљЬеНПиЃЃгАВ
еЬ®йХњиЊЊ13еєізЪДзІСз†ФзФЯжґѓдЄ≠пЉМPaiva жХЩжОИеЕ±еПСи°®иЃЇжЦЗ150зѓЗпЉМеЕґдЄ≠дї•зђђдЄАдљЬиАЕиЇЂдїљеПСи°®37зѓЗпЉМдї•жЬАеРОдљЬиАЕжИЦйАЪиЃѓдљЬиАЕиЇЂдїљеПСи°®15зѓЗгАВдїЦзЪДз†Фз©ґжИРжЮЬе§Ъжђ°еПСи°®дЇОеМїе≠¶дЄОиВњзШ§е≠¶йҐЖеЯЯзЪДй°ґзЇІжЬЯеИКпЉМеЕґдЄ≠еМЕжЛђпЉЪгАКNew England Journal of MedicineгАЛпЉИ1зѓЗпЉЙгАБгАКNature MedicineгАЛпЉИ1зѓЗпЉЙгАБгАКCancer CellгАЛпЉИ2зѓЗпЉЙгАБгАКThe Lancet OncologyгАЛпЉИ4зѓЗпЉЙеТМгАКJournal of Clinical OncologyгАЛпЉИ4зѓЗпЉЙпЉМж≠§е§ЦпЉМдїЦеЬ®и°Ажґ≤е≠¶йҐЖеЯЯзЪДжЭГе®БжЬЯеИКдЄКдєЯеПСи°®дЇЖе§ІйЗПеЕЈжЬЙељ±еУНеКЫзЪДиЃЇжЦЗпЉМдЊЛе¶ВпЉЪгАКBloodгАЛпЉИ26зѓЗпЉЙеТМгАКLeukemiaгАЛпЉИ23зѓЗпЉЙгАВ
еЕґжЙАжЬЙеПСи°®жИРжЮЬдЄ≠пЉМиґЕињЗ90%зЪДжЦЗзЂ†еИКзЩїдЇОеРДе≠¶зІСйҐЖеЯЯеЖЕеЕђиЃ§зЪДдЄАзЇњж†ЄењГжЬЯеИКгАВ
иЙЊж≤РиТљдЄУж≥®дЇОеЕНзЦЂзїДдЇМдї£жµЛеЇПйҐЖеЯЯе§ЪеєіпЉМжШѓеЕ®еЫљй¶ЦеЃґжО®еЗЇи°Ажґ≤иВњзШ§NGS MRDж£АжµЛдЇІеУБSeq-MRD¬ЃзЪДеЕђеПЄгАВSeq-MRD¬ЃйАВзФ®дЇОB/Tз≥їзЩљи°АзЧЕгАБB/Tз≥їжЈЛеЈізШ§гАБе§ЪеПСжАІй™®йЂУзШ§пЉМиГље§ЯеЄЃеК©дЄіеЇКеМїзФЯйҐДжµЛйХњжЬЯзЦЧжХИгАБиѓДдЉ∞ж≤їзЦЧжХИжЮЬгАБзЫСжµЛзЉУиІ£зКґжАБдї•еПКж£АжµЛжЧ©жЬЯе§НеПСгАВзїПињЗе§ЪеєізЪДзІѓзіѓеТМеПСе±ХпЉМSeq-MRD¬ЃеЬ®дЄіеЇКж£АжµЛеТМзІСе≠¶з†Фз©ґдЄКеЭЗеПЦеЊЧдЄНе∞СжИРжЮЬпЉМеєґиОЈеЊЧеЫљйЩЕеЄВеЬЇиЃ§еПѓгАВ
иОЈеЊЧжђІзЫЯCEиµДиі®иЃ§иѓБ
Seq-MRD¬ЃиОЈеЊЧжђІзЫЯCEиµДиі®пЉИж≥®еЖМеПЈпЉЪDE/CA20/01-IVD-Luxuslebenswelt-190/22пЉЙпЉМиОЈжЙєзЪДжШѓдЇЇжЈЛеЈіBзїЖиГЮеЊЃе∞ПжЃЛзХЩзЧЕеЯЇеЫ†ж£АжµЛиѓХеЙВзЫТпЉИеПѓйАЖжЬЂзЂѓзїИж≠ҐжµЛеЇПж≥ХпЉЙгАВ

иОЈеЊЧдЄЙй°єеПСжШОдЄУеИ©
иЙЊж≤РиТљжО®еЗЇзЪДSeq-MRD¬Ѓи°Ажґ≤зЩМзЧЗMRDж£АжµЛжШѓжЬАжЧ©жЙєеЃЮзО∞еХЖдЄЪеМЦзЪДдЇІеУБпЉМиЗ™2016еєіз†ФеПСдЄУеИ©жКАжЬѓиЗ≥дїКпЉМиЙЊж≤РиТљSeq-MRD¬ЃеЈ≤зїПиОЈеЊЧ3й°єеЫљеЃґеПСжШОдЄУеИ©пЉЪ
[1]вАЬдЄАзІНеЇФзФ®дЇОйЂШйАЪйЗПжµЛеЇПж£АжµЛTзїЖиГЮзЩљи°АзЧЕеЊЃе∞ПжЃЛзХЩзЧЕзЪДеЉХзЙ©зїДеРИеПКиѓХеЙВзЫТвАЭпЉИдЄУ еИ© еПЈ: 2016 11204857.0пЉМжОИжЭГеЕђеСКеПЈ:CN 106957906 BпЉЙ
[2]вАЬдЄАзІНж£АжµЛеЊЃе∞ПжЃЛзХЩзЧЕMRDзЪДиѓХеЙВзЫТвАЭпЉИдЄУ еИ© еПЈ: 2018 1 1550133.0пЉМжОИжЭГеЕђеСКеПЈ: CN 109652518 BпЉЙ
[3]вАЬдЄАзІНж£АжµЛеЊЃе∞ПжЃЛзХЩзЧЕMRDзЪДжЦєж≥ХвАЭпЉИдЄУ еИ© еПЈ: 2018 1 1549203.0пЉМжОИжЭГеЕђеСКеПЈ: CN 109680062 BпЉЙ

иОЈеЊЧзЫЄеЕ≥иљѓдїґиСЧдљЬ
[1]вАЬеЕНзЦЂзїДеЇУMRDж£АжµЛиЗ™еК®еМЦжК•еСКз≥їзїЯ[зЃАзІ∞ImmuReport] V1.0вАЭпЉИзЩїиЃ∞еПЈпЉЪ2019SR0916207пЉЙ
[2]вАЬSeq-MRDж£АжµЛиЗ™еК®еМЦеИЖжЮРз≥їзїЯпЉИDiscTermiteпЉЙ[зЃАзІ∞пЉЪDiscTermite]0.4.6вАЬпЉИзЩїиЃ∞еПЈпЉЪ2019SR1131517пЉЙ
[3]вАЬеЯЇдЇОеЕНзЦЂзїДеЇУдЇМдї£жµЛеЇПзЪДеЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛжХ∞жНЃе§ДзРЖз≥їзїЯвАЭпЉИзЩїиЃ∞еПЈпЉЪ2020SR0507594пЉЙ

иОЈеЊЧиН£и™ЙиѓБдє¶
1гАБиЙЊж≤РиТљиБФеРИжµЩе§ІйЩДдЄАйїДж≤≥жХЩжОИеЃМжИРзЪДгАКжЦ∞еЮЛCAR-TзїЖиГЮз†ФеПСеПКеЕґж≤їзЦЧжБґжАІи°Ажґ≤зЧЕдЄіеЇКиљђеМЦеИЫжЦ∞дљУз≥їеїЇзЂЛгАЛиОЈ2023еєіеЇ¶жµЩж±ЯзЬБзІСе≠¶жКАжЬѓињЫж≠•е•ЦдЄАз≠Йе•ЦгАВSeq-MRD¬ЃеЬ®иѓ•жКАжЬѓзЪДеИЫжЦ∞дЄОеЇФзФ®дЄ≠иµЈеИ∞дЇЖеЕ≥йФЃжАІдљЬзФ®гАВ

2гАБиЙЊж≤РиТљзФ≥жК•зЪДвАЬеЕНзЦЂзїДTCR/IgйЂШйАЪйЗПжµЛеЇПжКАжЬѓ/и°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛ/Seq-MRD¬ЃвАЭеЫ†еЕґеИЫжЦ∞жАІгАБеЙНж≤њжАІгАБеЄВеЬЇеЃЮзФ®жАІиН£иОЈвАЬ2022еєіеЇ¶CCTBдЄ≠еЫљиВњзШ§ж†ЗењЧзЙ©дЇІдЄЪеИЫжЦ∞е§ІдЉЪеИЫжЦ∞жКАжЬѓ/дЇІеУБиѓДйАЙвАЭй°єзЫЃдЇМз≠Йе•ЦгАВ

2023еєіиОЈжЙєдЇЖгАРеЕ®и°А/й™®йЂУеЯЇеЫ†зїДDNAжПРеПЦиѓХеЙВзЫТгАСпЉИз¶їењГеРЄйЩДжЯ±ж≥ХпЉЙе§Зж°ИзЉЦеПЈпЉЪжµЩжЭ≠жҐ∞е§З20230798 пЉМиѓХеЙВзЫТеИЖеИЂйАВзФ®дЇОдЇЇе§ЦеС®и°АгАБй™®йЂУж†ЈжЬђзЪДж†ЄйЕЄзЪДжПРеПЦгАВ
еПСи°®зЫЄеЕ≥жЦЗзМЃ
Seq-MRD¬ЃеПСи°®зЫЄеЕ≥жЦЗзМЃ
1гАБHuang Y, Zhao H, Shao M, Zhou L, Li X, Wei G, Wu W, Cui J, Chang AH, Sun T, Hu Y, Huang H.Predictive value of next-generation sequencing-based minimal residual disease after CAR-T cell therapy. Bone Marrow Transplant.2022 Jun 1. doi: 10.1038/s41409-022-01699-2. Epub ahead of print. PMID: 35650329.пЉИзВєеЗїйУЊжО•еПѓжЯ•зЬЛжЦЗзЂ†еЖЕеЃєпЉЙ

2гАБChen H, Gu M, Liang J, Song H, Zhang J, Xu W, Zhao F, Shen D, Shen H, Liao C, Tang Y, Xu X.¬†Minimal residual disease detection by next-generation sequencing of different immunoglobulin gene rearrangements in pediatric B-ALL.¬†Nat Commun. 2023 Nov 17;14(1):7468. doi: 10.1038/s41467-023-43171-9. пЉИзВєеЗїйУЊжО•еПѓжЯ•зЬЛжЦЗзЂ†еЖЕеЃєпЉЙ

3гАБMin’er Gu,Yahong Xia, Jingying Zhang, Yongmin Tang, Weiqun Xu, Hua Song ¬†Xiaojun Xu.The effectiveness of blinatumomab in clearing measurable residual disease in pediatric B-cell acute lymphoblastic leukemia patients detected by next-generation sequencing.¬† Cancer Med. 2023 Dec;12(24):21978-21984. doi:10.1002/cam4.6771. пЉИзВєеЗїйУЊжО•еПѓжЯ•зЬЛжЦЗзЂ†еЖЕеЃєпЉЙ

4гАБYan N, Wang ZL, Wang XJ, etпЉМal.¬†Measurable residual disease testing by next generation sequencing is more accurate compared with multiparameter flow cytometry in adults with B-cell acute lymphoblastic leukemia.¬†Cancer Lett. 2024 Jul 4;598:217104. doi: 10.1016/j.canlet.2024.217104.

иОЈеЊЧеЫљйЩЕеЄВеЬЇиЃ§еПѓ
2023еєіDelveInsightеЕђеПЄеПСеЄГзЪДMRDеЫљйЩЕеЄВеЬЇз†Фз©ґжК•еСКдЄ≠пЉМиЙЊж≤РиТљ/Seq-MRD¬ЃжШѓдЄ≠еЫљеФѓдЄАдЄАеЃґеЕђеПЄ/дЇІеУБињЫеЕ•еЫљйЩЕи∞Гз†ФеЄВеЬЇжК•еСКгАВDelveInsightжШѓдЄАеЃґйҐЖеЕИзЪДеМїзЦЧдњЭеБ•еЄВеЬЇз†Фз©ґеТМеХЖдЄЪеҮ胥еЕђеПЄпЉМдї•еЕґзО∞жИРзЪДиБФеРИеЄВеЬЇз†Фз©ґжК•еСКдї•еПКдЄЇеМїзЦЧдњЭеБ•и°МдЄЪзЪДеЕђеПЄжПРдЊЫзЪДеЃЪеИґиІ£еЖ≥жЦєж°ИиАМйЧїеРНгАВ

жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМиН£иОЈжµЩж±ЯзЬБзІСжКАињЫж≠•дЄАз≠Йе•ЦпЉМеєґжОИжЭГж≥ЫзФЯе≠РдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†|еЕНзЦЂеКЫжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВзЫЃеЙНдЄЇж≠ҐеПСи°®дЇЖжХ∞еНБзѓЗиЃЇжЦЗпЉМеЕґдЄ≠еМЕжЛђпЉЪThe New England Journal of Medicine(IF:158.5), Nature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24),¬†Nature Communications¬†(IF:17)з≠Йе§ЪзѓЗйЂШеИЖжЭВењЧгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ





