在非小细胞肺癌(NSCLC)免疫治疗领域,新辅助免疫检查点阻断(NA-ICB)是近年来备受关注的前沿方向 —— 它能在保留原发肿瘤的同时激活全身抗瘤 T 细胞响应,为可切除和局部晚期患者带来新希望。但一直以来,介导 NA-ICB 疗效的关键 T 细胞亚型及其迁移、分化机制,始终是科研界亟待破解的难题。
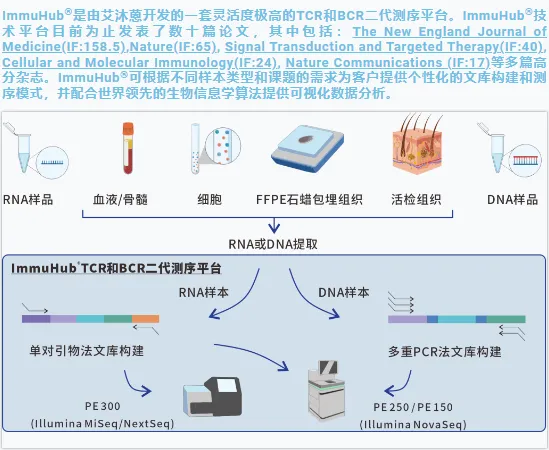
近日,《British Journal of Cancer》(IF=8.6)发表了一项针对 NSCLC 患者的重磅研究,不仅首次明确CD8+CX3CR1+T 细胞是 NA-ICB 治疗响应的核心循环细胞毒性前体,更揭示了其从外周血增殖、迁移至肿瘤微环境(TME)并分化发挥作用的完整轨迹。而在这项突破性研究中,艾沐蒽的ImmuHub® T-cell receptor (TCR) profiling kit,成为了解析 T 细胞克隆动态与组织迁移的关键技术支撑!

研究首先对来自18名患者的25个组织样本(包括肿瘤、正常肺组织和淋巴结)进行了scRNA-seq分析,获得了151,036个高质量免疫细胞的转录组数据。
1. 高分辨率细胞图谱: 通过对95,205 个T/NK细胞进行无偏差聚类分析,研究团队成功鉴定了16 个功能各异的T细胞亚群。这些亚群根据其核心特征基因被精准注释。

fig 1. scRNA-seq解析NSCLC肿瘤微环境中的T/NK细胞景观。(a) UMAP可视化显示16个细胞亚群。(b) 各亚群特征基因表达热图,显示T8_CX3CR1_eff等亚群高表达细胞毒性基因。
2. 识别治疗响应关键亚群: 通过比较新辅助治疗组(NAT)与初治组(TN),研究发现T8_CX3CR1_eff 和T8_FCGR3A_NK-like 亚群在治疗组中显著富集,并且在达到主要病理缓解(MPR)的患者中,这种富集更为明显。这从转录组水平首次指出,CX3CR1阳性的细胞毒性T细胞是响应NA-ICB治疗的核心细胞类型。
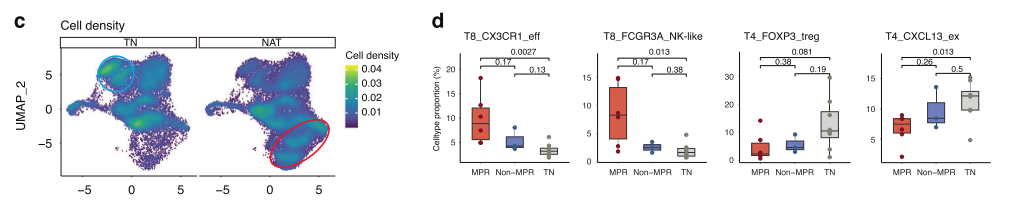
fig 2. CD8+CX3CR1+T细胞在治疗响应者中显著富集。
研究的另一大亮点在于将scRNA-seq与scTCR-seq数据在单个细胞水平上进行整合。
1. 伪时间轨迹分析:利用scRNA-seq数据进行的RNA velocity 分析显示,CD8+CX3CR1+T细胞在浸润肿瘤后,并非终点,而是分化的起点。它们会沿着一条轨迹向耗竭前体细胞(T8_ENTPD1_ex) 分化,或沿另一条轨迹向NK样细胞(T8_FCGR3A_NK-like)转化。
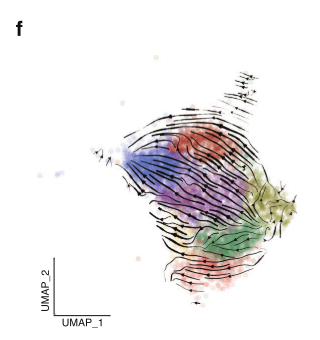

fig 3. CD8+CX3CR1+T细胞的分化轨迹。矢量图显示T8_CX3CR1_eff细胞分化为耗竭前体(T8_ENTPD1_ex)和NK样细胞(T8_FCGR3A_NK-like)的轨迹。
2. 克隆谱系追踪: 通过追踪同一个TCR克隆型在不同细胞亚群中的分布,研究者能直观了解细胞状态的转变。例如,一个在血液中属于T8_CX3CR1_eff的克隆,在肿瘤内其“后代”可能同时出现在T8_GZMK_em和T8_ENTPD1_ex群体中。这为上述分化轨迹提供了基于克隆关系的实验性证据,描绘了“循环前体 → 瘤内效应/记忆细胞 → 耗竭细胞”的动态演变过程。
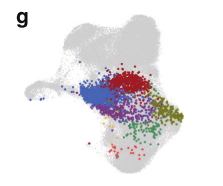

fig 4. 共享TCR克隆型。UMAP图显示,相同的TCR克隆型可同时分布在T8_CX3CR1_eff和T8_ENTPD1_ex等不同亚群中,证实了细胞状态的动态转变。
2
单细胞测序揭示了“哪些细胞”在响应,而要证明这些细胞是“从血液迁移至肿瘤”,则需要借助TCR分析。因为每个T细胞都具有其独特的TCR序列。
研究使用艾沐蒽ImmuHub® TCR profiling kit,对包括肿瘤、正常肺、淋巴结和纵向外周血在内的多种样本进行了批量TCR-β 测序。
关键发现如下:
-
发现共享克隆,证实迁移: 在治疗响应者的外周血(B1, B3)与术后肿瘤组织(T2) 中,发现了大量完全一致的TCR克隆序列。这意味着,在血液中被激活、增殖的T细胞,确实迁移并浸润到了肿瘤病灶中。这是证明CD8+CX3CR1+T细胞具备跨组织迁移能力的最直接证据。
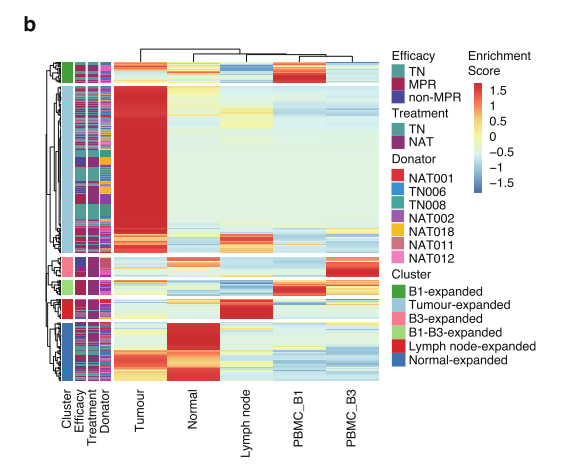
fig 5. TCR谱系追踪揭示细胞迁移路径。热图显示共享的TCR克隆型(每一行)在不同组织与血液样本(每一列)中的分布,证实了克隆性T细胞从外周血向肿瘤的迁移。
-
克隆动态揭示响应模式: 通过分析不同组织中专一性扩增的克隆类型,研究者归纳出六种TCR分布模式。其中,“肿瘤扩增” 和 “外周血B1-B3持续扩增” 这两种模式尤其关键。后者几乎 exclusively 出现在MPR患者中,并且其对应的细胞表型正是T8_CX3CR1_eff和T8_GZMK_em,提示这群在血液中持续存在的效应细胞是治疗成功的关键。
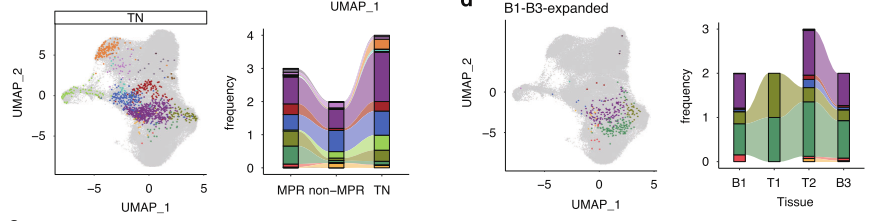
fig 6. 具有特定迁移模式的TCR克隆定位于效应性T细胞亚群。
-
计算生物学辅助验证: 研究进一步采用STARTRAC-migr 计算模型对细胞迁移潜力进行量化。结果显示,T8_CX3CR1_eff和T8_FCGR3A_NK-like等亚群在“肿瘤-血液”配对中具有最高的迁移指数,从计算角度再次验证了它们的强迁移属性。
本研究通过”单细胞转录组定位细胞状态+TCR测序追踪迁移路径+计算模型量化动态”的多维策略,明确三大核心结论:
-
CD8+CX3CR1+T 细胞是NA-ICB 治疗的核心响应细胞 -
该细胞可从外周血定向迁移至肿瘤微环境 -
其在肿瘤内可双向分化并执行杀伤或耗竭功能。
这些结论为后续NA-ICB 疗效预测标志物开发及治疗方案优化提供了直接理论依据。
艾沐蒽ImmuHub® TCR 测序试剂盒凭借高灵敏度(捕获低频共享克隆)、高精准性(保障跨组织克隆匹配可靠性)、高兼容性(适配多样本类型)的核心优势,为研究的关键结论提供了稳定技术保障。该试剂盒可广泛应用于肿瘤免疫治疗、感染性疾病及自身免疫病等领域的T细胞克隆分析,为免疫机制研究提供可靠工具。

ImmuHub®部分科研方向

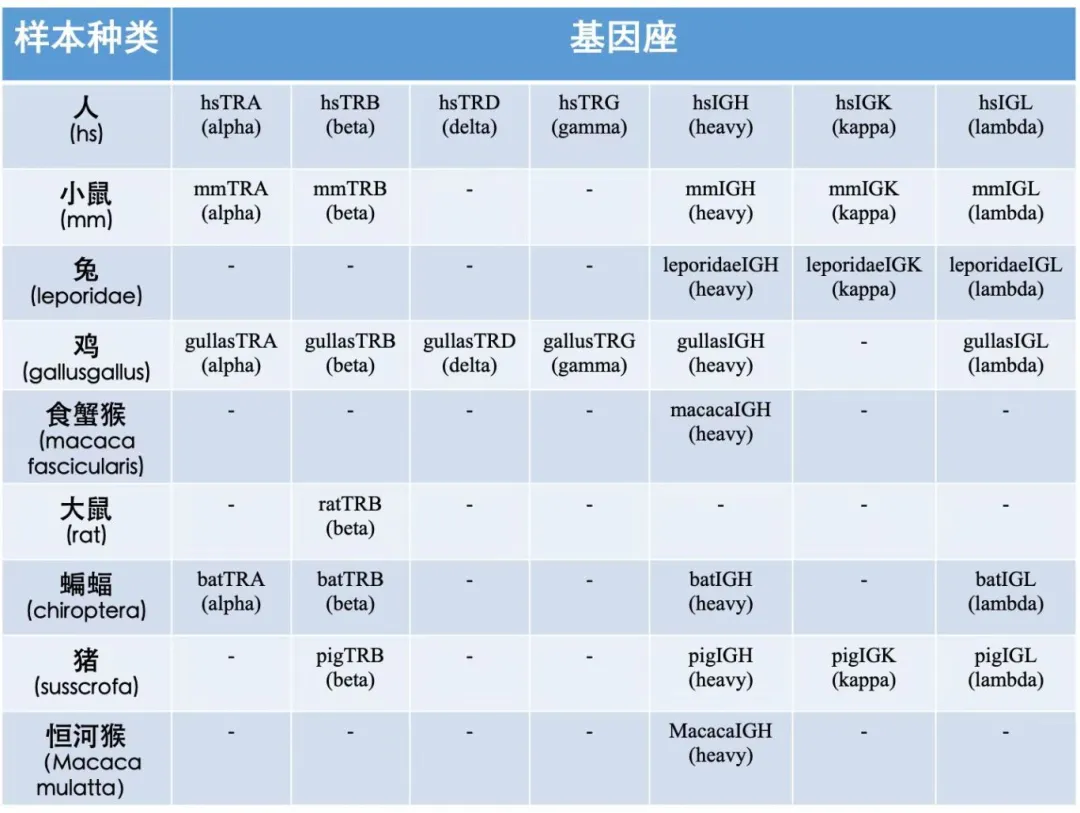
ImmuHub®适用基因座
部分数据分析结果展示
杭州艾沐蒽生物科技有限公司成立于2016年,是国际前沿的专注于免疫驱动医学技术的国家高新技术企业和专精特新企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组基因高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® 免疫力测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®肿瘤早筛、单细胞测序、新抗原、TCR和抗体发现等平台管线。目前为止发表了50余篇论文,其中包括:TheNewEnglandJournalofMedicine(IF:158.5),Nature(IF:65),SignalTransductionandTargetedTherapy(IF:40),CellularandMolecularImmunology(IF:24),NatureCommunications(IF:17)等多篇高分杂志。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。


