еЬ®иВњзШ§еЕНзЦЂж≤їзЦЧйҐЖеЯЯпЉМжКЧеОЯзЙєеЉВжАІTзїЖиГЮеПЧдљУпЉИTCRпЉЙзЪДжњАжіїжШѓжњАеПСжКЧиВњзШ§еЕНзЦЂеПНеЇФзЪДж†ЄењГзОѓиКВгАВжЧ†иЃЇжШѓеЕНзЦЂж£АжЯ•зВєжКСеИґеЙВиБФеРИжФЊзЦЧпЉМињШжШѓжЦ∞еЕізЪДTCR-TзїЖиГЮзЦЧж≥ХпЉМеЕґжИРеКЯйГљз¶їдЄНеЉАеѓєTCR жњАжіїзКґжАБзЪДз≤ЊеЗЖй™МиѓБгАВ
жЬђжЦЗе∞ЖзїУеРИеЫЫй°єеЙНж≤њз†Фз©ґпЉМз≥їзїЯжҐ≥зРЖе¶ВдљХдїОе§ЪзїіеЇ¶гАБе§Ъе±Вжђ°й™МиѓБT зїЖиГЮжШѓеж襀иВњзШ§зЙєеЉВжАІжЦ∞жКЧеОЯзЬЯж≠£жњАжіїпЉМдЄЇеЕНзЦЂж≤їзЦЧз†ФеПСжПРдЊЫеЭЪеЃЮдњЭйЪЬгАВ

3 еРНйХњжЬЯзФЯе≠ШжВ£иАЕпЉИOS 46вАУ104дЄ™жЬИпЉЙ
йАЪињЗеЕ®е§ЦжШЊе≠РжµЛеЇПпЉИWESпЉЙзїУеРИйШіжАІдЄОйШ≥жАІеѓєзЕІпЉМз≠ЫйАЙеЕЛйЪЖжАІдљУзїЖиГЮз™БеПШпЉИFig 1пЉЙпЉМеРИжИРMANAиВљжЃµ
йЗЗйЫЖжВ£иАЕеЯЇзЇњгАБж≤їзЦЧзђђ2-4 еС®жЬЯзЪДPBMCпЉМеИЖз¶їTзїЖиГЮеРОдЄОMANAиВљжЃµеЕ±еЯєеЕїпЉМж®°жЛЯдљУеЖЕжњАжіїињЗз®Л
йЗЗзФ®TCR жµЛеЇПеИЖжЮРCD8+зїЖиГЮзЪДTCR еЇУпЉМеєґйАЪињЗMANAFEST еє≥еП∞ињљиЄ™зЙєеЉВжАІжЙ©еҐЮзЪДTCR еЕЛйЪЖеК®жАБ
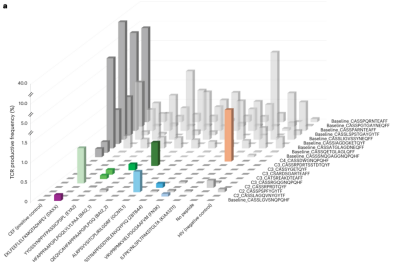
жЧґйЧізЙєеЉВжАІпЉЪжЦ∞жКЧеОЯеПНеЇФжАІTCR дїЕеЬ®ж≤їзЦЧеРОпЉИзђђ2вАУ4еС®жЬЯпЉЙеЗЇзО∞жШЊиСЧжЙ©еҐЮ
жКЧеОЯдЊЭиµЦжАІпЉЪдїЕеЬ®еѓєеЇФMANA иВљеИЇжњАдЄЛеПСзФЯеЕЛйЪЖжЙ©еҐЮпЉМз©ЇзЩљжИЦжЧ†еЕ≥иКВжЃµжЧ†еПШеМЦ
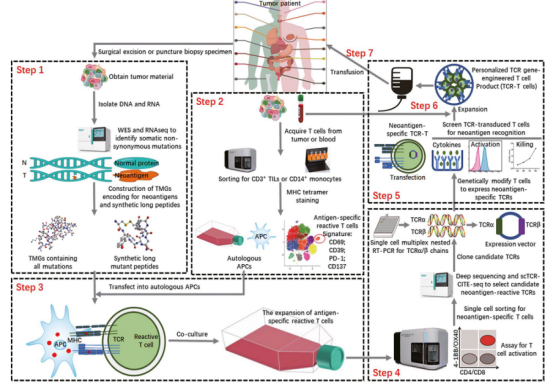
TCR-T¬†зїЖиГЮзЦЧж≥ХзЪД¬†вАЬеЕ®жµБз®ЛжМЗеНЧвАЭвАФвАФ¬†жЦ∞жКЧеОЯзЪДз≠ЫйАЙгАБйЙіеЃЪдЄОдЄіеЇКеЇФзФ®

жКАжЬѓиЈѓеЊД
step 1.з™БеПШиѓЖеИЂдЄОжКЧеОЯиЃЊиЃ°пЉИWES/RNA-seq + TMGs/з™БеПШиВљеЇУпЉЙ
step 2.еАЩйАЙTзїЖиГЮз≠ЫйАЙпЉИscTCR-CITE-seq + PD-1/CD39ж†ЗиЃ∞пЉЙ
step 3.дљУе§ЦеЕ±еЯєеЕїжњАжіїпЉИиЗ™дљУAPCsиіЯиљљжЦ∞жКЧеОЯ + IL-2пЉЙ
step 4.TCRеЕЛйЪЖдЄОиљљдљУжЮДеїЇпЉИжµБеЉПеИЖйАЙ + еНХзїЖиГЮRT-PCRпЉЙ
step 5.еКЯиГљй™МиѓБпЉИIFN-ќ≥йЗКжФЊгАБиВњзШ§жЭАдЉ§еЃЮй™МпЉЙ
step 6.жВ£иАЕTзїЖиГЮжЙ©еҐЮпЉИеИґе§ЗдЄіеЇКзЇІTCR-TдЇІеУБпЉЙ
step 7.дЄіеЇКеЫЮиЊУдЄОзЫСжµЛпЉИзЦЧжХИеПКеЃЙеЕ®жАІиѓДдЉ∞пЉЙ
еЕНзЦЂеОЯжАІж£АжµЛпЉЪELISPOT/ELISA¬†жµЛIFN-ќ≥¬†йЗКжФЊйЗПпЉИеПНжШ†T¬†зїЖиГЮжіїеМЦеЉЇеЇ¶пЉЙпЉМжµБеЉПзїЖиГЮжЬѓжµЛ4-1BBпЉИCD137пЉЙи°®иЊЊпЉИз≠ЫйАЙжіїеМЦT¬†зїЖиГЮпЉЙгАВ
TCRеЕЛйЪЖзЙєеЉВжАІпЉЪйАЪињЗNEST¬†жКАжЬѓпЉИеѓєжѓФеИЇжњАеЙНеРОTCR¬†йҐСзОЗпЉЙжИЦ¬†MANAFEST¬†еЃЮй™МпЉМз°ЃиЃ§TCR¬†еЕЛйЪЖдїЕ襀зЫЃж†ЗжЦ∞жКЧеОЯжњАжіїгАВ
жЭАдЉ§еКЯиГљй™МиѓБпЉЪLDH¬†йЗКжФЊж≥ХжИЦCFSE/7-AAD¬†еПМжЯУж≥ХпЉМж£АжµЛTCR-T¬†зїЖиГЮеѓєи°®иЊЊжЦ∞жКЧеОЯзЪДиВњзШ§зїЖиГЮзЪДжЭАдЉ§жХИзОЗгАВ
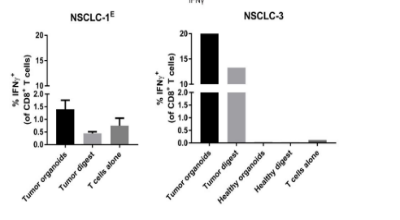
иВњзШ§з±їеЩ®еЃШвАФвАФ¬†дљУе§Цй™МиѓБTCR¬†жњАжіїзЪДвАЬеЊЃеЮЛиВњзШ§ж®°еЮЛвАЭ

дїОеРМдЄАжВ£иАЕеИЖз¶їPBMCs еТМеЯєеЕїиВњзШ§з±їеЩ®еЃШпЉМдљњзФ®IFN-ќ≥ йҐДе§ДзРЖз±їеЩ®еЃШпЉМдљњеЊЧMHC-I еИЖе≠РдЄКи∞ГпЉЫ
еЬ®жКЧCD28 еМЕ襀жЭњдЄ≠еЕ±еЯєеЕїTзїЖиГЮдЄОиВњзШ§з±їеЩ®еЃШпЉМеК†еЕ•IL-2 еТМжКЧPD-1 жКЧдљУпЉЫ
жѓПеС®дљњзФ®жЦ∞й≤Ьз±їеЩ®еЃШињЫи°МеЖНеИЇжњАпЉМеЕ±еЯєеЕї2еС®гАВ
1.жњАжіїж†ЗењЧзЙ©пЉЪCD3+CD8+IFN-ќ≥+ жИЦ CD3+CD8+CD107a+пЉИFig 3пЉЙ
2.зЙєеЉВжАІеУНеЇФпЉЪдїЕеѓєиЗ™дљУиВњзШ§з±їеЩ®еЃШжЬЙеПНеЇФпЉМж≠£еЄЄзїДзїЗжИЦжЧ†еЕ≥иКВеЩ®еЃШжЧ†еУНеЇФ
3.жЭАдЉ§й™МиѓБпЉЪMHC-I йШїжЦ≠еРОиВњзШ§е≠ШжіїзОЗеЫЮеНЗпЉМжіїзїЖиГЮжИРеГПжШЊз§ЇеЗЛдЇ°еҐЮеК†

дїОжВ£иАЕиљђзІїзБґе§ДеИЖз¶їTIL зЙЗжЃµпЉЫ
зФ®иіЯиљљжЦ∞жКЧеОЯзЪДиЗ™дљУAPCs еИЇжњАпЉЫ
еК†еЕ•IL-21еТМIL-2пЉМйАЙжЛ©жАІжЙ©еҐЮ14вАУ19姩гАВ
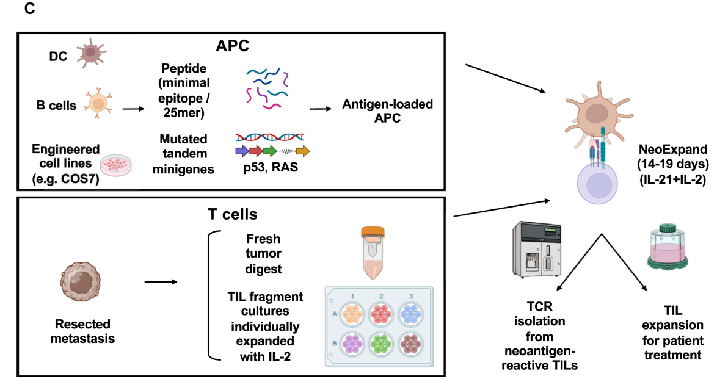
Fig 4
жіїеМЦж†ЗењЧзЙ©пЉЪжµБеЉПж£АжµЛ 4-1BB + жИЦ OX-40+T зїЖиГЮжѓФдЊЛпЉМжѓФдЊЛеНЗйЂШжПРз§ЇзЙєеЉВжАІжњАжіїгАВ
еКЯиГљеУНеЇФпЉЪELISPOT¬†ж£АжµЛ¬†IFN-ќ≥¬†жЦСзВєжХ∞пЉМеПНжШ†¬†T¬†зїЖиГЮеѓєжЦ∞жКЧеОЯзЪДеКЯиГљжАІеЇФз≠ФгАВ
TCR¬†еЕЛйЪЖйЗНеїЇпЉЪдїОжњАжії¬†T¬†зїЖиГЮдЄ≠еЕЛйЪЖ¬†TCRќ±/ќ≤¬†йУЊпЉМиљђеѓЉеИ∞еБ•еЇЈдЊЫдљУ¬†T¬†зїЖиГЮдЄ≠пЉМйАЪињЗ¬†вАЬиВљжЃµжїіеЃЪеЃЮй™МвАЭ¬†з°ЃиЃ§еЕґдїЕиѓЖеИЂз™БеПШиВљпЉИдЄНиѓЖеИЂйЗОзФЯеЮЛпЉЙгАВ
и°®еЮЛеИЖжЮРпЉИscRNA-seqпЉЙпЉЪжЙ©еҐЮзЪД¬†T¬†зїЖиГЮеѓМйЫЖ¬†вАЬеє≤зїЖиГЮж†ЈиЃ∞ењЖ¬†T¬†зїЖиГЮвАЭпЉИйЂШи°®иЊЊ¬†IL7RгАБTCF7пЉМдљОи°®иЊЊ¬†PD-1пЉЙпЉМеЕЈе§ЗйХњжЬЯе≠ШжіїеТМдЇМжђ°еЇФз≠ФиГљеКЫгАВ
дљУеЖЕй™МиѓБпЉЪ
еЃЮй™МиЃЊзљЃпЉЪNSG е∞ПйЉ†зЪЃдЄЛжО•зІНдЇЇиВњзШ§зїЖиГЮпЉИе¶Ви°®иЊЊ p53R175H зЪД TYK-nu зїЖиГЮпЉЙпЉМйЭЩиДЙж≥®е∞Д NeoExpand жЙ©еҐЮзЪДTILsгАВ
зїУжЮЬпЉЪдЄОдЉ†зїЯжЙ©еҐЮзЪДTILs зЫЄжѓФпЉМNeoExpand зїДе∞ПйЉ†иВњзШ§зФЯйХњжШЊиСЧеЗПзЉУпЉМйГ®еИЖе∞ПйЉ†иВњзШ§еЃМеЕ®жґИйААгАВ
дїОиБФеРИж≤їзЦЧз†Фз©ґгАБTCR-TеЕ®жµБз®ЛеЉАеПСпЉМеИ∞з±їеЩ®еЃШж®°еЮЛеТМNeoExpandжЦ∞жКАжЬѓпЉМе§ЪзїіеЇ¶гАБе§Ъе±Вжђ°зЪДTCRжњАжіїй™МиѓБжЦєж≥Хж≠£еЬ®дЄНжЦ≠жО®еК®иВњзШ§еЕНзЦЂж≤їзЦЧеРСз≤ЊеЗЖгАБйЂШжХИзЪДжЦєеРСеПСе±ХгАВйАЪињЗзїЉеРИињРзФ®е§ЪзІНеИЖе≠РзФЯзЙ©е≠¶еПКеКЯиГљжАІеЃЮй™МпЉМжИСдїђиГље§ЯжЫіеПѓйЭ†еЬ∞иѓДдЉ∞TзїЖиГЮжњАжіїзЪДзЙєеЉВжАІпЉМдЄЇеЯЇдЇОTCRзЩМзЧЗеИЫжЦ∞еЕНзЦЂзЦЧж≥ХзЪДжИРеКЯеЇФзФ®дњЭй©ЊжК§иИ™гАВ
1. Huang, J., Theelen, W.S.M.E., Belcaid, Z. et al. Combination of pembrolizumab and radiotherapy induces systemic antitumor immune responses in immunologically cold non-small cell lung cancer. Nat Cancer (2025). https://doi.org/10.1038/s43018-025-01018-w
2. Li, J., Xiao, Z., Wang, D. et al. The screening, identification, design and clinical application of tumor-specific neoantigens for TCR-T cells. Mol Cancer 22, 141 (2023). https://doi.org/10.1186/s12943-023-01844-5
3. Krijn K. Dijkstra, Chiara M. Cattaneo, Fleur Weeber et al., Generation of Tumor-Reactive T Cells by Co-culture of Peripheral Blood Lymphocytes and Tumor Organoids, Cell, Volume 174, Issue 6, 2018, Pages 1586-1598.e12,  https://doi.org/10.1016/j.cell.2018.07.009.
4. Levin N, Kim SP, Marquardt CA, Vale NR, Yu Z, Sindiri S, et al. Neoantigen-specific stimulation of tumor-infiltrating lymphocytes enables effective TCR isolation and expansion while preserving stem-like memory phenotypes. Journal for ImmunoTherapy of Cancer. 2024;12:e008645. https://doi.org/10.1136/jitc-2023-008645

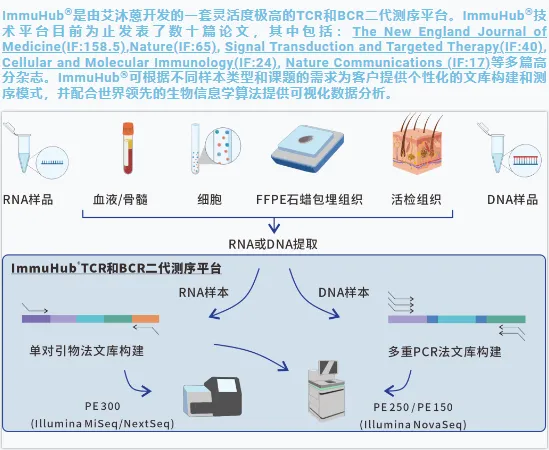
ImmuHub¬ЃйГ®еИЖзІСз†ФжЦєеРС

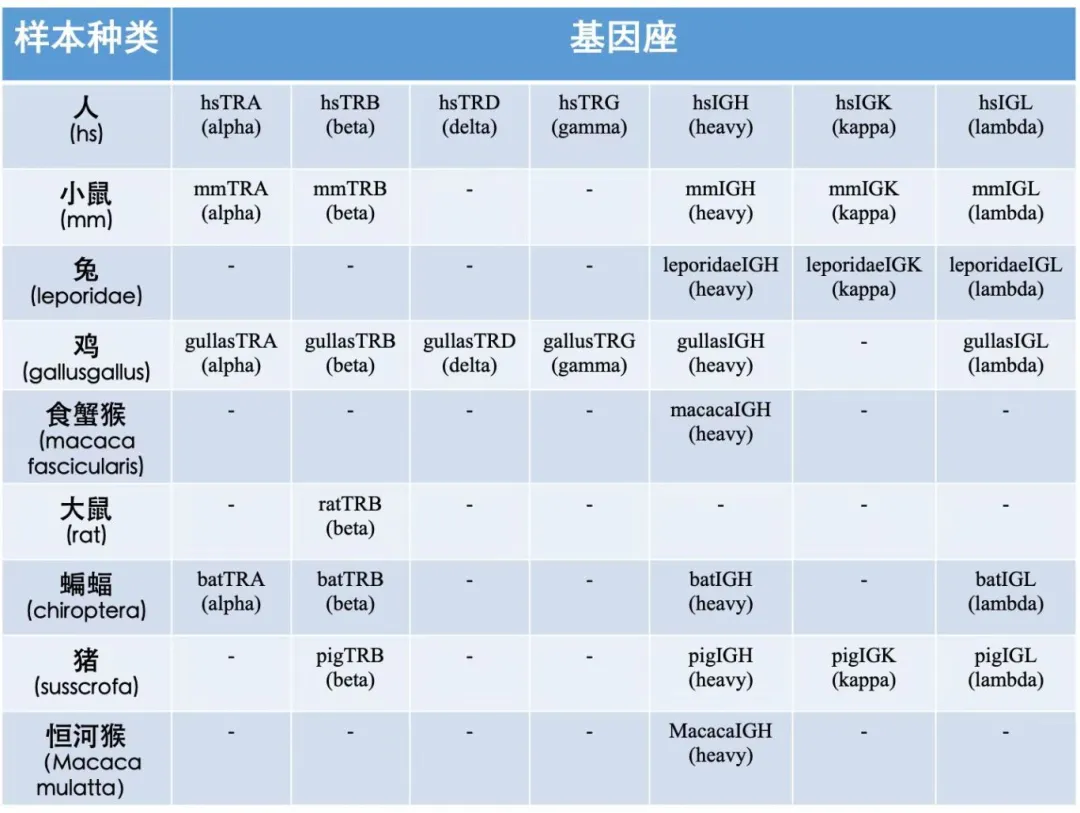
ImmuHub¬ЃйАВзФ®еЯЇеЫ†еЇІ
йГ®еИЖжХ∞жНЃеИЖжЮРзїУжЮЬе±Хз§Ї
жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪеТМдЄУз≤ЊзЙєжЦ∞дЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†еЕНзЦЂеКЫжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБжЦ∞жКЧеОЯгАБTCRеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВзЫЃеЙНдЄЇж≠ҐеПСи°®дЇЖ50дљЩзѓЗиЃЇжЦЗпЉМеЕґдЄ≠еМЕжЛђпЉЪThe New England Journal of Medicine(IF:158.5), Nature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24), Nature Communications (IF:17)з≠Йе§ЪзѓЗйЂШеИЖжЭВењЧгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ


