жЈЛеЈізШ§жШѓиµЈжЇРдЇОжЈЛеЈійА†и°Аз≥їзїЯзЪДжБґжАІиВњзШ§пЉМдї•жЧ†зЧЫжАІжЈЛеЈізїУиВње§ІдЄЇеЄЄиІБи°®зО∞пЉМињШеПѓиГљдЉійЪПиВЭиДЊиВње§ІеПКеПСзГ≠гАБзЫЧж±ЧгАБжґИзШ¶з≠ЙеЕ®иЇЂзЧЗзКґпЉМеПѓзіѓеПКеЕ®иЇЂеРДзїДзїЗеЩ®еЃШгАВжЈЛеЈізШ§дЇЪеЮЛдЉЧе§ЪпЉМе§ІдљУеПѓеИЖдЄЇйЬНе•ЗйЗСжЈЛеЈізШ§еТМйЭЮйЬНе•ЗйЗСжЈЛеЈізШ§дЄ§е§Із±їпЉМдЄНеРМдЇЪеЮЛеЬ®иѓКзЦЧеТМйҐДеРОдЄКеЈЃеЉВжШОжШЊгАВ
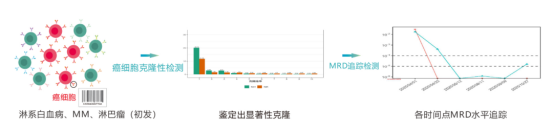
MRDж£АжµЛжШѓиѓДдЉ∞иВњзШ§ж≤їзЦЧжХИжЮЬеТМеИ§жЦ≠йҐДеРОзЪДйЗНи¶БжЙЛжЃµпЉМдЄНеРМзЪДMRDж£АжµЛжЦєж≥Хе¶Вељ±еГПе≠¶гАБжµБеЉПзїЖиГЮжЬѓгАБеИЖе≠РзФЯзЙ©е≠¶з≠ЙеРДжЬЙеЕґйАВзФ®еЬЇжЩѓгАВйЪПзЭАдЇМдї£жµЛеЇПпЉИNGSпЉЙжКАжЬѓзЪДеєњж≥ЫеЕіиµЈпЉМеЫ†еЕґйЂШйАЪйЗПгАБйЂШзБµжХПеЇ¶пЉМеЇФзФ®дЇОжЈЛеЈізШ§MRDж£АжµЛйҐЖеЯЯеПЦеЊЧдЇЖеЊИе•љзЪДжХИжЮЬгАВ
дЄЛйЭҐе∞ПзЉЦиѓ¶зїЖдЄЇе§ІеЃґдїЛзїНеЯЇдЇОеЕНзЦЂзїДпЉИIG/TCRпЉЙзЪДжЈЛеЈізШ§NGS MRDж£АжµЛжКАжЬѓ~

жЈЛеЈізШ§жШѓдЄАзІНжБґжАІиВњзШ§пЉМзФ±жЈЛеЈізїЖиГЮеЉВеЄЄеҐЮжЃЦеЉХиµЈпЉМж†єжНЃжЈЛеЈізїЖиГЮз±їеЮЛеТМзЧЕеПШзЪДйГ®дљНеПѓеИЖдЄЇдЄНеРМдЇЪеЮЛгАВ
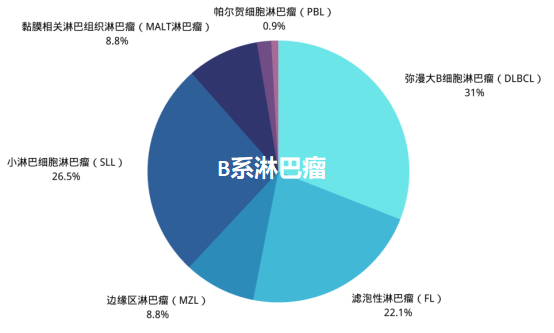
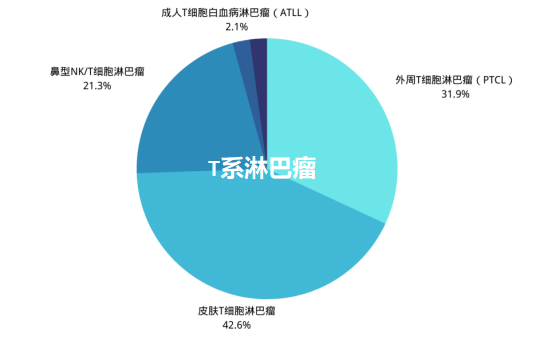
жЈЛеЈізШ§е§ІдљУеПѓеИЖдЄЇйЬНе•ЗйЗСжЈЛеЈізШ§пЉИHLпЉЙпЉИеН†10%пЉЙеТМйЭЮйЬНе•ЗйЗСжЈЛеЈізШ§пЉИNHLпЉЙпЉИеН†90%пЉЙдЄ§е§Із±їгАВйЭЮйЬНе•ЗйЗСжЈЛеЈізШ§дЄїи¶БеМЕжЛђBзїЖиГЮжЈЛеЈізШ§пЉИзЇ¶еН†70%пЉЙеТМT/NKзїЖиГЮжЈЛеЈізШ§пЉИзЇ¶еН†20%пЉЙгАВ
BзїЖиГЮжЈЛеЈізШ§жШѓжМЗжЈЛеЈізїЖиГЮдЄ≠зЪДBзїЖиГЮеПСзФЯжБґжАІеПШеЉВпЉМ嚥жИРиВњзШ§гАВBзїЖиГЮжЈЛеЈізШ§еМЕжЛђеЉ•жЉЂе§ІBзїЖиГЮжЈЛеЈізШ§гАБжї§ж≥°жАІжЈЛеЈізШ§гАБе∞ПжЈЛеЈізїЖиГЮжЈЛеЈізШ§з≠ЙдЄНеРМдЇЪеЮЛгАВ
TзїЖиГЮжЈЛеЈізШ§жШѓжМЗжЈЛеЈізїЖиГЮдЄ≠зЪДTзїЖиГЮеПСзФЯжБґжАІеПШеЉВпЉМдїОиАМ嚥жИРиВњзШ§гАВеПѓдї•ж†єжНЃеПСзЧЕйГ®дљНеИЖдЄЇпЉЪзЪЃиВ§TзїЖиГЮжЈЛеЈізШ§гАБе§ЦеС®TзїЖиГЮжЈЛеЈізШ§гАБжИРдЇЇTзїЖиГЮзЩљи°АзЧЕжЈЛеЈізШ§з≠ЙдЄНеРМдЇЪеЮЛгАВ
ctDNAдїЛзїН
ctDNAпЉИCirculating Tumor DNAпЉЙжШѓжМЗиВњзШ§зїЖиГЮйЗКжФЊињЫеЕ•и°Ажґ≤еЊ™зОѓдЄ≠зЪДDNAеИЖе≠РгАВ
зФ±дЇОиВњзШ§зїЖиГЮеЬ®дЄНжЦ≠еИЖи£ВзФЯйХњзЪДињЗз®ЛдЄ≠пЉМдЉЪйЗКжФЊдЄАйГ®еИЖDNAињЫеЕ•и°Ажґ≤еЊ™зОѓдЄ≠пЉМињЩдЇЫDNAеИЖе≠РжРЇеЄ¶дЇЖиВњзШ§зїЖиГЮзЪДйБЧдЉ†дњ°жБѓпЉМеσ俕襀ж£АжµЛеИ∞гАВеЫ†ж≠§пЉМctDNAеПѓдї•дљЬдЄЇиВњзШ§зФЯзЙ©ж†ЗењЧзЙ©ињЫи°МзЫСжµЛпЉМзФ®дЇОиВњзШ§зЪДжЧ©жЬЯз≠ЫжЯ•гАБиѓКжЦ≠гАБж≤їзЦЧжХИжЮЬиѓДдЉ∞еТМе§НеПСзЫСжµЛз≠ЙжЦєйЭҐгАВ
зЫЄжѓФдЇОдЉ†зїЯзЪДиВњзШ§ж£АжµЛжЦєж≥ХпЉИе¶ВзїДзїЗжіїж£АеТМељ±еГПе≠¶ж£АжЯ•з≠ЙпЉЙпЉМctDNAеЕЈжЬЙиЊГе§ЪеИЫжЦ∞жАІзЪДдЉШзВє:
-
йЭЮдЊµеЕ•жАІпЉЪдЄНйЬАи¶БеИЗйЩ§иВњзШ§зїДзїЗжИЦињЫи°Мз©њеИЇз≠ЙжУНдљЬпЉМеЗПе∞СдЇЖеѓєжВ£иАЕиЇЂдљУзЪДеИЫдЉ§еТМзЦЉзЧЫгАВ
-
йЗНе§НжАІпЉЪеПѓдї•еПНе§НињЫи°Мж£АжµЛпЉМдЄНеПЧиВњзШ§йГ®дљНгАБе§Іе∞ПгАБжЈ±еЇ¶з≠ЙеЫ†зі†зЪДељ±еУНгАВ
-
зБµжХПеЇ¶йЂШпЉЪеПѓдї•ж£АжµЛеИ∞иВњзШ§еЊЃе∞ПеПШеМЦпЉМжѓФе¶ВеЊЃе∞ПзЪДжЃЛзХЩзЧЕзБґеТМеЊЃиљђзІїз≠ЙгАВ
-
зЙєеЉВжАІеЉЇпЉЪctDNAжШѓжЭ•иЗ™иВњзШ§зїЖиГЮзЪДDNAпЉМеЫ†ж≠§еПѓдї•йБњеЕНиѓѓиѓКжИЦжЉПиѓКгАВ


еЯЇдЇО ctDNA зЪДжЦєж≥ХеЬ®жЈЛеЈізШ§зЪДиѓКжЦ≠еТМж≤їзЦЧдЄ≠еЕЈжЬЙеЊИе§ІзЪДжљЬеКЫпЉМctDNA ж£АжµЛеПѓдї•дљЬдЄЇдЄАзІНйЭЮдЊµеЕ•жАІзЪДиѓКжЦ≠жЦєж≥ХпЉМиГље§ЯеѓєжВ£иАЕжШѓеР¶жВ£жЬЙжЈЛеЈізШ§еПКзЩМзїЖиГЮжЃЛзХЩж∞іеє≥ињЫи°МењЂйАЯгАБеЗЖз°ЃзЪДж£АжµЛгАВ
зЫЃеЙНеЯЇдЇОctDNAзЪДMRDж£АжµЛжЦєж≥ХдЄїи¶БжЬЙеЯЇеЫ†з™БеПШдљНзВєзЪДж£АжµЛеТМIg/TCRзЪДж£АжµЛгАВ
еЯЇдЇОctDNAзЪДеЯЇеЫ†з™БеПШж£АжµЛпЉМиЩљзДґдЄіеЇКеПѓж†єжНЃж£АжµЛзїУжЮЬињЫи°МеѓєеЇФзФ®иНѓзЪДжМЗеѓЉпЉМдљЖеЬ®MRDж£АжµЛдЄКдєЯе≠ШеЬ®дЄАдЇЫеК£еКњдєЛе§ДпЉМжѓФе¶ВпЉЪ
[вЕ†]з™БеПШж£АжµЛзїУжЮЬеПЧеИ∞иЃЄе§ЪеЫ†зі†зЪДељ±еУНпЉМе¶ВctDNAжµУеЇ¶гАБиВњзШ§зїЖиГЮзЪДи£ВиІ£жГЕеЖµз≠ЙпЉМеПѓиГљдЉЪеѓЉиЗіеБЗйШ≥жАІжИЦеБЗйШіжАІзїУжЮЬгАВ
[вЕ°]еЯЇдЇОctDNAзЪДз™БеПШж£АжµЛжЦєж≥ХжЧ†ж≥Хз°ЃеЃЪз™БеПШжЭ•иЗ™еУ™дЇЫзїЖиГЮпЉМеПѓиГљдЉЪжО©зЫЦзЬЯж≠£зЪДиВњзШ§зїЖиГЮпЉМдїОиАМеѓЉиЗіжЉПиѓКгАВ
[вЕҐ]дїЈж†ЉиЊГйЂШгАВ
зЫЄжѓФдєЛдЄЛпЉМеЯЇдЇОctDNAзЪДIg/TCR MRDж£АжµЛжЦєж≥ХеЕЈжЬЙдї•дЄЛдЉШеКњеТМдЄіеЇКеЇФзФ®еКЯиГљзЙєзВєпЉЪ
-
зБµжХПеЇ¶йЂШпЉЪеПѓдї•ж£АжµЛеИ∞жЮБдљОжµУеЇ¶зЪДctDNAпЉМдїОиАМж£АжµЛеИ∞еЊЃе∞ПзЪДжЃЛзХЩзЧЕзБґеТМеЊЃиљђзІїз≠ЙгАВ
-
зЙєеЉВжАІеЉЇпЉЪеЯЇдЇОIg/TCRйЗНжОТзЪДMRDж£АжµЛжЦєж≥ХиВњзШ§еЕЛйЪЖеЇПеИЧзЙєеЉВжАІйЂШпЉМеЗПе∞СдЇЖеБЗйШ≥жАІжИЦеБЗйШіжАІзЪДеПѓиГљжАІгАВ
-
йЗНе§НжАІе•љпЉЪеПѓдї•еПНе§НињЫи°Мж£АжµЛпЉМйЪПжЧґзЫСжµЛзЦЊзЧЕињЫе±ХжГЕеЖµгАВ
-
еПѓзЫСжµЛж≤їзЦЧжХИжЮЬпЉЪеЯЇдЇОIg/TCRйЗНжОТж£АжµЛзЪДжЦєж≥ХеПѓдї•еПКжЧґзЫСжµЛMRDж∞іеє≥пЉМиѓДдЉ∞ж≤їзЦЧжХИжЮЬпЉМеЄЃеК©еМїзФЯињЫи°МдЄ™жАІеМЦж≤їзЦЧгАВ
-
жМЗеѓЉеИЖе±Вж≤їзЦЧпЉЪж†єжНЃиѓ±еѓЉзЉУиІ£ж≤їзЦЧжЧ©жЬЯеПКеЈ©еЫЇж≤їзЦЧеЉАеІЛеЙНMRDж∞іеє≥еѓєжВ£иАЕињЫи°МеН±йЩ©еЇ¶еИЖе±ВпЉМжМЗеѓЉеИЖе±Вж≤їзЦЧгАВ

еЯЇдЇОIG/TCRзЪДNGS MRDж£АжµЛжКАжЬѓдЄїи¶БйАВзФ®дЇОжЈЛз≥їи°Ажґ≤иВњзШ§пЉМеМЕжЛђB/Tз≥їзЩљи°АзЧЕгАБе§ЪеПСжАІй™®йЂУзШ§еТМB/Tз≥їжЈЛеЈізШ§гАВ
жЈЛз≥їи°Ажґ≤иВњзШ§жШѓT/BжЈЛеЈізїЖиГЮеПСзФЯзЩМеПШиАМеѓЉиЗіпЉМељУT/BжЈЛеЈізїЖиГЮеПСзФЯзЩМеПШжЧґпЉМдЉЪе§ІйЗПе§НеИґеҐЮжЃЦгАВиАМеЕґи°®йЭҐзЪДзФЯзЙ©ж†ЗењЧзЙ©TCR/BCRжШѓдЄНеПСзФЯжФєеПШзЪДпЉМйАЪињЗйЂШйАЪйЗПжµЛеЇПжЙЊеИ∞ињЩдЇЫеЗЇзО∞йҐСзОЗеЊИйЂШзЪДзЩМзїЖиГЮеПЧдљУVDJеЯЇеЫ†еЇПеИЧпЉМеЬ®ж≤їзЦЧеРОеѓєж≠§еЯЇеЫ†еЇПеИЧињЫи°МињљиЄ™пЉМжЯ•жЙЊеЕґеЕЛйЪЖжГЕеЖµпЉМеЊЧеИ∞MRDеАЉгАВ
ињЩдЄНеРМдЇОеЯЇеЫ†з™БеПШж£АжµЛз≠ЙеЕґеЃГеЯЇеЫ†жµЛеЇПпЉМеЯЇеЫ†з™БеПШж£АжµЛжШѓеИЖжЮРDNAжЮДи±°жИЦиІ£йУЊзЙєжАІпЉМжИЦиАЕеИ©зФ®DNAеПШжАІеТМе§НжАІз≠ЙзЙєжАІпЉМињЫи°МDNAз™БеПШзЪДеИЖжЮРпЉМдєЯе∞±жШѓйАЪињЗдЄАдЇЫеЯЇеЫ†з™БеПШдњ°жБѓжЭ•йЙіеЃЪзЩМзїЖиГЮгАВиАМNGS MRDжШѓеЯЇдЇОжµЛеИ∞зЪДеПѓеПШеМЇеЇПеИЧ( еЕЛйЪЖ)йҐСзОЗйЂШдљОжЭ•йЙіеЃЪзЩМзїЖиГЮпЉМдЄ§иАЕж£АжµЛеОЯзРЖдЄНеРМгАВеН≥дЊњзЩМзїЖиГЮDNAеПСзФЯдЇЖз™БеПШпЉМTCR/BCRйАЪеЄЄжШѓз®≥еЃЪдЄНеПШзЪДпЉМдЊЭзДґеПѓдї•ињЫи°МињљиЄ™гАВ

ж£АжµЛз±їеЮЛеИЖдЄЇеИЭиѓКзЪДеЯЇзЇњж£АжµЛеТМж≤їзЦЧеРОзЪДињљиЄ™ж£АжµЛгАВ
пЉИ1пЉЙзЩМзїЖиГЮеЕЛйЪЖжАІж£АжµЛ
йАЪињЗжВ£иАЕеИЭиѓКжИЦзЩМзїЖиГЮйЂШиіЯиНЈжЧґзЪДж†ЈжЬђпЉМйЙіеЃЪеЗЇжШЊиСЧжАІеЕЛйЪЖпЉИеН≥зЩМзїЖиГЮеЕЛйЪЖеЇПеИЧпЉЙгАВ
пЉИ2пЉЙMRDињљиЄ™ж£АжµЛ
еИ©зФ®з≠ЫжЯ•еЗЇзЪДзЩМзїЖиГЮеЕЛйЪЖеЇПеИЧпЉМеЬ®ж≤їзЦЧжЬЯйЧіжИЦж≤їзЦЧеРОиѓДдЉ∞MRDж∞іеє≥пЉМзЫСжµЛзЩМзїЖиГЮеРЂйЗПпЉМеРМжЧґж£АжµЛиѓЖеИЂжЦ∞еЗЇзО∞зЪДзЩМзїЖиГЮеЇПеИЧгАВ
йЬАи¶Бж≥®жДПзЪДжШѓпЉМењЕй°їеЕИеѓєеИЭиѓКж†ЈжЬђжИЦиАЕиВњзШ§йЂШиіЯиНЈж†ЈжЬђињЫи°МеЕЛйЪЖжАІж£АжµЛпЉМжЙЊеИ∞еПѓзФ®дЇОињљиЄ™зЪДзЩМзїЖиГЮеЕЛйЪЖеЇПеИЧдєЛеРОпЉМжЙНиГљеЬ®ж≤їзЦЧеРОињЫи°МMRDињљиЄ™ж£АжµЛгАВе¶ВжЮЬеЯЇзЇњж£АжµЛж≤°жЬЙжЙЊеИ∞еПѓињљиЄ™зЪДжШЊиСЧжАІеЕЛйЪЖпЉМеН≥дЄЇе§ЪеЕЛйЪЖеЮЛпЉМеИЩдЄНйАВеРИж≠§жКАжЬѓжЦєж≥ХињЫи°МMRDињљиЄ™гАВ

дЄНеРМдЇОзЩљи°АзЧЕгАБе§ЪеПСжАІй™®йЂУзШ§з≠Йи°Ажґ≤зЩМзЧЗпЉМжЈЛеЈізШ§жЧҐе±ЮдЇОT/BзїЖиГЮзЩМеПШжЙАиЗізЪДи°Ажґ≤иВњзШ§пЉМеПИеРМжЧґеЕЉеЕЈеЃЮдљУиВњзШ§зЪДзЙєзВєвАФвАФзїДзїЗзЩМеПШпЉМеЬ®жЯРдЇЫдЇЪеЮЛжИЦеИЖжЬЯзЪДжЈЛеЈізШ§жВ£иАЕдЄ≠пЉМй™®йЂУеТМе§ЦеС®и°АдЄ≠дЄНдЄАеЃЪжЬЙзЩМзїЖиГЮзіѓеПКгАВ
еЫ†ж≠§жЈЛеЈізШ§зЪДеИЭиѓКеЕЛйЪЖжАІж£АжµЛеїЇиЃЃдљњзФ®иВњзШ§зїДзїЗж†ЈжЬђжПРеПЦgDNAињЫи°Мж£АжµЛпЉМMRDињљиЄ™ж£АжµЛпЉИж≤їзЦЧеРОпЉЙйЬАи¶БжПРеПЦе§ЦеС®и°АctDNAињЫи°МжЃЛзХЩж£АжµЛгАВиЛ•жЧ†ж≥ХжПРдЊЫеИЭиѓКзЪДиВњзШ§зїДзїЗж†ЈжЬђпЉМеП™иГљжПРдЊЫй™®йЂУ/е§ЦеС®и°Аж†ЈжЬђзЪДиѓЭпЉМйЬАи¶БдЄіеЇКеМїзФЯз°ЃиЃ§й™®йЂУ/е§ЦеС®и°АдЄ≠жШѓжЬЙзЩМзїЖиГЮзіѓеПКзЪДгАВ
жЈЛеЈізШ§зЪДеЯЇдЇОIG/TCRзЪДNGS MRDж£АжµЛйАБж†Ји¶Бж±Ве¶ВдЄЛпЉЪ
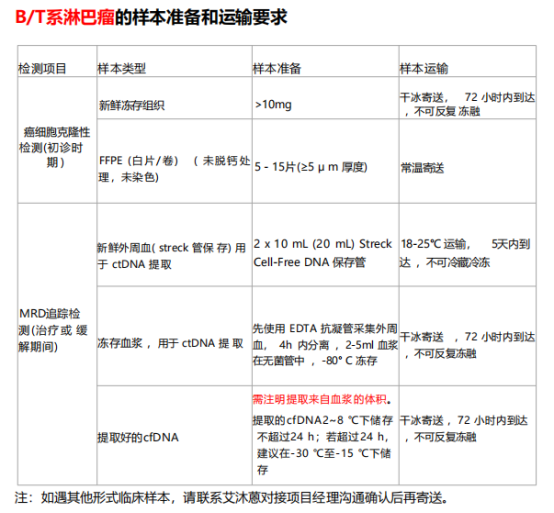
жЈЛеЈізШ§зЪДеЯЇдЇОIG/TCRзЪДNGS MRDж£АжµЛпЉМдЄАжЦєйЭҐеЇФзФ®дЇОдЄіеЇКдЄ≠иѓДдЉ∞ж≤їзЦЧжХИжЮЬпЉМйҐДжµЛйҐДеРОпЉЫеП¶дЄАжЦєйЭҐињШеПѓдљЬдЄЇиНѓзЙ©дЄіеЇКиѓХй™МзЪДзїИзВєпЉМиѓДдїЈиНѓзЙ©зЦЧжХИгАВдЄЛйЭҐеИЖдЇЂ2зѓЗжЈЛеЈізШ§NGS MRDеЇФзФ®зЪДйЂШеИЖжЦЗзЂ†~


еПСи°®жЬЯеИКпЉЪHaematologicaпЉИIFпЉЪ7.9пЉЙ
еПСи°®жЧґйЧіпЉЪ2025еєі7жЬИ
иѓ•з†Фз©ґжФґйЫЖдЇЖ73дЊЛжЦ∞иѓКжЦ≠зЪДеЉ•жЉЂе§ІBзїЖиГЮжЈЛеЈізШ§пЉИDLBCLпЉЙжВ£иАЕзЪДиВњзШ§FFPEж†ЈжЬђеТМе§ЦеС®и°Аж†ЈжЬђпЉМж£АжµЛIGHйУЊеТМIGKйУЊйЗНжОТгАВйАЪињЗињљиЄ™ctDNAж†ЈжЬђзЪДIGеЕЛйЪЖпЉМиѓДдЉ∞ж≤їзЦЧжЬЯйЧіпЉИдЄ≠жЬЯпЉЙеТМж≤їзЦЧзїУжЭЯжЧґпЉИEOTпЉЙзЪДMRDзКґжАБгАВ
дЄ≠жЬЯжЧґпЉМ71.1% ctDNA MRDйШіжАІпЉМ28.9%дЄЇйШ≥жАІпЉМctDNA MRDдЄОPFSжШЊиСЧзЫЄеЕ≥пЉИеЫЊ1пЉЙгАВEOTжЧґпЉМ78.7%дЄЇйШіжАІпЉМ21.3%дЄЇйШ≥жАІгАВctDNA MRDдЄОPFSжШЊиСЧзЫЄеЕ≥пЉМжЙАжЬЙйШ≥жАІжВ£иАЕеЭЗе§НеПСпЉИеЫЊ2пЉЙгАВиѓіжШОеЯЇдЇОIGзЪДNGS MRDзїУжЮЬеПѓдї•йҐДжµЛйҐДеРОгАВ
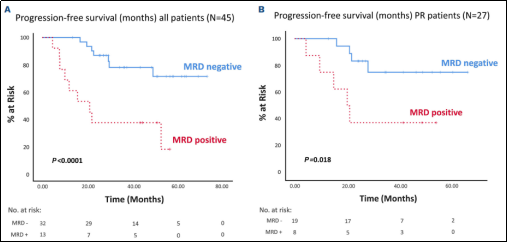
еЫЊ1.ж≤їзЦЧдЄ≠жЬЯMRDзїУжЮЬдЄОйҐДеРОзЪДеЕ≥з≥ї
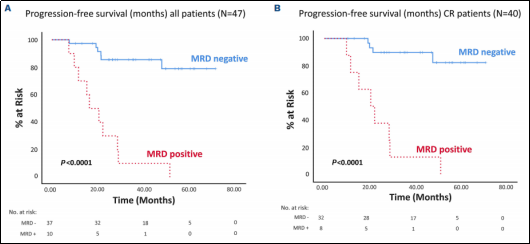
еЫЊ2.ж≤їзЦЧзїУжЭЯжЧґMRDзїУжЮЬдЄОйҐДеРОзЪДеЕ≥з≥ї


еПСи°®жЬЯеИКпЉЪJOURNAL OF CLINICAL ONCOLOGYпЉИIFпЉЪ42.1пЉЙ
еПСи°®жЧґйЧіпЉЪ2023еєі4жЬИ
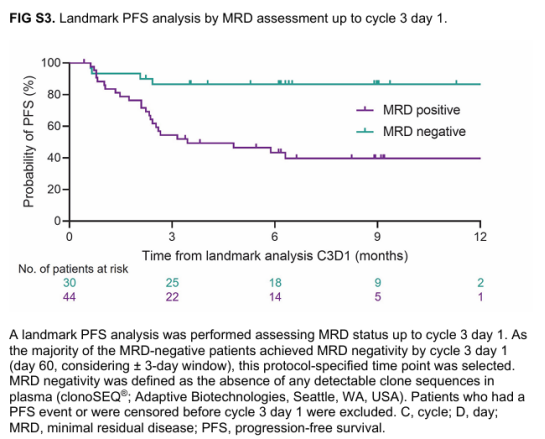
ињЩжШѓдЄАй°єеЕ≥дЇОEpcoritamabпЉИдЄАзІНжЦ∞еЮЛзЪДзЪЃдЄЛж≥®е∞ДCD3xCD20еПМзЙєеЉВжАІTзїЖиГЮжО•еРИжКЧдљУпЉЙеЬ®ж≤їзЦЧе§НеПСжИЦйЪЊж≤їжАІеЉ•жЉЂе§ІBзїЖиГЮжЈЛеЈізШ§пЉИLBCLпЉЙдЄ≠зЪДдЄіеЇКиѓХй™Мз†Фз©ґгАВеЬ®иѓ•з†Фз©ґдЄ≠йЗЗзФ®еЯЇдЇОIG зЪДNGS MRDж£АжµЛдљЬдЄЇжΥ糥жАІзїИзВєгАВ
з†Фз©ґеПСзО∞пЉМC3D1жЧґпЉМ45.8%зЪДжВ£иАЕдЄЇMRDйШіжАІгАВдЄОMRDйШ≥жАІжВ£иАЕзЫЄжѓФпЉМMRDйШіжАІжВ£иАЕеЕЈжЬЙжЫійХњзЪДPFSгАВ
-
Soscia R, Assanto GM, Starza ID, et al. Molecular measurable residual disease by immunoglobulin gene rearrangements on circulating tumor DNA predicts outcome in diffuse large B-cell lymphoma. Haematologica. 2025;110(7):1573-1583.
-
Thieblemont C, Phillips T, Ghesquieres H, et al. Epcoritamab, a Novel, Subcutaneous CD3xCD20 Bispecific T-Cell-Engaging Antibody, in Relapsed or Refractory Large B-Cell Lymphoma: Dose Expansion in a Phase I/II Trial. J Clin Oncol. 2023;41(12):2238-2247.

иЙЊж≤РиТљдЄУж≥®дЇОеЕНзЦЂзїДдЇМдї£жµЛеЇПйҐЖеЯЯе§ЪеєіпЉМжШѓеЕ®еЫљй¶ЦеЃґжО®еЗЇи°Ажґ≤иВњзШ§NGS MRDж£АжµЛдЇІеУБSeq-MRD¬ЃзЪДеЕђеПЄгАВSeq-MRD¬ЃйАВзФ®дЇОB/Tз≥їзЩљи°АзЧЕгАБB/Tз≥їжЈЛеЈізШ§гАБе§ЪеПСжАІй™®йЂУзШ§пЉМиГље§ЯеЄЃеК©дЄіеЇКеМїзФЯйҐДжµЛйХњжЬЯзЦЧжХИгАБиѓДдЉ∞ж≤їзЦЧжХИжЮЬгАБзЫСжµЛзЉУиІ£зКґжАБдї•еПКзЫСжµЛжЧ©жЬЯе§НеПСгАВзїПињЗе§ЪеєізЪДзІѓзіѓеТМеПСе±ХпЉМSeq-MRD¬ЃеЬ®дЄіеЇКж£АжµЛеТМзІСе≠¶з†Фз©ґдЄКеЭЗеПЦеЊЧдЄНе∞СжИРжЮЬпЉМеєґиОЈеЊЧеЫљйЩЕеЄВеЬЇиЃ§еПѓгАВ
иОЈеЊЧжђІзЫЯCEиµДиі®иЃ§иѓБ
Seq-MRD¬ЃиОЈеЊЧжђІзЫЯCEиµДиі®пЉИж≥®еЖМеПЈпЉЪDE/CA20/01-IVD-Luxuslebenswelt-190/22пЉЙпЉМиОЈжЙєзЪДжШѓдЇЇжЈЛеЈіBзїЖиГЮеЊЃе∞ПжЃЛзХЩзЧЕеЯЇеЫ†ж£АжµЛиѓХеЙВзЫТпЉИеПѓйАЖжЬЂзЂѓзїИж≠ҐжµЛеЇПж≥ХпЉЙгАВ¬†

иОЈеЊЧдЄЙй°єеПСжШОдЄУеИ©
иЙЊж≤РиТљжО®еЗЇзЪДSeq-MRD¬Ѓи°Ажґ≤зЩМзЧЗMRDж£АжµЛжШѓжЬАжЧ©жЙєеЃЮзО∞еХЖдЄЪеМЦзЪДдЇІеУБпЉМиЗ™2016еєіз†ФеПСдЄУеИ©жКАжЬѓиЗ≥дїКпЉМиЙЊж≤РиТљSeq-MRD¬ЃеЈ≤зїПиОЈеЊЧ3й°єеЫљеЃґеПСжШОдЄУеИ©пЉЪ
[1]вАЬдЄАзІНеЇФзФ®дЇОйЂШйАЪйЗПжµЛеЇПж£АжµЛTзїЖиГЮзЩљи°АзЧЕеЊЃе∞ПжЃЛзХЩзЧЕзЪДеЉХзЙ©зїДеРИеПКиѓХеЙВзЫТвАЭпЉИдЄУ еИ© еПЈ: 2016 11204857.0пЉМжОИжЭГеЕђеСКеПЈ:CN 106957906 BпЉЙ
[2]вАЬдЄАзІНж£АжµЛеЊЃе∞ПжЃЛзХЩзЧЕMRDзЪДиѓХеЙВзЫТвАЭпЉИдЄУ еИ© еПЈ: 2018 1 1550133.0пЉМжОИжЭГеЕђеСКеПЈ: CN 109652518 BпЉЙ
[3]вАЬдЄАзІНж£АжµЛеЊЃе∞ПжЃЛзХЩзЧЕMRDзЪДжЦєж≥ХвАЭпЉИдЄУ еИ© еПЈ: 2018 1 1549203.0пЉМжОИжЭГеЕђеСКеПЈ: CN 109680062 BпЉЙ

иОЈеЊЧзЫЄеЕ≥иљѓдїґиСЧдљЬ
[1]вАЬеЕНзЦЂзїДеЇУMRDж£АжµЛиЗ™еК®еМЦжК•еСКз≥їзїЯ[зЃАзІ∞ImmuReport] V1.0вАЭпЉИзЩїиЃ∞еПЈпЉЪ2019SR0916207пЉЙ
[2]вАЬSeq-MRDж£АжµЛиЗ™еК®еМЦеИЖжЮРз≥їзїЯпЉИDiscTermiteпЉЙ[зЃАзІ∞пЉЪDiscTermite]0.4.6вАЬпЉИзЩїиЃ∞еПЈпЉЪ2019SR1131517пЉЙ
[3]вАЬеЯЇдЇОеЕНзЦЂзїДеЇУдЇМдї£жµЛеЇПзЪДеЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛжХ∞жНЃе§ДзРЖз≥їзїЯвАЭпЉИзЩїиЃ∞еПЈпЉЪ2020SR0507594пЉЙ

иОЈеЊЧиН£и™ЙиѓБдє¶
1гАБиЙЊж≤РиТљиБФеРИжµЩе§ІйЩДдЄАйїДж≤≥жХЩжОИеЃМжИРзЪДгАКжЦ∞еЮЛCAR-TзїЖиГЮз†ФеПСеПКеЕґж≤їзЦЧжБґжАІи°Ажґ≤зЧЕдЄіеЇКиљђеМЦеИЫжЦ∞дљУз≥їеїЇзЂЛгАЛиОЈ2023еєіеЇ¶жµЩж±ЯзЬБзІСе≠¶жКАжЬѓињЫж≠•е•ЦдЄАз≠Йе•ЦгАВSeq-MRD¬ЃеЬ®иѓ•жКАжЬѓзЪДеИЫжЦ∞дЄОеЇФзФ®дЄ≠иµЈеИ∞дЇЖеЕ≥йФЃжАІдљЬзФ®гАВ

2гАБиЙЊж≤РиТљзФ≥жК•зЪДвАЬеЕНзЦЂзїДTCR/IgйЂШйАЪйЗПжµЛеЇПжКАжЬѓ/и°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛ/Seq-MRD¬ЃвАЭеЫ†еЕґеИЫжЦ∞жАІгАБеЙНж≤њжАІгАБеЄВеЬЇеЃЮзФ®жАІиН£иОЈвАЬ2022еєіеЇ¶CCTBдЄ≠еЫљиВњзШ§ж†ЗењЧзЙ©дЇІдЄЪеИЫжЦ∞е§ІдЉЪеИЫжЦ∞жКАжЬѓ/дЇІеУБиѓДйАЙвАЭй°єзЫЃдЇМз≠Йе•ЦгАВ

2023еєіиОЈжЙєдЇЖгАРеЕ®и°А/й™®йЂУеЯЇеЫ†зїДDNAжПРеПЦиѓХеЙВзЫТгАСпЉИз¶їењГеРЄйЩДжЯ±ж≥ХпЉЙе§Зж°ИзЉЦеПЈпЉЪжµЩжЭ≠жҐ∞е§З20230798 пЉМиѓХеЙВзЫТеИЖеИЂйАВзФ®дЇОдЇЇе§ЦеС®и°АгАБй™®йЂУж†ЈжЬђзЪДж†ЄйЕЄзЪДжПРеПЦгАВ
еПСи°®зЫЄеЕ≥жЦЗзМЃ
Seq-MRD¬ЃеПСи°®зЫЄеЕ≥жЦЗзМЃ
1гАБHuang Y, Zhao H, Shao M, Zhou L, Li X, Wei G, Wu W, Cui J, Chang AH, Sun T, Hu Y, Huang H.¬†Predictive value of next-generation sequencing-based minimal residual disease after CAR-T cell therapy. Bone Marrow Transplant.¬†2022 Jun 1. doi: 10.1038/s41409-022-01699-2. Epub ahead of print. PMID: 35650329.пЉИзВєеЗїйУЊжО•еПѓжЯ•зЬЛжЦЗзЂ†еЖЕеЃєпЉЙ

2гАБChen H, Gu M, Liang J, Song H, Zhang J, Xu W, Zhao F, Shen D, Shen H, Liao C, Tang Y, Xu X.¬†Minimal residual disease detection by next-generation sequencing of different immunoglobulin gene rearrangements in pediatric B-ALL.¬†Nat Commun. 2023 Nov 17;14(1):7468. doi: 10.1038/s41467-023-43171-9. пЉИзВєеЗїйУЊжО•еПѓжЯ•зЬЛжЦЗзЂ†еЖЕеЃєпЉЙ

3гАБMin’er Gu,Yahong Xia, Jingying Zhang, Yongmin Tang, Weiqun Xu, Hua Song ¬†Xiaojun Xu.¬†The effectiveness of blinatumomab in clearing measurable residual disease in pediatric B-cell acute lymphoblastic leukemia patients detected by next-generation sequencing.¬† Cancer Med. 2023 Dec;12(24):21978-21984. doi:10.1002/cam4.6771. пЉИзВєеЗїйУЊжО•еПѓжЯ•зЬЛжЦЗзЂ†еЖЕеЃєпЉЙ

4гАБYan N, Wang ZL, Wang XJ, etпЉМal.¬†Measurable residual disease testing by next generation sequencing is more accurate compared with multiparameter flow cytometry in adults with B-cell acute lymphoblastic leukemia.¬†Cancer Lett. 2024 Jul 4;598:217104. doi: 10.1016/j.canlet.2024.217104.

иОЈеЊЧеЫљйЩЕеЄВеЬЇиЃ§еПѓ
2023еєіDelveInsightеЕђеПЄеПСеЄГзЪДMRDеЫљйЩЕеЄВеЬЇз†Фз©ґжК•еСКдЄ≠пЉМиЙЊж≤РиТљ/Seq-MRD¬ЃжШѓдЄ≠еЫљеФѓдЄАдЄАеЃґеЕђеПЄ/дЇІеУБињЫеЕ•еЫљйЩЕи∞Гз†ФеЄВеЬЇжК•еСКгАВDelveInsightжШѓдЄАеЃґйҐЖеЕИзЪДеМїзЦЧдњЭеБ•еЄВеЬЇз†Фз©ґеТМеХЖдЄЪеҮ胥еЕђеПЄпЉМдї•еЕґзО∞жИРзЪДиБФеРИеЄВеЬЇз†Фз©ґжК•еСКдї•еПКдЄЇеМїзЦЧдњЭеБ•и°МдЄЪзЪДеЕђеПЄжПРдЊЫзЪДеЃЪеИґиІ£еЖ≥жЦєж°ИиАМйЧїеРНгАВ

жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†еЕНзЦЂеКЫжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВзЫЃеЙНдЄЇж≠ҐеПСи°®дЇЖжХ∞еНБзѓЗиЃЇжЦЗпЉМеЕґдЄ≠еМЕжЛђпЉЪThe New England Journal of Medicine(IF:158.5), Nature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24), Nature Communications (IF:17)з≠Йе§ЪзѓЗйЂШеИЖжЭВењЧгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ


