BзїЖиГЮжШѓеЕНзЦЂз≥їзїЯзЪДж†ЄењГжИРеСШпЉМеЕґи°®йЭҐзЪДBзїЖиГЮеПЧдљУпЉИBCRпЉЙиГљзЙєеЉВжАІиѓЖеИЂжКЧеОЯпЉМе¶ВеРМвАЬйЫЈиЊЊвАЭиИђз≤ЊеЗЖйФБеЃЪзЧЕеОЯдљУгАВзДґиАМпЉМBCRеЯЇеЫ†зЪДе§Ъж†ЈжАІйЂШиЊЊ1014зІНпЉМдЉ†зїЯжКАжЬѓйЪЊдї•еЕ®йЭҐиІ£жЮРеЕґе§НжЭВжАІгАВBCRеЕНзЦЂзїДжµЛеЇПпЉИBCR-SeqпЉЙеЇФињРиАМзФЯпЉМжИРдЄЇиІ£йФБBзїЖиГЮеКЯиГљгАБеЕНзЦЂеЇФз≠ФжЬЇеИґеПКзЦЊзЧЕеЕ≥иБФзЪДвАЬйЗСйТ•еМЩвАЬгАВзЫЃеЙНпЉМ¬†BCRжµЛеЇПжКАжЬѓеЬ®иВњзШ§з†Фз©ґпЉМеЕНзЦЂзЦЊзЧЕиѓКжЦ≠пЉМзЦЂиЛЧеПСиВ≤еТМжКЧдљУиНѓзЙ©еПСзО∞з≠Йз†Фз©ґдЄ≠еєњж≥ЫеЇФзФ®гАВ
жЬђжЬЯе∞ЖдїЛзїНдЄАдЄЛBCR-SeqзЪДжКАжЬѓжµБз®ЛгАБдЉШеКњгАБеЇФзФ®~
 
пЉИеЫЊжЇРжЭ•иЗ™зљСзїЬпЉЙ

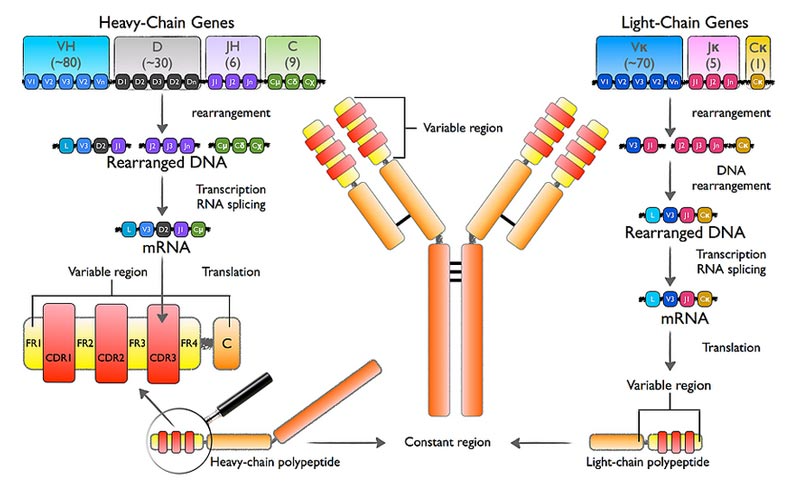
BCRеПЧдљУжµЛеЇПйАЪињЗйЂШйАЪйЗПжµЛеЇПжКАжЬѓж£АжµЛйЭґеРСжЙ©еҐЮеРОзЪДBCRйЗНйУЊеТМиљїйУЊпЉМеЕ®йЭҐиІ£жЮРBCRеЯЇеЫ†йЗНжОТ祱еЯЇеЇПеИЧпЉМдї•еПКеРДеЇПеИЧзЪДдЄ∞еЇ¶пЉМдїОиАМжП≠з§ЇBзїЖиГЮдїЛеѓЉзЪДдљУжґ≤еЕНзЦЂеЇФз≠ФжЬЇеИґдї•еПКеЕНзЦЂзРГиЫЛзЩљзЪДе§Ъж†ЈжАІеПШеМЦгАВеЕЈдљУжµБз®Ле¶ВдЄЛпЉЪ
пЉИ1пЉЙйТИеѓєRNAж†ЈжЬђпЉМйЗЗзФ®RNA+5′RACE+UMIзЪДеїЇеЇУжЦєж≥ХпЉМдљњзФ®зЙєеЉВжАІеЉХзЙ©з≤ЊеЗЖжЙ©еҐЮBCRйЗНйУЊпЉИIgHпЉЙжИЦиљїйУЊпЉИIgK/IgќїпЉЙзЪДеЕ®йХњеЇПеИЧпЉМRNA+5′¬†RACE+UMIеїЇеЇУжЦєж≥ХеПѓеМєйЕНе§ЪзІНжµЛеЇПж®°еЉПпЉЪPE150/PE250/PE300, еєґдЄФеПѓз°ЃдњЭйБњеЕНжµЛеЇПеТМжЙ©еҐЮйФЩиѓѓпЉМињШеОЯжХ∞жНЃзЪДзЬЯеЃЮзКґжАБгАВ
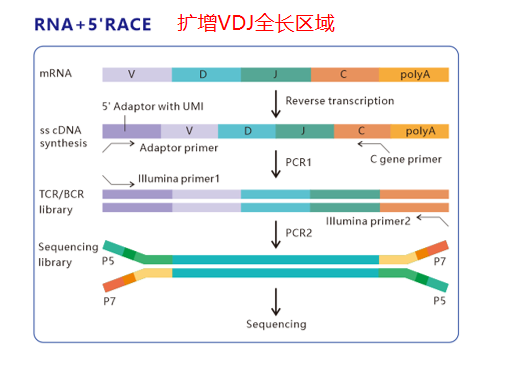
пЉИ2пЉЙйТИеѓєDNAж†ЈжЬђпЉМйЗЗзФ®DNA+е§ЪйЗНзЪДеїЇеЇУжЦєж≥ХпЉМжШѓзФ®зЙєеЉВжАІеЉХзЙ©жЙ©еҐЮBCRйЗНйУЊпЉИIgHпЉЙжИЦиљїйУЊпЉИIgK/IgќїпЉЙзЪДCDR3еЇПеИЧпЉМDNA+е§ЪйЗНеП™йАВзФ®PE150жµЛеЇПж®°еЉПгАВImmuHub¬ЃBCRжµЛеЇПеє≥еП∞зЪДDNA+е§ЪйЗНжЦєж≥ХпЉМзїПињЗе§Ъжђ°дЉШеМЦи∞ГжХіпЉМе∞љеПѓиГљеЗПе∞СдЇЖеЉХзЙ©еБПе•љжАІйЧЃйҐШгАВ
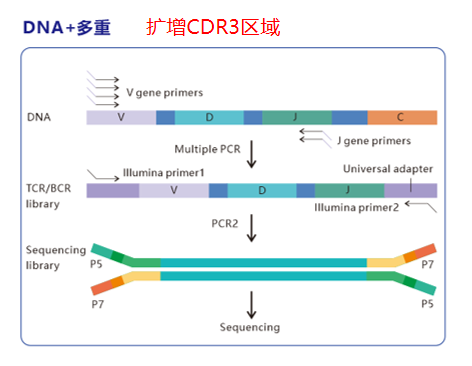
BCRжµЛеЇПжКАжЬѓдЊЭжЙШIllumina/MGl/GeneMind/Salusз≠ЙжµЛеЇПеє≥еП∞пЉМзїУеРИжХ∞е≠ЧPCRпЉИdPCRпЉЙжКАжЬѓпЉМе∞Жж£АжµЛзБµжХПеЇ¶жПРеНЗиЗ≥еЕ®жЦ∞йЂШеЇ¶гАВдЉ†зїЯSangerжµЛеЇПеѓєдљОдЄ∞еЇ¶з™БеПШпЉИе¶ВBCR-ABLиЮНеРИеЯЇеЫ†пЉЙзЪДиѓЖеИЂзОЗдЄНиґ≥1%пЉМиАМNGSжКАжЬѓеПѓжНХжНЙеИ∞йҐСзОЗдљОиЗ≥0.1%зЪДзљХиІБз™БеПШпЉМзФЪиЗ≥з≤ЊеЗЖеЃЪдљНBCR-ABLжњАйЕґеМЇзЪДеЊЃе∞ПеПШеЉВпЉМдЄЇи°Ажґ≤иВњзШ§зЪДжЧ©жЬЯиАРиНѓзЫСжµЛжПРдЊЫеЕ≥йФЃдЊЭжНЃгАВ
BCRжµЛеЇПеПѓдї•жП≠з§ЇBзїЖиГЮзЪДеЕЛйЪЖиµЈжЇРгАБе§Ъж†ЈжАІеТМеК®жАБеПШеМЦпЉМйАВзФ®дЇОиЈЯиЄ™зЦЊзЧЕињЫе±ХжИЦж≤їзЦЧињЗз®ЛдЄ≠жКЧдљУи∞±зЪДеПШеМЦпЉМеѓєдЇОдЄ™жАІеМЦеМїзЦЧжЬЙйЗНи¶БдїЈеАЉгАВж≠§е§ЦпЉМBCRжµЛеЇПеПѓдї•жПРдЊЫеѓєжКЧдљУеЇУзЪДеЕ®йЭҐиІЖеЫЊпЉМеЄЃеК©з†Фз©ґдЇЇеСШдЇЖиІ£жКЧдљУзЪДе§Ъж†ЈжАІеТМињЫеМЦињЗз®ЛгАВ
BCRжµЛеЇПдЄОиЫЛзЩљиі®зїДе≠¶пЉИиі®и∞±жКАжЬѓпЉЙзЪДиБФеРИеЇФзФ®пЉМеПѓеРМж≠•иІ£жЮРжКЧдљУиЫЛзЩљзЪДи°®иЊЊж∞іеє≥дЄОBCRеЯЇеЫ†и∞±пЉМжП≠з§ЇдљУжґ≤еЕНзЦЂзЪДеК®жАБи∞ГжОІжЬЇеИґгАВж≠§е§ЦпЉМжХіеРИTCRжµЛеЇПжКАжЬѓпЉМиГљеЕ®йЭҐзїШеИґT-BзїЖиГЮдЇТдљЬзљСзїЬпЉМдЄЇжДЯжЯУгАБиВњзШ§еПКиЗ™иЇЂеЕНзЦЂзЧЕз†Фз©ґжПРдЊЫе§ЪзїіжХ∞жНЃжФѓжТСгАВ
Bulk BCRжµЛеЇПйАЪињЗйЂШйАЪйЗПиІ£жЮРBзїЖиГЮеПЧдљУеЇУзЪДе§Ъж†ЈжАІпЉМеЬ®дЄіеЇКдЄ≠жИРдЄЇз≤ЊеЗЖеМїе≠¶зЪДйЗНи¶БеЈ•еЕЈгАВеЕґеЬ®и°Ажґ≤иВњзШ§йҐЖеЯЯеПѓиѓЖеИЂжБґжАІеЕЛйЪЖгАБзЫСжµЛеЊЃе∞ПжЃЛзХЩзЧЕзБґпЉИMRDпЉЙпЉМзБµжХПеЇ¶иЊЊзЩЊдЄЗеИЖдєЛдЄАпЉМжШЊиСЧжПРеНЗе§НеПСйҐДи≠¶иГљеКЫпЉЫеЬ®иЗ™иЇЂеЕНзЦЂзЧЕдЄ≠иГљз≠ЫйАЙиЗізЧЕжАІBзїЖиГЮеЕЛйЪЖпЉМжМЗеѓЉйЭґеРСж≤їзЦЧеєґиѓДдЉ∞зЦЧжХИпЉЫеЬ®жДЯжЯУеЕНзЦЂжЦєйЭҐеПѓињљиЄ™дЄ≠еТМжКЧдљУеК®жАБпЉМиІ£жЮРзЦЂиЛЧеЇФз≠ФжЬЇеИґпЉЫеРМжЧґпЉМйАЪињЗжХіеРИеЕНзЦЂж≤їзЦЧжХ∞жНЃпЉИе¶ВPD-1жКСеИґеЙВзЦЧжХИйҐДжµЛгАБCAR-TйЭґзВєз≠ЫйАЙпЉЙпЉМдЄЇдЄ™дљУеМЦж≤їзЦЧжПРдЊЫеИЖе≠РдЊЭжНЃгАВ
е∞љзЃ°йЭҐдЄіж†ЗеЗЖеМЦдЄОжИРжЬђжМСжИШпЉМеЕґйЂШзБµжХПеЇ¶гАБеК®жАБзЫСжµЛеПКе§ЪеЬЇжЩѓеЕЉеЃєжАІпЉИе¶ВеЊЃйЗПж†ЈжЬђеИЖжЮРпЉЙеЈ≤жО®еК®еЕґеЬ®иВњзШ§гАБеЕНзЦЂзЦЊзЧЕеТМжДЯжЯУзЃ°зРЖдЄ≠зЪДеєњж≥ЫеЇФзФ®пЉМжИРдЄЇињЮжО•еЯЇз°Аз†Фз©ґдЄОдЄіеЇКиљђеМЦзЪДж†ЄењГж°•жҐБгАВ
BCR-SeqпЉИBзїЖиГЮеПЧдљУжµЛеЇПпЉЙйАЪињЗиІ£жЮРBзїЖиГЮеПЧдљУзЪДе§Ъж†ЈжАІгАБеЕЛйЪЖеК®жАБеПКеКЯиГљзЙєеЊБпЉМеЈ≤жИРдЄЇеЕНзЦЂе≠¶з†Фз©ґзЪДеЕ≥йФЃжКАжЬѓпЉМеЕґеЇФзФ®жґµзЫЦдї•дЄЛж†ЄењГйҐЖеЯЯпЉЪ
- еПСиВ≤иљ®ињєиІ£жЮРпЉЪйАЪињЗеѓєдЄНеРМеПСиВ≤йШґжЃµBзїЖиГЮзЪДBCRињЫи°МжµЛеЇПпЉМеПѓдї•йШРжШОеЯЇеЫ†йЗНжОТзЪДиІДеЊЛеТМзЙєеЊБгАВдЊЛе¶ВпЉМеЬ®й™®йЂУдЄ≠пЉМBCRеЯЇеЫ†еЬ®жЬ™жИРзЖЯBзїЖиГЮдЄ≠зЪДйЗНжОТе§ДдЇОеИЭеІЛйШґжЃµпЉМйЪПзЭАзїЖиГЮзЪДеПСиВ≤еТМжИРзЖЯпЉМBCRеЯЇеЫ†зЪДе§Ъж†ЈжАІйАРжЄРеҐЮеК†гАВжµЛеЇПеПѓдї•йШРжШОBCRеЯЇеЫ†еЬ®жѓПдЄ™йШґжЃµзЪДзЙєеЊБпЉМдЄЇжЈ±еЕ•дЇЖиІ£й™®йЂУBзїЖиГЮзЪДеПСиВ≤ињЗз®ЛжПРдЊЫдЊЭжНЃгАВ
- BCRеЇУе§Ъж†ЈжАІиѓДдЉ∞пЉЪйЗПеМЦеБ•еЇЈдЇЇдЄОзЦЊзЧЕзКґжАБдЄЛзЪДBCRеЇУе§Ъж†ЈжАІпЉИе¶ВеЕЛйЪЖжЙ©еҐЮгАБSHMйҐСзОЗпЉЙпЉМжΥ糥еЕНзЦЂз®≥жАБдЄОеЉВеЄЄзЪДеЕ≥з≥їгАВ
 
- дЄ≠еТМжКЧдљУжМЦжОШпЉЪйАЪињЗжДЯжЯУжИЦзЦЂиЛЧжО•зІНеРОзЪДBCRи∞±еИЖжЮРпЉМз≠ЫйАЙйЂШдЇ≤еТМеКЫгАБеєњи∞±дЄ≠еТМжКЧдљУеЇПеИЧпЉИе¶ВжКЧжЦ∞еЖ†зЧЕжѓТзЪДIGHV3-53еЕЛйЪЖеЮЛпЉЙпЉМеК†йАЯж≤їзЦЧжАІжКЧдљУеЉАеПСгАВ
- зЦЂиЛЧжХИеКЫиѓДдЉ∞пЉЪйАЪињЗињљиЄ™BзїЖиГЮеПЧдљУпЉИBCRпЉЙеЇУзЪДе§Ъж†ЈжАІжЉФеПШдЄОдЇ≤еТМеКЫжИРзЖЯпЉМBCRжµЛеЇПеПѓз≤ЊеЗЖиѓДдЉ∞зЦЂиЛЧиѓ±еѓЉзЪДдљУжґ≤еЕНзЦЂеЇФз≠ФгАВеЕґйАЪињЗйЗПеМЦеЕЛйЪЖжЙ©еҐЮз®ЛеЇ¶гАБдљУзїЖиГЮиґЕз™БеПШпЉИSHMпЉЙйҐСзОЗеПКжКЧеОЯйАЙжЛ©еОЛеКЫпЉМжП≠з§ЇзЦЂиЛЧжњАжіїBзїЖиГЮзЪДиГљеКЫгАВдЊЛе¶ВпЉМжЬЙз†Фз©ґеПСзО∞жЦ∞еЖ†mRNAзЦЂиЛЧеЕНзЦЂеРОпЉМIGHV3-53/66еЕЛйЪЖеЮЛеН†жѓФжПРеНЗ5еАНдї•дЄКпЉМдЄФSHMдљНзВєйЫЖдЄ≠дЇОдЇТи°•еЖ≥еЃЪеМЇпЉИCDR3пЉЙпЉМжПРз§ЇеЉЇжХИдЄ≠еТМжКЧдљУзФЯжИРгАВ
 
еЬ®иЗ™иЇЂеЕНзЦЂзЦЊзЧЕдЄ≠пЉМиЗізЧЕжАІBзїЖиГЮеЫ†BCRеЉВеЄЄиѓЖеИЂиЗ™иЇЂжКЧеОЯпЉИе¶Вж†ЄиЫЛзЩљгАБзїЖиГЮиЖЬжИРеИЖпЉЙиАМ襀жњАжіїпЉМй©±еК®зВОзЧЗжНЯдЉ§еТМзїДзїЗз†іеЭПгАВеЯЇдЇОBCR-SeqзЪДйЂШзБµжХПеЇ¶жµЛеЇПжКАжЬѓпЉМеПѓеѓєжВ£иАЕе§ЦеС®и°АгАБзЧЕеПШзїДзїЗдЄ≠зЪДBзїЖиГЮињЫи°Ме§ЪзїіеЇ¶иІ£жЮРгАВ
- з≤ЊеЗЖйФБеЃЪвАЬеПЫеПШвАЭеЕЛйЪЖпЉЪйАЪињЗињљиЄ™BCRеПѓеПШеМЇзЪДV(D)JеЯЇеЫ†дљњзФ®еБПе•љжАІгАБдљУзїЖиГЮиґЕз™БеПШпЉИSHMпЉЙж®°еЉПеПКеЕЛйЪЖжЙ©еҐЮзЙєеЊБпЉМиѓЖеИЂдЄОзЦЊзЧЕеЉЇзЫЄеЕ≥зЪДиЗ™иЇЂеПНеЇФжАІBзїЖиГЮеЕЛйЪЖгАВдЊЛе¶ВпЉМз≥їзїЯжАІзЇҐжЦСзЛЉзЦЃпЉИSLEпЉЙжВ£иАЕдЄ≠пЉМIGHV4-34еЯЇеЫ†зЙЗжЃµзЉЦз†БзЪДBCRеЕЛйЪЖеПѓйАЪињЗеИЖе≠Рж®°жЛЯжЬЇеИґжФїеЗїеПМйУЊDNAпЉМеЕґж£АеЗЇзОЗдЄОжКЧdsDNAжКЧдљУжїіеЇ¶еПКиВЊиДПеПЧзіѓз®ЛеЇ¶еСИж≠£зЫЄеЕ≥гАВ
- еК®жАБзЫСжОІж≤їзЦЧеЇФз≠ФпЉЪеЬ®йЭґеРСBзїЖиГЮзЦЧж≥ХпЉИе¶ВCD20еНХжКЧгАБBAFFжКСеИґеЙВпЉЙеє≤йҐДеРОпЉМBCR-SeqеПѓйЗПеМЦиЗізЧЕжАІеЕЛйЪЖзЪДжЄЕйЩ§жХИзОЗпЉМзїУеРИBзїЖиГЮеЇУе§Ъж†ЈжАІжБҐе§Нж∞іеє≥пЉМдЄЇзЦЧжХИиѓДдЉ∞жПРдЊЫеИЖе≠Рж†Зз≠ЊгАВ
 
- зШ§еЖЕBзїЖиГЮеКЯиГљз†Фз©ґпЉЪеИЖжЮРиВњзا浪洶BзїЖиГЮпЉИTIL-BпЉЙзЪДBCRзЙєеЊБпЉМжП≠з§ЇеЕґйАЪињЗжКЧеОЯеСИйАТгАБеИЖж≥МжКЧдљУжИЦи∞ГжОІTзїЖиГЮеПВдЄОжКЧиВњзШ§еЕНзЦЂзЪДжЬЇеИґгАВ
- CAR-T/еПМжКЧеЉАеПСпЉЪдїОиВњзШ§зЫЄеЕ≥BCRдЄ≠з≠ЫйАЙзЙєеЉВжАІжКЧеОЯйЭґзВєпЉМиЃЊиЃ°дЄЛдЄАдї£зїЖиГЮзЦЧж≥ХжИЦеПМзЙєеЉВжАІжКЧдљУгАВ

еЬ®жΥ糥еЕНзЦЂз≥їзїЯзЪДе§НжЭВжАІеТМе§Ъж†ЈжАІињЗз®ЛдЄ≠пЉМз†Фз©ґдЇЇеСШжЧґеЄЄйЭҐдЄіж†ЈжЬђйЗПжЬЙйЩРгАБиОЈеПЦйЪЊеЇ¶е§Із≠ЙжМСжИШпЉМе∞§еЕґжШѓеЬ®з†Фз©ґзљХиІБзЦЊзЧЕжИЦзЙєеЃЪзїДзїЗдЄ≠зЪДBзїЖиГЮжЧґгАВйТИеѓєињЩдЄ™дЄіеЇКж†ЈжЬђз®АзЉЇжИЦйЪЊдї•иОЈеПЦзЪДжГЕеЖµпЉМImmuHub¬Ѓ¬†5’RaceUltraжКАжЬѓеЇФеКњиАМзФЯвАФвАФеЕґеЯЇдЇО5’зЂѓжЧ†еБПе•љжАІжЙ©еҐЮз≠ЦзХ•пЉМдїЕйЬАе∞СйЗПзЪДзПНиіµж†ЈжЬђеН≥еПѓеЃМжИРеЕ®йХњBCRжЦЗеЇУжЮДеїЇпЉМз™Бз†іжАІеЃЮзО∞вАШеЊЃйЗПдЄНйЩНзїігАБдљОдЄ∞жЧ†еБПеАЪвАЩпЉМеН≥дљњеЬ®иВњзШ§еЊЃзОѓеҐГгАБз•ЮзїПеЕНзЦЂз≠ЙжЮБзЂѓж†ЈжЬђеЬЇжЩѓдЄЛпЉМдєЯиГљз≤ЊеЗЖжНХиОЈжѓПдЄАдЄ™еЕНзЦЂеЇФз≠ФзЪДвАШеИЖе≠РжМЗзЇєвАЩгАВ
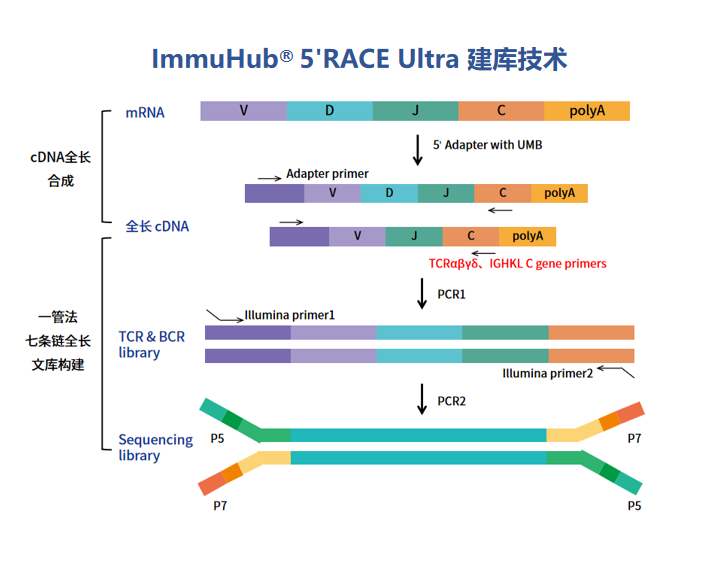
- иґЕеЊЃйЗПеїЇеЇУпЉЪдїЕйЬАе∞СйЗПеН≥еПѓеЃМжИРеЕ®йХњBCRжЙ©еҐЮпЉМжФѓжМБиДСиДКжґ≤гАБз©њеИЇзїДзїЗз≠Йз®АзЉЇж†ЈжЬђеИЖжЮРпЉЫ
- жЧ†еБПеАЪжЙ©еҐЮпЉЪеЯЇдЇО5’RACEеОЯзРЖпЉМйБњеЕНе§ЪйЗНPCRеЉХзЙ©и¶ЖзЫЦдЄНеЕ®еѓЉиЗізЪДеЕЛйЪЖ䪥姱пЉМзЬЯеЃЮињШеОЯBCRе§Ъж†ЈжАІпЉЫ
- дЄіеЇКзЇІзБµжХПеЇ¶пЉЪж£АжµЛйЩРдљОиЗ≥0.001%пЉМз≤ЊеЗЖиѓЖеИЂиВњзШ§еЊЃзОѓеҐГдЄ≠зЪДиАРиНѓеЕЛйЪЖжИЦиЗ™иЇЂеЕНзЦЂзЧЕзЪДдљОйҐСиЗізЧЕжАІBзїЖиГЮ
еЕЈдљУиѓ¶иІБпЉЪImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПжЬНеК°зДХжЦ∞дљУй™МпљЬTCR & BCRдЄГйУЊиБФж£АпЉМзІСз†ФдЄОдЄіеЇКж£АжµЛеЕ®йЭҐжПРжХИгАВ
дљЬдЄЇеЕНзЦЂзїДеЇУз†Фз©ґзЪД”йАПиІЖйХЬ”пЉМBCR-SeqжКАжЬѓйАЪињЗйЂШйАЪйЗПжµЛеЇПжП≠з§ЇдЇЖBзїЖиГЮеПЧдљУе§Ъж†ЈжАІиГМеРОзЪДзФЯзЙ©е≠¶еѓЖз†БгАВдїОж†ЈжЬђеИґе§ЗеИ∞жХ∞жНЃеИЖжЮРпЉМеЕґж†ЗеЗЖеМЦжµБз®ЛдЄЇеЕНзЦЂз†Фз©ґжПРдЊЫдЇЖеПѓйЗНе§НзЪДиІ£еЖ≥жЦєж°ИвАФвАФдї•ImmuHub¬Ѓ¬†5вАЩRACE UltraдЄЇдї£и°®зЪДеИЫжЦ∞жКАжЬѓпЉМеЗ≠еАЯеЕґйЂШзБµжХПеЇ¶гАБеЕ®йХњи¶ЖзЫЦеТМдљОеБПе•љжАІдЉШеКњпЉМж≠£йАРж≠•з™Бз†ідЉ†зїЯеїЇеЇУжКАжЬѓеѓєз®АжЬЙBCRеЕЛйЪЖзЪДжЉПж£АзУґйҐИпЉМжШЊиСЧжПРеНЗжХ∞жНЃеПѓйЭ†жАІгАВ

 
 
иЙЊж≤РиТљдЄУж≥®дЇОеЕНзЦЂзїДжµЛеЇПйҐЖеЯЯе§ЪеєіпЉМеЉАеПСзЪДImmuHub¬ЃжКАжЬѓеє≥еП∞жЦєж≥ХеЕ®йЭҐпЉМж£АжµЛзЙ©зІНе§Ъж†ЈпЉМеїЇеЇУжЦєж≥ХеЕЈжЬЙзБµжіїжАІпЉМиЗіеКЫдЇОдЄЇеРДе§ІйЂШж†°гАБеМїйЩҐгАБзІСз†ФжЬЇжЮДгАБдЉБдЄЪз≠ЙжПРдЊЫдЉШиЙѓзЪДзІСз†ФжЬНеК°гАВ


ImmuHub¬ЃйГ®еИЖзІСз†ФжЦєеРС
ImmuHub¬ЃйАВзФ®еЯЇеЫ†еЇІ
йГ®еИЖжХ∞жНЃеИЖжЮРзїУжЮЬе±Хз§Ї
жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМиН£иОЈжµЩж±ЯзЬБзІСжКАињЫж≠•дЄАз≠Йе•ЦпЉМеєґжОИжЭГж≥ЫзФЯе≠РдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†|еЕНзЦЂеКЫжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВзЫЃеЙНдЄЇж≠ҐеПСи°®дЇЖжХ∞еНБзѓЗиЃЇжЦЗпЉМеЕґдЄ≠еМЕжЛђпЉЪThe New England Journal of Medicine(IF:158.5), Nature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24),¬†Nature Communications¬†(IF:17)з≠Йе§ЪзѓЗйЂШеИЖжЭВењЧгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ


