晚期肝癌治疗方法和效果有限,目前的免疫疗法虽然在肝癌治疗中显示出潜力,但PD-1、PD-L1等免疫检查点抑制剂、TILs疗法等都各有其不足之处,使得仅有少数患者能从中获益。这一现状促使科学家们不断探索更有效的免疫治疗策略。
过继细胞疗法(ACT)利用T细胞对肿瘤特异性抗原或肿瘤相关抗原的特异性和亲和力发挥作用,为肝癌治疗提供了新可能。
2025年发表于《Gut》(IF:25.8)期刊上一项研究开发了一种通过新抗原(neoantigen)驱动T细胞受体(TCR)分离的新型T细胞免疫疗法,为肝癌免疫治疗带来了新希望。




研究纳入了7名晚期肝癌患者,从肿瘤组织、肝脏冲洗液(含循环于肝脏的外周血T细胞)和肿瘤引流淋巴结这三个关键部位获取T细胞,同时分离抗原呈递细胞(APCs)。这种采样策略突破了既往只聚焦于TILs的局限性,能够挖掘更多的肿瘤反应性T细胞。
通过全外显子测序(WES)和RNA测序(RNA-seq)对肿瘤样本进行分析,优选出最具有潜在免疫原性的肿瘤新抗原,合成对应肽段,用于体外T细胞刺激实验。
将APCs负载肽段后与不同来源T细胞共培养,收集细胞检测4-1BB(CD137)表达以判断T细胞活化/反应性,通过流式筛选出41BB+的CD4+或 CD8+ T 细胞。
通过单细胞RNAseq分析抗原经历T细胞的转录组特征,依据特定标志物将T细胞划分为不同亚群,如记忆T细胞、耗竭T细胞、中心记忆T细胞等,并详细描述各亚群的表型和功能特点。针对筛选出的表达4-1BB的新抗原反应性T细胞进行TCR测序,分析TCR克隆的分布和扩增情况,以识别具有肿瘤特异性的TCR。
将重建的TCR基因转导到自体T细胞中,与负载突变和野生型肽的自体B细胞共培养,检测T细胞的活化标志物(如 4-1BB)表达、细胞因子(IL-2、IFNγ、TNFα)产生以及细胞毒性(CD107α 表达),评估筛选出的TCR的特异性和功能性。


对7例患者的肿瘤样本进行WES和RNA-seq分析,结合 PIOR 排序法,最终确定78个患者特异性新抗原以及11个肝癌驱动癌基因的热点靶点,进行体外T细胞刺激,共14个靶点在共培养实验中被证实能引发T细胞反应,且大部分反应性T细胞来源于肝脏冲洗液和淋巴结,肿瘤组织中反应性T细胞较少。这表明肝脏冲洗液和淋巴结可能是获取反应性 T 细胞和 TCR 的更优来源。
肝脏冲洗液来源的T细胞以中心记忆和效应记忆CD4+ T细胞为主,具有细胞毒性效应特征,高表达GZMB、GZMH 等细胞毒性分子,能有效杀伤肿瘤细胞;而引流淋巴结中则主要是组织驻留记忆CD4+和CD8+ T细胞,且多表现出耗竭表型,高表达PD-1、CTLA4等耗竭标志物,功能受到抑制。这种差异为后续选择合适的T细胞来源用于免疫治疗提供了依据。
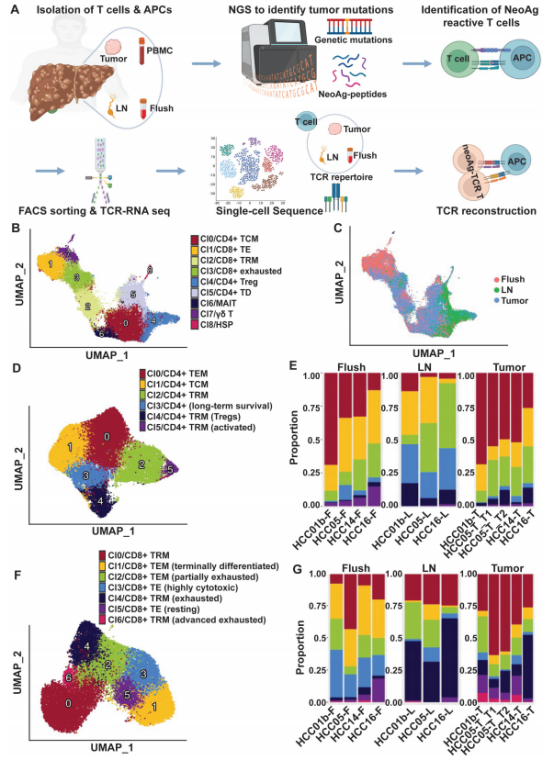
图1
CD4+ T细胞无明显克隆扩增。CD8+ T细胞存在显著的克隆扩增现象,TOP 5克隆在特定患者中占比达5%-10%,且主要富集在肝脏冲洗液和肿瘤组织中,淋巴结中较少。这表明肝脏冲洗液和肿瘤组织中可能存在大量针对肿瘤抗原的特异性 T 细胞,而淋巴结中的免疫反应相对较弱,可能受免疫抑制环境影响。
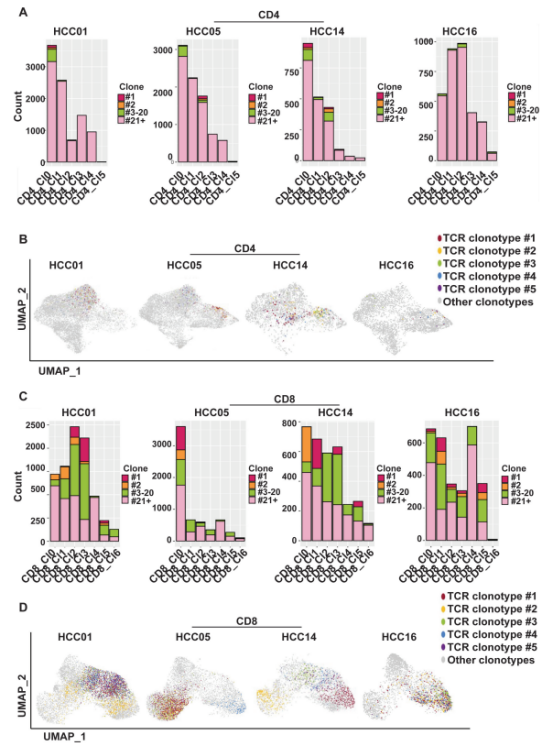
图2
针对SBNO2突变的3个重建TCR中, mTCR1和mTCR3对其同源突变抗原表现出强烈反应,4-1BB表达显著升高,且对野生型抗原反应微弱,证实了其抗原特异性。同时,这些T细胞能产生大量细胞因子,如IL-2、IFNγ、TNFα,并表达CD107α,具有良好的细胞毒性,能有效杀伤表达对应新抗原的肿瘤细胞。不同TCR的亲和力存在差异,mTCR1 对低浓度抗原即可产生较强反应,而mTCR3则需要较高浓度抗原才能引发明显反应,这种亲和力差异可能影响 T 细胞在体内的抗肿瘤效果。
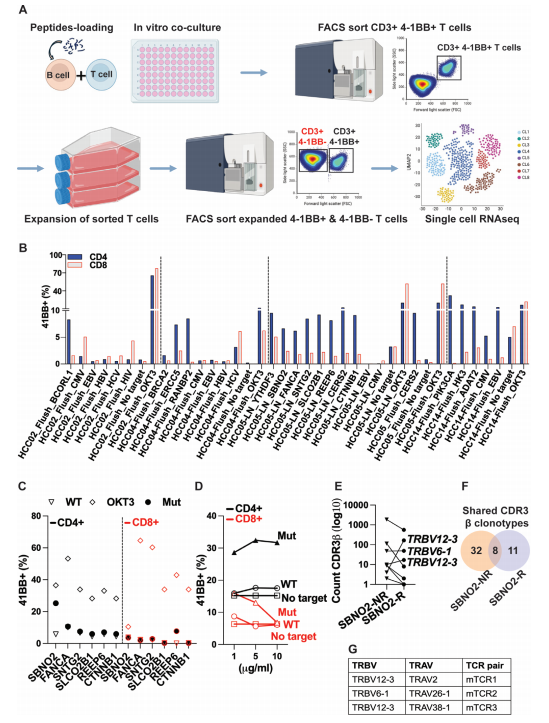
图3
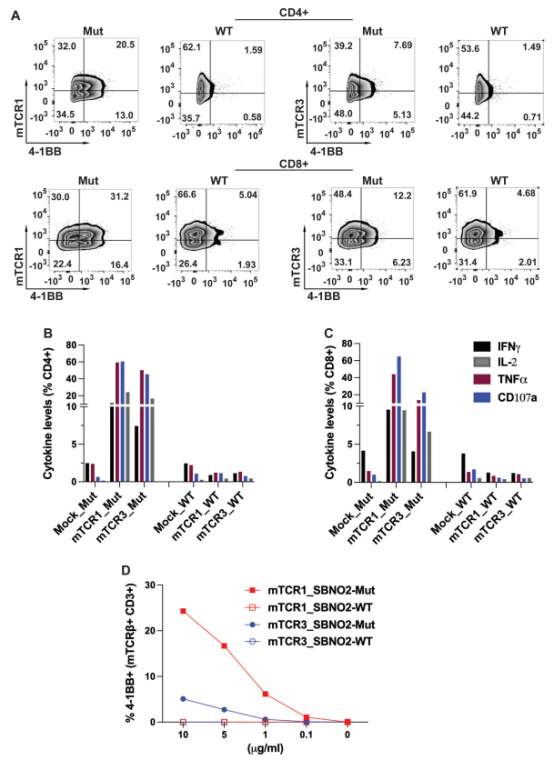
图4
通过单细胞RNAseq发现,4-1BB 阳性(反应性)T 细胞中存在一个独特的亚群(cluster 2),高表达 CD39、LAG3、4-1BB(TNFRSF9)、IFNG、NKG7 和 GZMB 等基因,兼具效应和细胞毒性特征,同时也表达部分耗竭标志物,表明这些细胞处于活化但部分耗竭状态,仍具有一定的抗肿瘤能力;而 4-1BB 阴性T 细胞则以非抗原反应性 / 非耗竭亚群(cluster 0)为主,高表达 IL7R/CD127,功能相对不活跃。
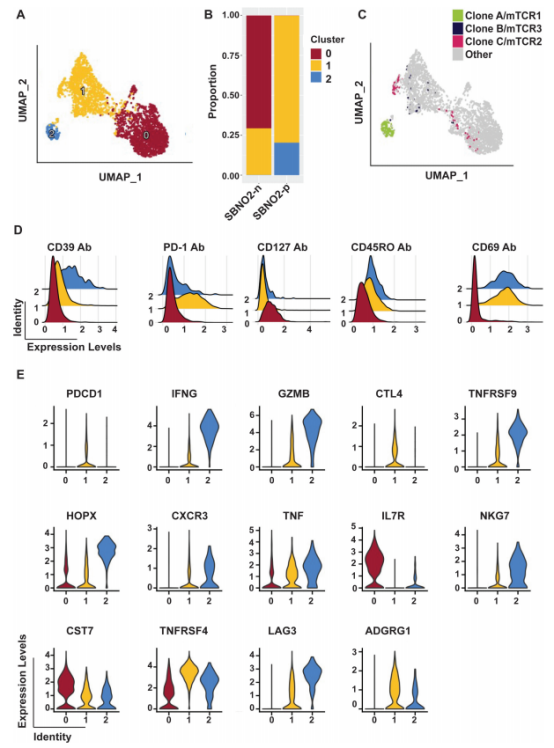
图5


该研究明确了肝脏冲洗液和淋巴结作为反应性T细胞和 TCR 来源的潜力,为后续T细胞获取提供了新的思路,改变了以往过度依赖肿瘤浸润T细胞的局面。
并建立了“新抗原筛选-细胞培养与分选-TCR功能验证”的标准化流程,为过继细胞疗法提供了潜在的治疗靶点,有望为晚期肝癌患者带来新的治疗选择。
此外,研究发现的不同部位T细胞亚群差异以及新抗原反应性T细胞的独特特征,为理解肝癌免疫微环境的复杂性提供了新视角,有助于指导后续研究如何改善肿瘤免疫微环境,提高免疫治疗效果。
Maravelia P, Yao H, Cai C, et al. Unlocking novel T cell-based immunotherapy for hepatocellular carcinoma through neoantigen-driven T cell receptor isolation. Gut. 2025;74(7):1125-1136. Published 2025 Jun 6.
在免疫治疗蓬勃发展的当下,精准靶向肿瘤的个性化疗法成为研究焦点。艾沐蒽科研服务聚焦个性化免疫治疗,提供从新抗原到疫苗的全链条支持。基于 TCR 精准预测肿瘤专属新抗原,通过专业技术验证其免疫原性,再量身设计高效疫苗肽序列,助力加速个性化新抗原疫苗研发,为科研突破注入核心动力!

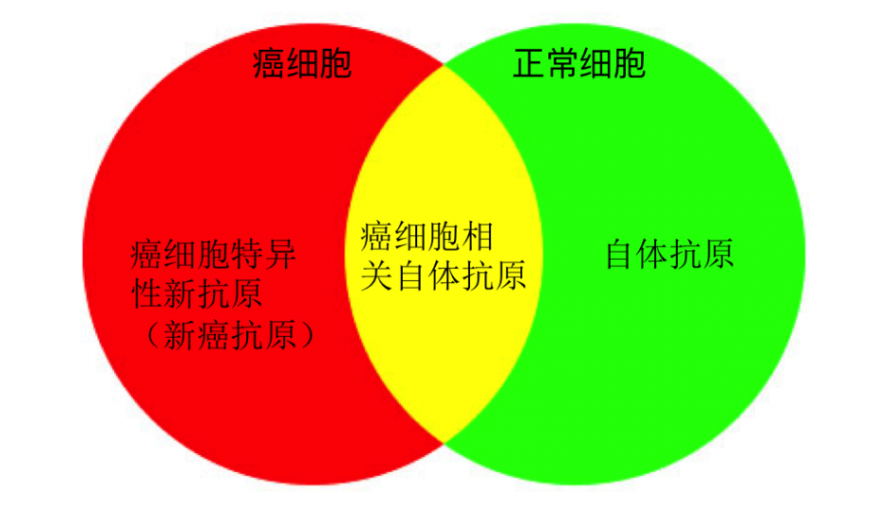
新癌抗原(Neo-antigen),就是特属个体肿瘤的基因翻译蛋白以抗原形式呈递在癌细胞或抗原呈递细胞表面,能被免疫系统识别,从而精准区分正常组织与癌组织。
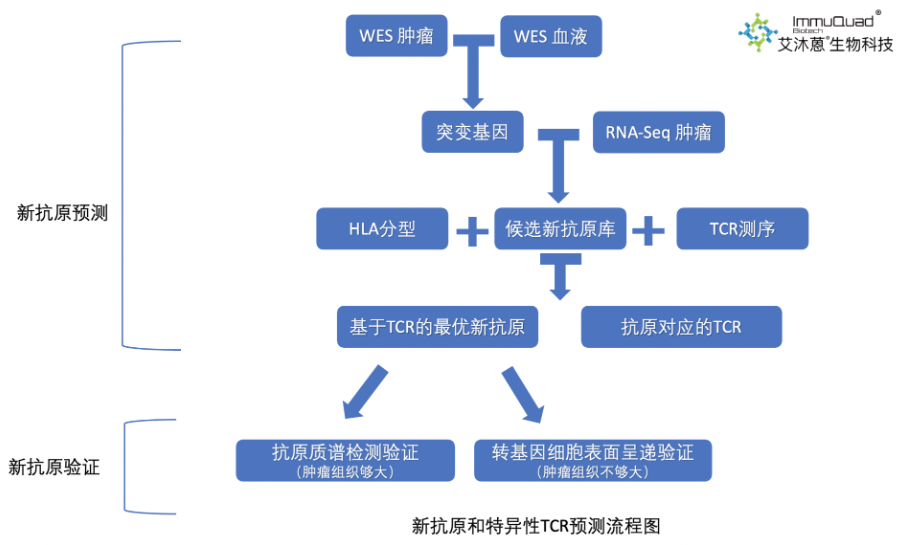
通过肿瘤细胞基因测序,找到患者特有的癌携基因,结合HLA分型进行免疫呈递亲和力预测,筛选出由癌携基因编码的癌抗原,即新癌抗原。配合TCR基因测序,能找出肿瘤突变与免疫系统之间的重要关系,更有助于制定个性化的癌症免疫治疗方案。

艾沐蒽新抗原预测,先通过肿瘤组织与血液对照(或癌旁组织)WES测序找到突变基因,结合肿瘤RNA-Seq构建候选新抗原库,再经HLA分型检测、TCR测序,通过艾沐蒽独有算法筛选出基于TCR的最优新抗原与对应TCR;后续新抗原验证,组织充足时可选择抗原质谱检测,不足则用转基因细胞表面呈递验证 。

-
通过预测肿瘤中的特异性新抗原,可以设计个性化的疫苗,激发患者体内免疫系统对肿瘤细胞的特异性免疫反应。艾沐蒽也可以提供疫苗肽序列设计服务,量身设计高效疫苗肽序列。
-
新抗原还可以用于过继性T细胞治疗(如CAR-T、TCR-T细胞疗法等),通过识别和筛选能够识别新抗原的TCR,可以设计出针对特定新抗原的T细胞,增强对肿瘤的杀伤能力。
艾沐蒽作为精准医疗的先行者,将继续致力于推动个性化免疫疗法的发展,为患者提供更多希望和选择。我们期待与更多的科研机构、企业合作,共同探索精准免疫治疗的无限可能!


