今天给大家分享一篇发表在Frontiers in Immunology(IF:8.786)杂志上的综述性文章,这篇文章详细描述随着新一代DNA测序技术的进步,已经可以通过(TCR库分析)对TCR基因集合进行综合分析,并且该测序分析技术已被用于研究抗肿瘤T细胞的克隆反应。本文介绍了两种有助于对TCR库数据进行免疫学分析的方法:bulk TCRseq器官间克隆跟踪分析和单细胞TCR测序。TCR库分析将更准确地了解肿瘤特异性以及TCR在肿瘤微环境中的反应。
下面就让我们一起了解一下!

研究背景
TCR库是体内TCR集合,也被认为是对于抗原特异性评价T细胞反应的新指标。新一代测序(NGS)技术TCR测序使个体TCR序列可以被检测出来。目前,TCR全库分析已被广泛应用于感染性疾病(6)、移植免疫(7)、肿瘤免疫(8)等多个医学领域。在本文中,作者对TCRseq方法进行了综述,并总结了目前TCR全库分析在癌症免疫治疗领域的发现和局限性。此外,作者介绍了两种新的TCR库分析方法,以促进TCR库数据的免疫学解释:bulk TCRseq器官间克隆跟踪分析,用于识别和分析肿瘤和其他组织中存在的T细胞克隆和单细胞(sc) TCRseq,用于在单细胞中识别TCR序列及其基因表达。
TCR测序方法综述
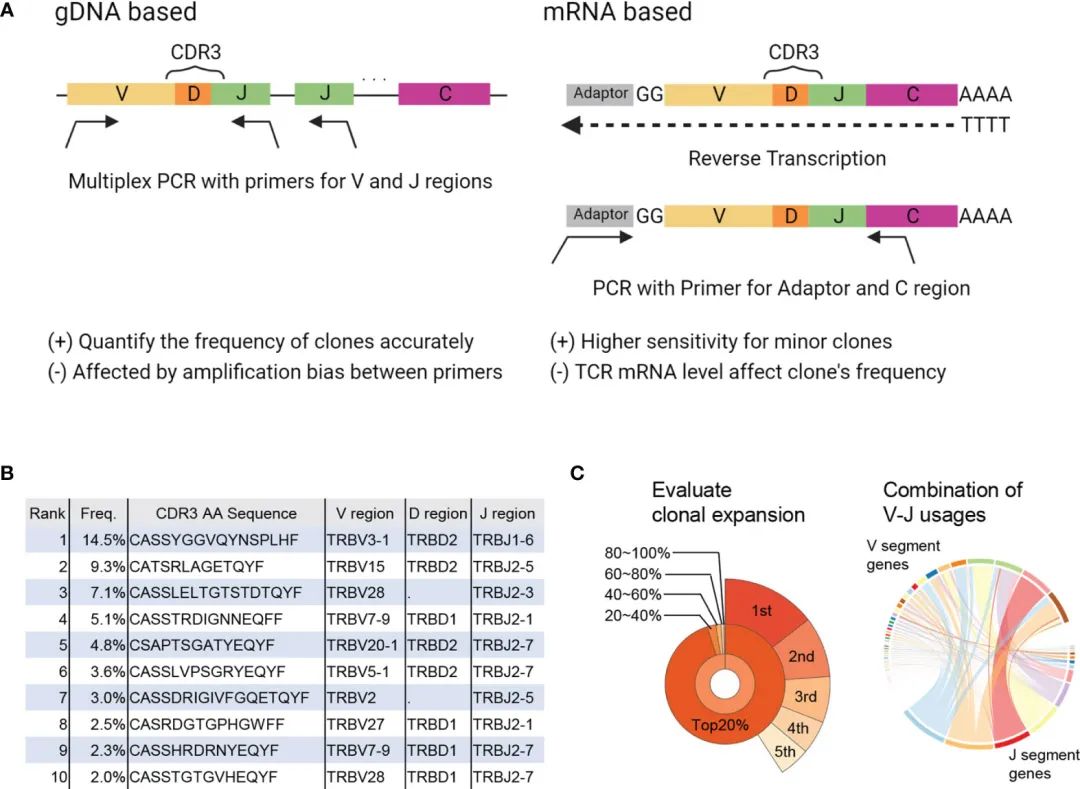
图1 TCRseq和TCR库分析。
TCR是通过对可变(V)、多样性(D)、连接(J)和恒定(C)基因片段插入和缺失的重排产生的,因此产生巨大的多样性(9)。在TCRseq中,TCR基因中主要是互补决定区3 (CDR3),这是TCR中变化最大的区域,也是抗原特异性的重要识别区域,也是主要被扩增和NGS测序的区域。
有几种TCRseq方法:
(i)使用基因组DNA (gDNA)或信使RNA (mRNA)作为模板;
(ii)使用多个V区特异性引物来扩增TCR序列(多重PCR)或使用通用引物来扩增适配器序列(5 ‘[RACE]快速扩增cDNA末端)(10)(图1A)。
(图1B)表中结果总结了所有检测到的T细胞克隆及其频率(初步分析)。
基于该克隆表,可以评估TCR库的特征,包括多样性(即库中存在的T细胞克隆数量)和克隆性(即库中特定T细胞克隆扩增的程度)(二次分析,图1C)。

表1 TCRseq方法的分类及其特点。
表1显示每种方法优点和缺点(11,12)。

表2 TCR-seq数据分析的计算工具。
通过NGS获得的TCR序列与V区、D区、J区参考序列比对,组装成具有相同CDR3序列的T细胞克隆。
如IgBLAST (13),IMGT/HighV-QUEST (14),MiXCR(15),和RTCR(16)用于分析TCR序列数据。
肿瘤免疫学中的TCR库分析
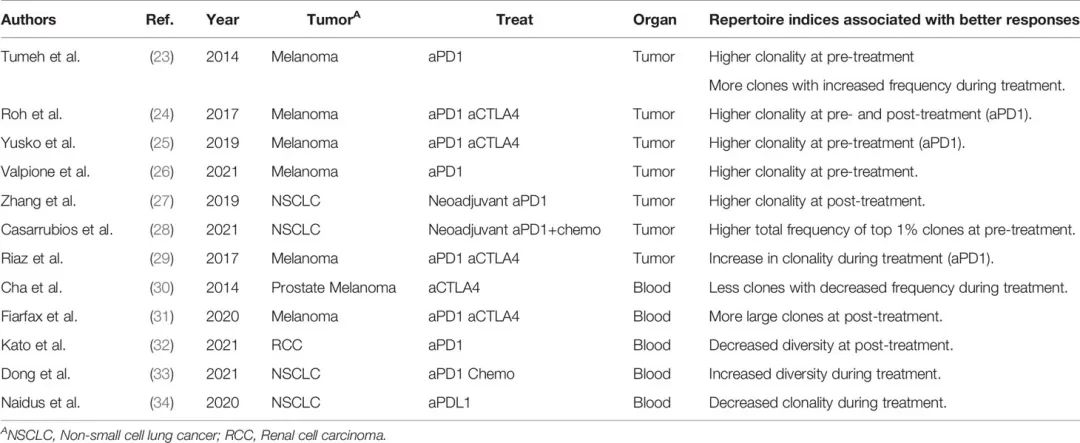
表3 研究分析了克隆库/多样性与临床反应之间的关系。
在癌症免疫疗法,如抗CTLA4 抗体和PD-1抑制剂疗法,应用于广泛的癌症类型,迫切需要能够预测治疗反应的生物标志物(19)。与肿瘤相关报道,治疗反应与肿瘤中PD-L1表达水平(20)和肿瘤的错配修复缺陷(MMRd)有关(21,22)。但是迄今为止,反映患者免疫状态的预测性生物标志物尚未建立。TCR库已被建议作为备选。在2014年前后就报道过TCR库与癌症免疫治疗之间存在关联,如表3所示。
一项针对抗PD-1抗体治疗黑色素瘤患者的临床研究表明,治疗前,有反应者肿瘤中TCR库的克隆性高于无反应者(23-26)。
同样,在对非小细胞肺癌(NSCLC)患者进行新辅助免疫治疗的研究中,肿瘤库中前1%克隆的总频率在应答者中高于无应答者(27,28)。此外,在治疗后,应答者表现出更多的T细胞克隆,且频率增加(23),肿瘤中T细胞库的克隆性增加(29)。这些结果提示肿瘤中TCR库的克隆性可以反映和预测肿瘤免疫治疗的效果。
然而,在这些研究中,CD4+和CD8+肿瘤浸润淋巴细胞(TILs)在TCRseq之前没有被分离。考虑到CD8+ TILs通常比CD4+表现出更高的克隆性(35,36),TIL库的高克隆性可能仅仅反映了CD8+细胞比例更高(37)。
由于血液采样比肿瘤活检造成的侵害小,所以外周血样本更适合癌症患者的长期免疫监测。Cha等人报道,在接受抗CTLA4抗体治疗的前列腺癌和黑色素瘤患者中,治疗后外周血中收缩的T细胞克隆减少(30)。
Fairfax等人发现单独使用抗PD-1抗体或联合使用抗CTLA4抗体治疗的黑色素瘤患者外周血中扩增的CD8+ T细胞克隆数量更高(31)。在一组接受PD-1抗体治疗的肾细胞癌患者中也报道了类似的趋势(32)。相比之下,非小细胞肺癌患者的应答者在治疗后表现出克隆性降低和外周血TCR谱多样性增加(33,34)。所以,现在对与治疗反应相关的外周血TCR谱的特征还没有达成共识。
这是因为TCR库的多样性和克隆性在个体之间差异很大,而且外周血包含很大一部分与抗肿瘤免疫反应无关的T细胞克隆。
尽管存在这些问题,TCR库的多样性和克隆性正逐渐被认为是与预后和/或治疗效果相关的因素。然而,这些TCR库指数的免疫病理学意义仍然不明确,因为TCR库分析确定的克隆性或多样性没有考虑单个T细胞克隆的免疫学特征。
因此,作者介绍了两种TCR库的分析方法,来支持TCR库数据的免疫学解释。第一种方法是器官间克隆跟踪分析,其中肿瘤中的T细胞克隆在血液和/或引流淋巴结(dLN)中被跟踪。第二种是单细胞(sc) TCRseq,其中基因表达谱整合到单个T细胞克隆中。
器官间重叠克隆的TCR库分析
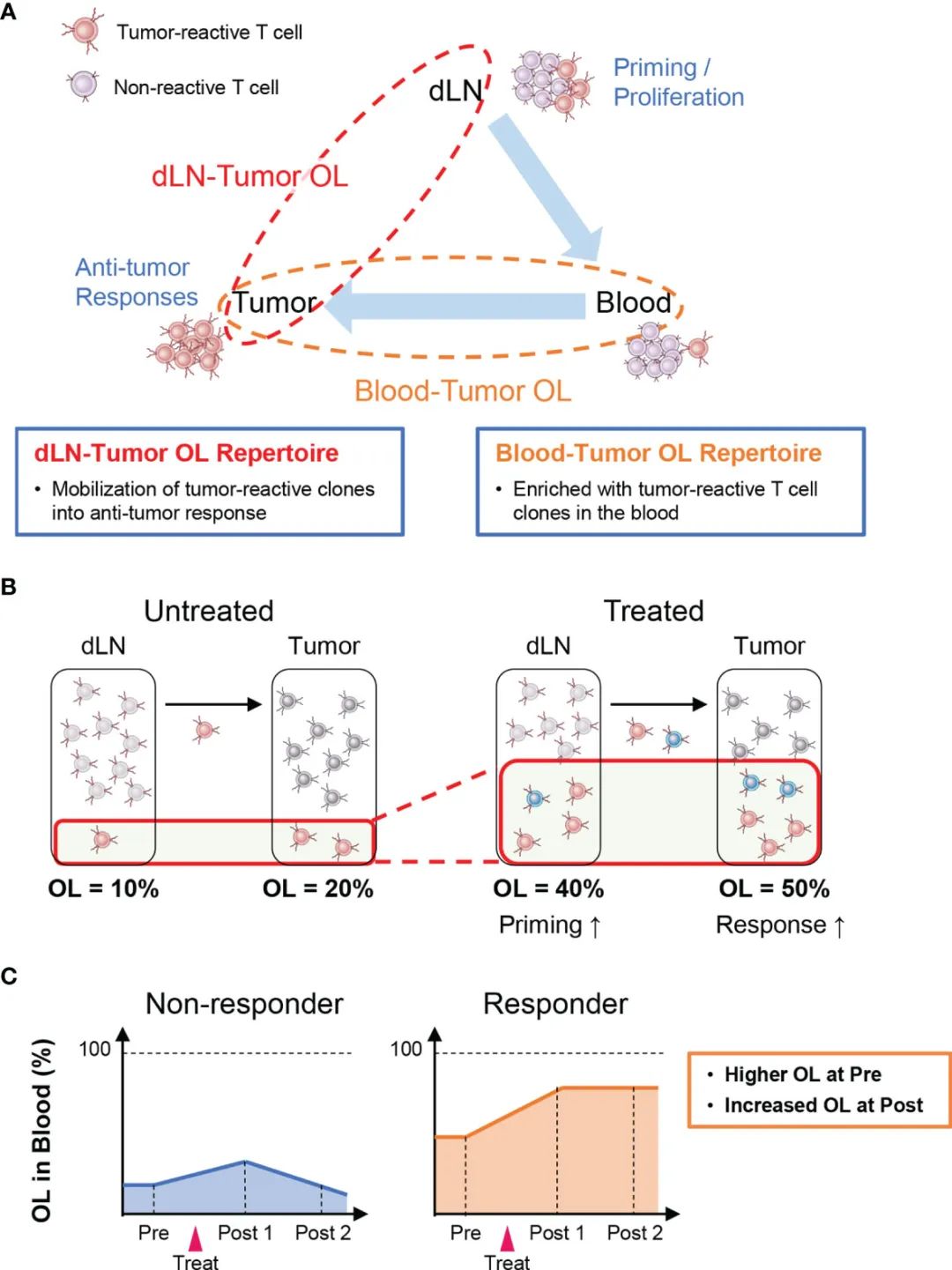
图2 器官间克隆跟踪分析概述。
肿瘤反应性T细胞在肿瘤抗原进入淋巴结(即dLNs)的抗原呈递后被激活和增殖,然后通过外周血浸润到肿瘤组织(Cancer Immunity Cycle:38)。因此,在肿瘤和dLNs (dLN-肿瘤重叠库)中检测到的T细胞克隆表明了肿瘤反应性克隆被用于抗肿瘤T细胞应答(图2A)。
因此,重叠克隆的增加显示了肿瘤反应性克隆的发动增强和强抗肿瘤作用有关(图2B)。
在外周血中,存在许多与抗肿瘤反应无关的T细胞克隆。这表明外周血中与肿瘤中重叠的TCR库(外周血-肿瘤重叠库)可能在肿瘤反应性T细胞克隆中得到富集。所以,血肿瘤重叠库可能有助于监测抗肿瘤T细胞反应。例如,基线时血液中血肿瘤重叠度较高,治疗后血肿瘤重叠度增加的患者可能表现出更好的抗肿瘤反应(图2C)。
此外,根据在血液CD4+或CD8+ T细胞库中是否检测到重叠克隆,可以将未分离的肿瘤T细胞库中的血液肿瘤重叠克隆注释为CD4+或CD8+。鉴于从肿瘤活检中分离足够数量的CD4+和CD8+ T细胞是困难和费力的,而血液-肿瘤重叠库分析的另一个优势是无需制备CD4+和CD8+ TILs就能分析肿瘤中CD4+和CD8+ T细胞克隆的反应。
dLN-肿瘤重叠库分析
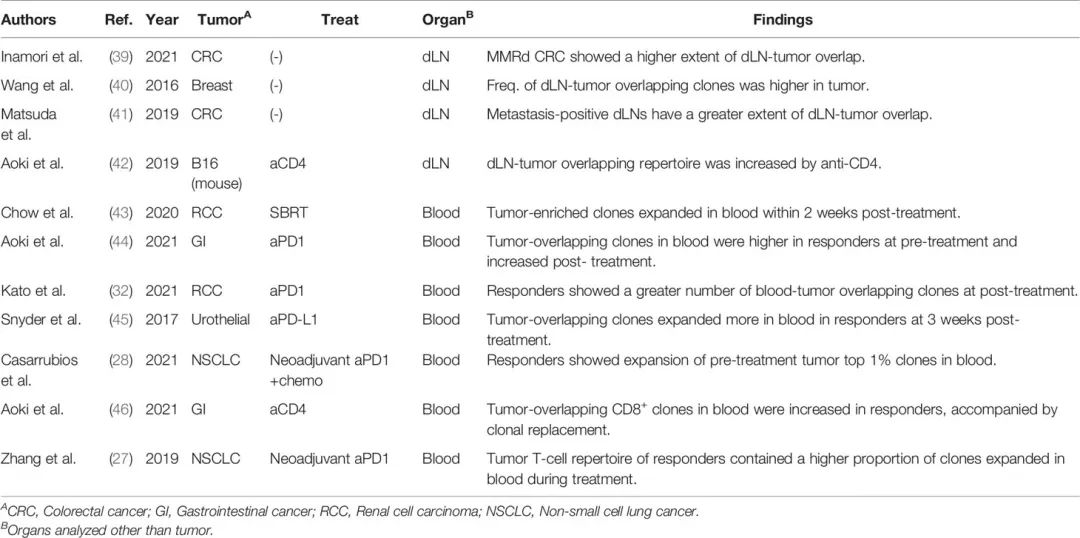
表4 TCR测序器官间克隆跟踪分析。
少数研究对癌症患者手术切除的样本进行dLN -肿瘤重叠分析(表4)。
Inamori等人报道,ICIs更有效的MMRd结直肠癌(CRC)患者比MMR熟练的CRC患者表现出更大程度的dLN肿瘤重叠(39)。这一结果与MMRd肿瘤中含有特异性突变相关新抗原的肿瘤反应性T细胞克隆的结果一致(22)。考虑到这一结果,其他表现出更大dLN-肿瘤重叠的肿瘤类型也可能对ICIs有反应。然而,值得注意的是,转移阳性的dLN显示出更高程度的dLN-肿瘤重叠(40,41)。因此,转移阳性dLN与肿瘤之间的重叠程度可能不一定反映肿瘤反应性克隆的增强。
在一项临床前研究中,作者证明了在接受抗CD4抗体消耗治疗的B16小鼠中,dLN肿瘤重叠库增加(42)。通过短暂去除CD4+免疫抑制细胞(包括调节性T细胞),并激活肿瘤反应性CD8+ T细胞显示出有效的抗肿瘤作用,虽然肿瘤中CD8+ T细胞的克隆性在未治疗和CD4抗体治疗的小鼠之间是相同的,但在抗CD4抗体治疗的小鼠中,dLN-肿瘤重叠库的总频率和多样性显著增加。此外,在dLN-肿瘤重叠库中检测到过继转移或内源性黑色素瘤反应性克隆的扩增(42)。这些结果表明在dLN肿瘤重叠中治疗引起的TCR库变化丰富。此外,dLN-肿瘤重叠克隆可分为三种模式:“TumorMajor克隆”,在肿瘤中占优势(>0.1%),而在dLNs中不占优势;“dLNMajor克隆”,在dLNs中占优势,但在肿瘤中不占优势;以及“DoubleMajor克隆”,在dLNs和肿瘤中均占主导地位(42)。抗CD4抗体治疗增加了dLNMajor和DoubleMajor克隆,这加强了抗癌免疫周期中抗CD4抗体的主要目标是启动dLN中的肿瘤反应性T细胞的证据。在临床前模型中,抗CD4抗体与PD1阻断剂联合可产生协同抗肿瘤作用(47)。考虑到PD1阻断的主要目标是防止肿瘤反应性T细胞在肿瘤中衰竭(38),其他增加dLN-肿瘤重叠的治疗也可能通过靶向dLN和发动更多的肿瘤反应性克隆与PD1阻断协同作用。
血肿重叠库分析
许多研究报道了血肿重叠库与临床反应之间的关联(表4)。
Chow等人报道,在开始立体定向全身放射治疗后两周内,血肿重叠的TumorMajor克隆在血液中扩增(43)。另外,PD-1阻断治疗的应答者在治疗前血肿重叠克隆的总频率更高(44),治疗后血肿重叠克隆的数量更多(32),治疗后血肿重叠克隆的扩张更明显(45)。在新辅助化疗免疫治疗(28)和人源抗CD4抗体的临床试验(46,48)中也报道了类似的观察结果。
作者还分析了血肿重叠库与临床反应之间的关系。Zhang等据报道,在一项新辅助PD-1阻断治疗NSCLC的试验中,与无反应者相比,反应者的肿瘤T细胞库在治疗后血液中扩增的克隆比例更高(27)。
另外,Yost等人发现肿瘤中的T细胞克隆在治疗过程中被替换,并且肿瘤中一些新出现的克隆在治疗前就存在于外周血中(49)。
这些观察结果表明,PD-1阻断疗法激活肿瘤外新的肿瘤反应性T细胞克隆,并促进其浸润到肿瘤中(50)。这种“肿瘤外源性”反应可能与肿瘤中耗尽的T细胞的再激活相对应,这在以前被认为是PD-1阻断的主要机制。另外,肿瘤和外周血的scTCR分析(见下文)表明,与效应功能相关的基因在外周血中的肿瘤重叠克隆中高度表达(51,52)。这些结果表明,外周血中肿瘤重叠克隆可能作为PD-1阻断治疗的预后和早期诊断标志物:肿瘤重叠克隆较多的患者可能受益于PD-1阻断,而肿瘤重叠克隆较少的患者可能需要更积极的免疫治疗,如联合抗CTLA4抗体。
此外,这些重叠克隆是否准确识别肿瘤细胞,并有助于抗肿瘤作用,还需要在临床前和临床研究中进行验证。
单细胞TCR测序方法综述
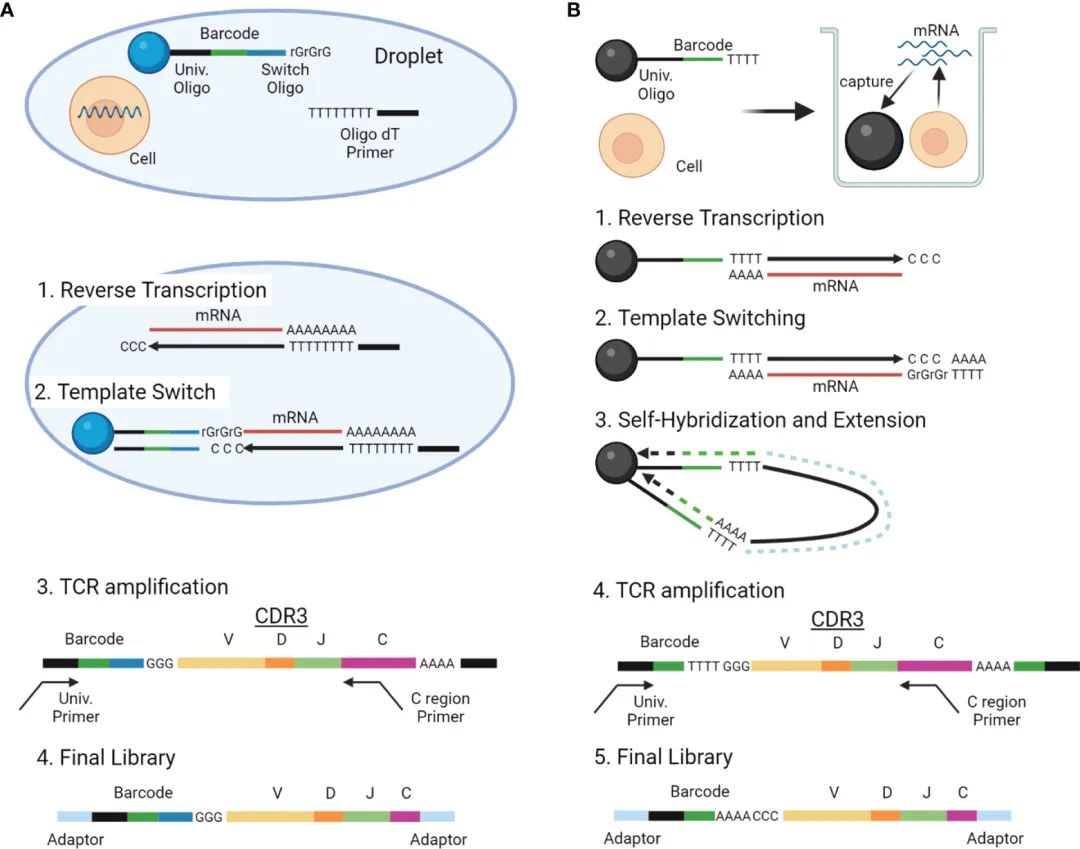
图3 scTCRseq方法概述。
随着单细胞分析技术的进步,越来越多的高通量scTCRseq方法被开发出来,大致可分为两类:
(1)从标准scRNAseq数据中提取TCR reads重建TCR序列的方法;
(2)在scRNA-seq文库构建和测序时,选择同时构建TCR文库基因和测序。图3和表2、表5(17,18,55,56)总结了这两类scTCRseq方法的实验概况和特点。

表5 TCRseq方法的分类及其特点。
SCTCR分析阐明肿瘤微环境中的T细胞反应
scTCRseq在肿瘤免疫学中的应用之一是基于T细胞克隆重叠来估计T细胞亚群之间的发育关系。
scTCRseq的另一个应用是鉴定对肿瘤抗原有反应的TCR。肿瘤浸润T细胞不仅包括识别肿瘤抗原的肿瘤反应性T细胞克隆,还包括识别与肿瘤无关的病毒抗原的克隆(63,64)。由于T细胞克隆的抗原特异性是由TCRα和β链决定的,因此需要scTCRseq鉴定TCR α和β链对来重建T细胞克隆的TCR,并检查其肿瘤反应性。Oliveira等人通过scTCRseq技术鉴定了CD8+ TILs的TCR α链和β链对,并利用慢病毒载体将其导入外周血T细胞。将转染TCR的T细胞与永生化淋巴母细胞系共培养,用肿瘤抗原或肿瘤无关病毒抗原的肽脉冲,鉴定TCR的抗原特异性。另外,scRNAseq检测了T细胞克隆的基因表达谱。使用这种方法,作者发现识别肿瘤抗原的克隆表现出衰竭表现,而识别病毒抗原对应的克隆表现出记忆表现(65)。上述scTCRseq表明肿瘤反应性TCRs可用于定制过继T细胞治疗。最近的一项研究表明,只有一小部分TILs可以体外培养(66)。另外考虑到,使用scTCRseq可以扩大T细胞治疗选择范围,并且可以直接鉴定功能性T细胞克隆,这将改善治疗效果。
总结
肿瘤浸润T细胞库反映了抗原特异性T细胞介导的抗肿瘤反应,是肿瘤微环境的一个重要特征。在这篇综述中,作者介绍了两种新的TCR库免疫学解释方法。基于bulk TCRseq的器官间克隆追踪分析可以使得被动员进入癌症免疫周期的浸润肿瘤性 T 细胞克隆更为丰富,提供了比表现型多样性或克隆性更直接的抗肿瘤 T 细胞反应指标。scTCRseq 技术可以将个体 T 细胞克隆与其基因表达谱链接起来,以实现对 TCR 表现型的更精确解释。此外,通过结合 scTCRseq 和 DNA 条形码化的肽-MHC 多聚体技术,和高通量技术使得对特异抗原 T 细胞的识别变得更加可能(56、67、68)。虽然 scTCRseq 可以更精确地表达单个克隆,但每个样本可以分析的 T 细胞克隆数量也只是 TCR 表现型的“冰山一角”。因此,高通量表现型重叠分析和 scTCRseq 的联合应用将有助于改善我们对多种 T 细胞克隆的抗肿瘤反应的理解。总的来说,本综述中描述的 TCR 表现型的分析方法,不仅更精确表达肿瘤微环境,而且还有助于开发对抗癌症有效的免疫治疗策略。
参考文献
Aoki H, Shichino S, Matsushima K and Ueha S (2022) Revealing Clonal Responses of Tumor-Reactive T-Cells Through T Cell Receptor Repertoire Analysis.Front. Immunol. 13:807696.doi: 10.3389/fimmu.2022.807696
什么是ImmuHub®技术?
杭州艾沐蒽生物科技有限公司成立于2016年,是国内前沿的专注于免疫基因组学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子(纳斯达克代码:GTH)使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®疾病早筛、单细胞测序、TCR-T药物开发等平台管线。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。
艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。

