近日,艾沐蒽与南方科技大学王艺瑾教授团队合作并在《Cancer science》(IF=5.7)上发表了题为“T-cell receptor sequencing reveals hepatocellular carcinoma immune characteristics according to Barcelona Clinic liver cancer stages within liver tissue and peripheral blood”的研究论文。研究使用艾沐蒽生物ImmuHub® TCR测序分析平台,探究肝癌不同分期的不同组织来源的T细胞免疫特征,该研究将有助于阐明肝癌进展机制,并有助于开发针对特定新抗原的细胞治疗方法。
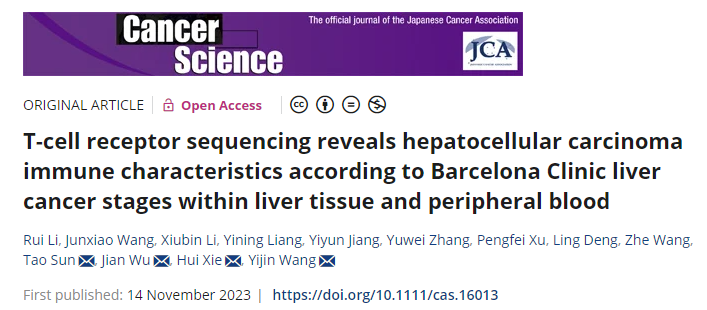
研究方法
-
样本收集
根据HCC BCLC分期标准,前瞻性纳入经影像学和病理学诊断证实的早期(BCLC_A)、中期(BCLC_B)、晚期 (BCLC_C)HCC患者各10例。收集30例HCC患者肝肿瘤组织、癌旁组织以及外周血单核细胞 (PBMCs)。
-
研究设计
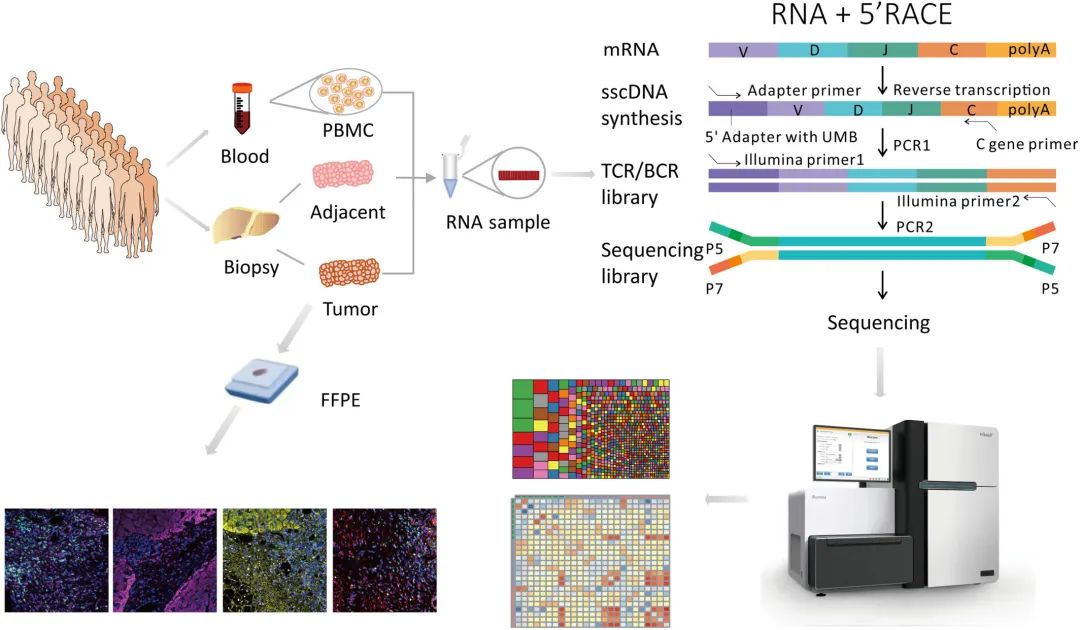
图1 实验设计
3.TCRβ扩增和测序:使用ImmuHub®TCR深度分析系统(艾沐蒽)对样品进行高通量TCR测序。使用了5 ‘ RACE无偏扩增。并在cDNA合成过程中引入的独特分子条形码(UMB),消除PCR和测序错误。
4.TCR谱分析
5.统计分析
研究背景
T 淋巴细胞通过细胞表面特定T细胞受体 (TCR) 识别抗原主要组织相容性复合物 (MHC) 分子,在人类适应性免疫中发挥重要作用。95%的T细胞的TCR是由α和β两条肽链通过链间二硫键连结组成α/β异二聚体,每条链由恒定和可变结构域组成。TCR多样性是由于肽链可变区 (V)、多变区(D) 和连接区 (J) 基因片段重排以及核苷酸的随机添加或缺失形成的。肝细胞癌 (HCC) 在全球癌症相关死亡原因中排名第四。HCC免疫微环境包含具有不同功能的T淋巴细胞亚群,目前,HCC不同阶段的TCR多样性及克隆性特征尚不清楚。
研究结果
1.CDR3序列的患者间异质性分析
研究了在25例HCC患者的所有样本类型中共享的CDR3序列。相邻组织与肿瘤组织共享CDR3序列的比例为4.3%(图2A),PBMC与肿瘤组织共享CDR3序列的比例为1.5%(图2B)。根据每个样本类型同一阶段的任意两个样本之间共有的TCR克隆型数量,采用Jaccard指数评估TCR相似性。肿瘤中TCR克隆型的相似性高于邻近组织(P=0.0378),但与PBMC相似(图2C)。BCLC_C期患者的TCR相似性高于BCLC_A和BCLC_B期,这在所有三种样本类型中都存在。根据TCR β-seq数据库,通过利用Morisita重叠指数(MOI),考虑T细胞重排的组成和丰度,定量评估每两个样本之间的重叠克隆型(图2D-F)。在肿瘤和PBMC中,TCR克隆型在BCLC_C期患者之间的重叠程度高于BCLC_A期和BCLC_B期患者,但无统计学意义。
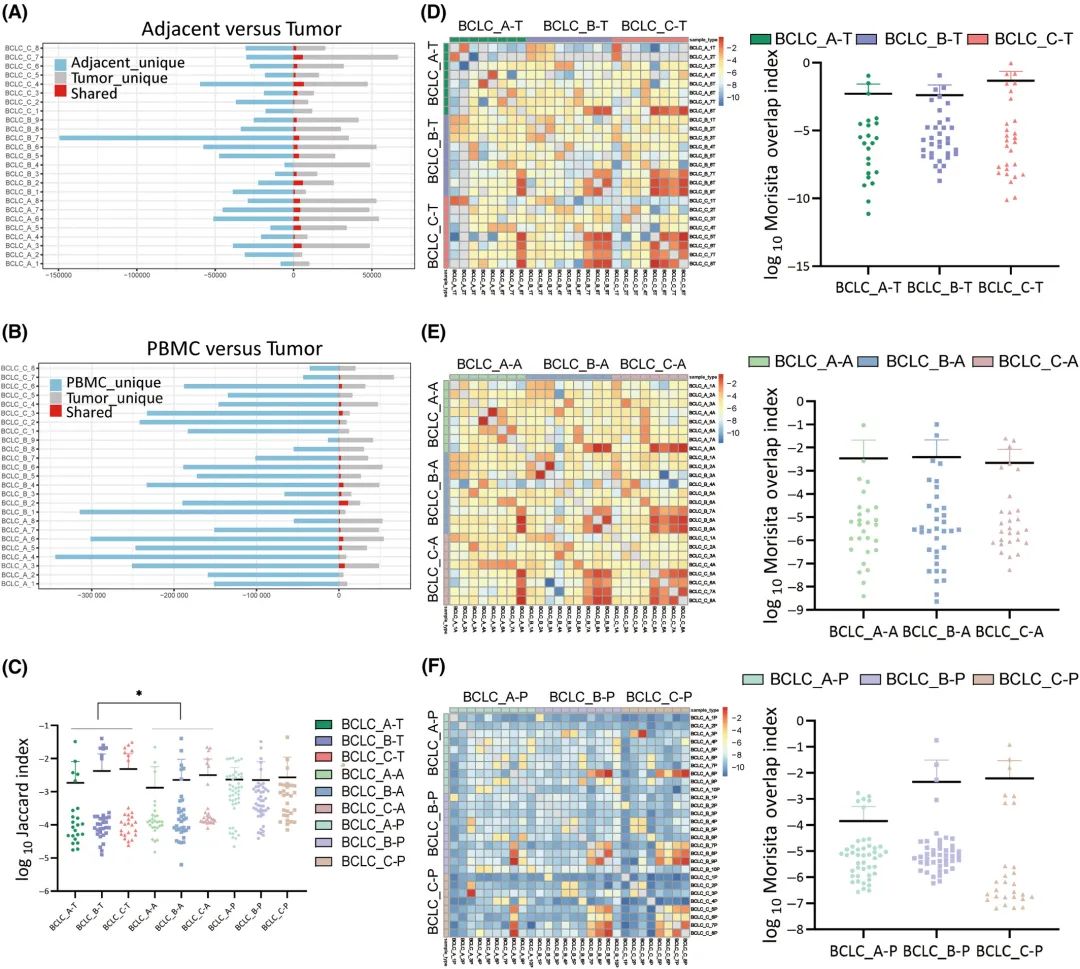
图2.CDR3序列的患者间异质性分析
2.CDR3序列的多样性和克隆性
CDR3序列是决定TCR多样性和反映特异性T细胞克隆增殖的主要区域。前100个CDR3序列与总CDR3序列的比值(前100个CDR3)代表TCR的克隆性(图3A-C)。
在肿瘤组织中,BCLC_A、BCLC_B和BCLC_C患者中前100个CDR3的频率分别为52.81%、35.11%和41.04%。BCLC_A期与BCLC_B期肿瘤组织前100位CDR3序列差异有统计学意义(P=0.042)。在PBMC样本中,BCLC_A、BCLC_B和BCLC_C分期前100个CDR3的频率分别为32.53%、25.87%和46.53%,表明晚期HCC的外周TCR克隆性高于中期HCC (P=0.015)。为了详细了解CDR3在不同阶段的频率分布,计算了CDR3序列的累积频率,将CDR3序列从最高频率到最低频率分为14组(图3D-L)。在肿瘤组织中,BCLC_A、BCLC_B和BCLC_C期患者中前50个CDR3的频率分别为46.67%、27.87%和34.27%(图3D-F)。在PBMC样本中,BCLC_A、BCLC_B和BCLC_C分期患者中前50个CDR3的频率分别为29.23%、23.10%和43.59%(图3J-l),进一步表明BCLC_C分期患者中TCR的克隆性增加。
考虑到CDR3前100个克隆型的克隆分数的差异,将样本分为高(克隆分数≥0.1%)、中(0.01% <克隆分数< 0.1%)和低(克隆分数≤0.01%)组(图3M,N)。与BCLC_A和BCLC_B期相比,BCLC_C期外周血中低频CDR3水平最低,高频CDR3水平最高,表明晚期HCC外周血T细胞中TCR的多样性减少,TCR的克隆性增加(图3N)。
图3
此外,还应用Hill指数分布曲线、D75、Shannon指数、singleton指数、克隆性指数、Gini-Simpson指数、逆辛普森指数和树形图对不同BCLC阶段CDR3序列的多样性和克隆性进行了更定量的测量(图4A-K)。Hill指数分析的TCR多样性在三种样本类型中均无统计学差异(图4A-C)。D75分析的TCR多样性显示,无论是肿瘤还是邻近组织,不同BCLC分期之间的TCR多样性均无统计学差异(图4D,E)。通过D75、Shannon指数和Singleton指数分析,发现PBMCs中TCR的多样性明显高于肿瘤和邻近组织(图4F-H)。Shannon指数、Singleton指数、ginissimpson指数和Inverse-Simpson指数分析的TCR多样性显示,无论是肿瘤还是邻近组织,不同BCLC分期之间的TCR多样性均无统计学差异(图4 G-J)。根据D75、Shannon指数和Singleton指数,BCLC_C患者的CDR3序列多样性明显低于PBMCs的BCLC_A患者(图4F-H)。根据D75、Shannon指数、Gini-Simpson指数和Inverse-Simpson指数,PBMCs中BCLC_C患者的CDR3序列多样性明显低于BCLC_B患者(图4F-J)。在PBMCs中,BCLC_C期的克隆性高于BCLC_A(P=0.02)和BCLC_B(P =0.0005)期(图4K)。这些数据进一步支持循环T细胞的多样性随着PBMC中HCC的进展而逐渐减少。
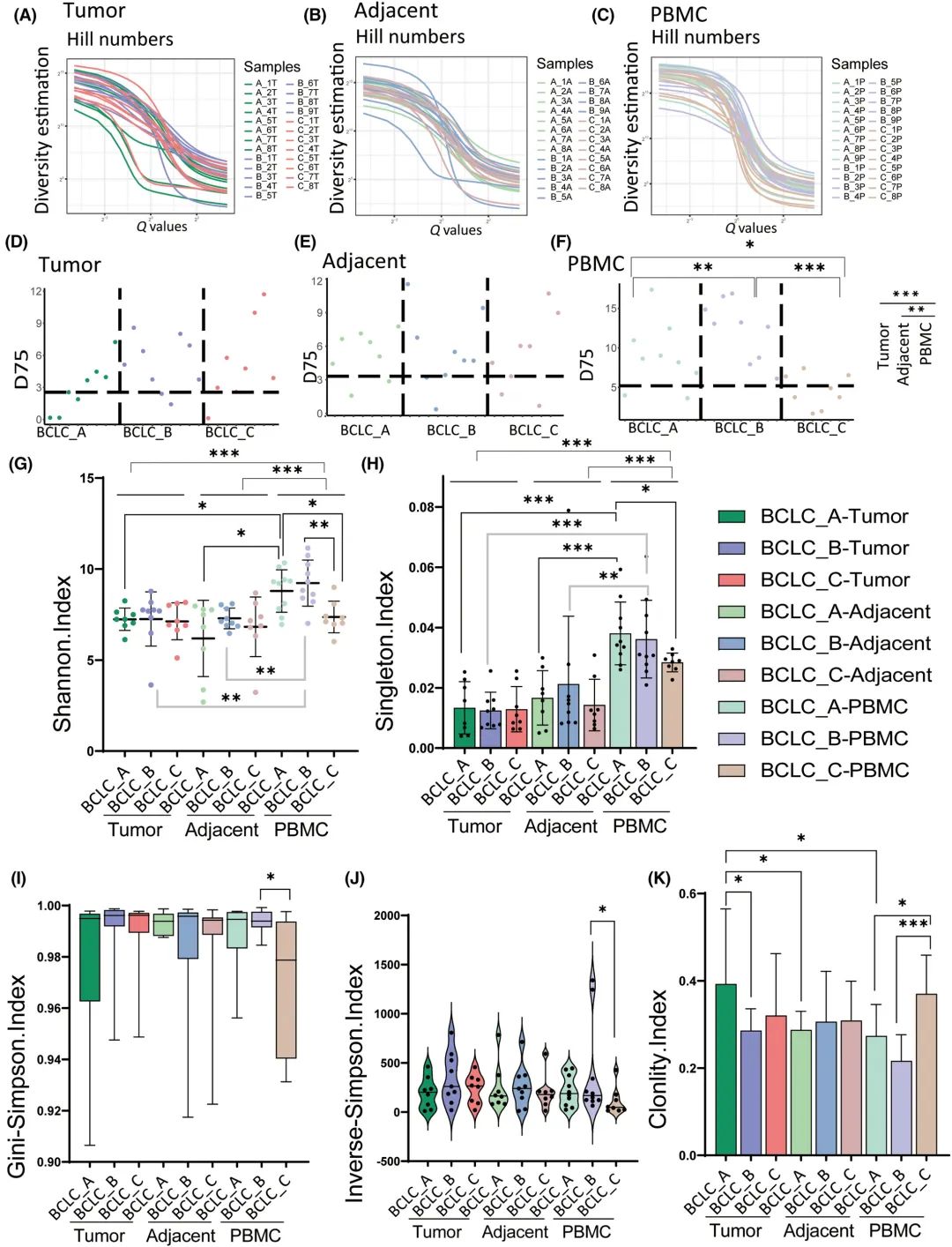
图4
3.CDR3长度和氨基酸组成
CDR3长度和组成的异常通常对患者多种非自身抗原产生有效适应性免疫反应的能力产生重大影响。V、D和J基因的偏差用法可能影响氨基酸的组成和CDR3区域的疏水性,这对抗原鉴定具有潜在的重要影响。然而,在肿瘤、邻近组织和PBMC的所有三个阶段中,CDR3长度分布均无显著差异(图5A)。此外,在所有三个阶段和三种样品类型中,CDR3片段>15个氨基酸长度没有显著差异(图5B)。
最近的研究表明,在CDR3的13个氨基酸长序列中,第6位和第7位的疏水性氨基酸可以促进自反应性T细胞的发育。三个阶段和三个样品类型的6和7位分析了20个氨基酸残基组成(图5C-E)。与疏水和亲水氨基酸相比,无论BCLC阶段和样品类型如何,在位置6和7,中性氨基酸的频率最高(图5F)。在6号位置,BCLC_C期亲水氨基酸比PBMC的BCLC_A期(P=0.049)和BCLC_B期(P=0.873)更丰富(图5G)。在7号位置,与肿瘤的BCLC_A期(P=0.03)或BCLC_B期(P=0.001)相比,BCLC_C期疏水氨基酸的富集程度较低(图5G)。这些结果表明,自身反应性T细胞的发育和功能在晚期HCC中受损。
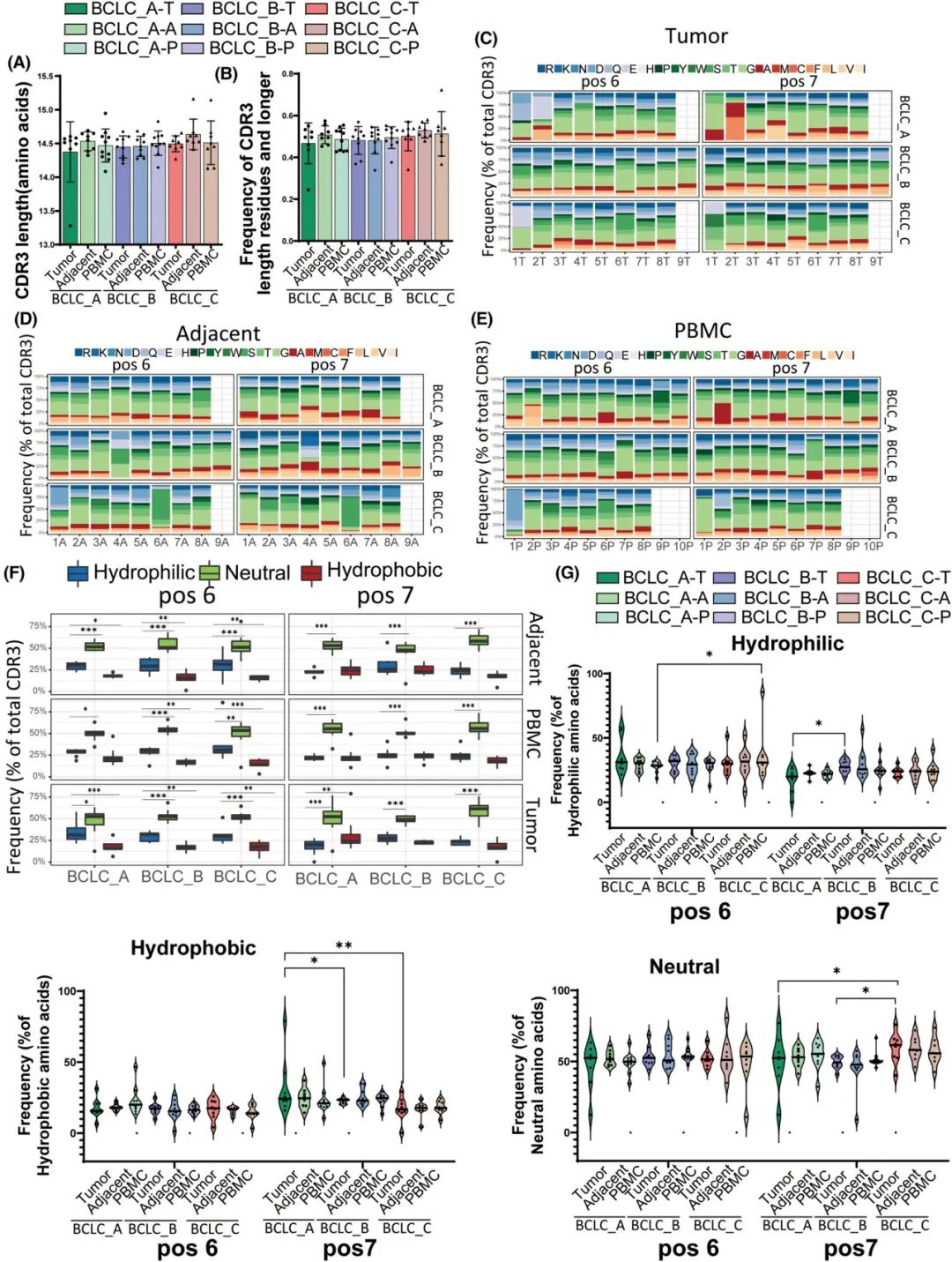
图5
4.复发与非复发患者TCR谱比较
BCLC_B和BCLC_C组采用Kaplan-Meier法计算OS。只有1例患者在BCLC_A期死亡,导致中位OS未确定。BCLC_B期中位OS为13.0个月(95% CI 10.1-15.9), BCLC_C期中位OS为5.5个月(95% CI 3.2-6.8)(图6A)。
为了明确TCR与预后的关系,通过分析了6例BCLC_A期复发和3例非复发患者的V(D)J基因片段使用频率、CDR3序列分布和氨基酸组成。与肿瘤相比,PBMC中的CDR3序列重叠程度更高(图6B)。肿瘤中,复发和非复发患者前100位CDR3频率分别为36.40%和75.98% (P=0.022)(图6C)。肿瘤复发和非复发患者的前50位CDR3频率分别为27.1%和73.82% (P=0.001)(图6D)。在PBMC中,复发和非复发患者的前100名CDR3频率分别为28.37%和41.94%(图6C);复发和非复发患者CDR3频率前50位分别为24.67%和39.38%(图6D)。这些结果表明,较高的前100 CDR3频率似乎与较好的预后相关。肿瘤复发患者的高克隆分数低于非复发患者,但无统计学意义(图6E)。
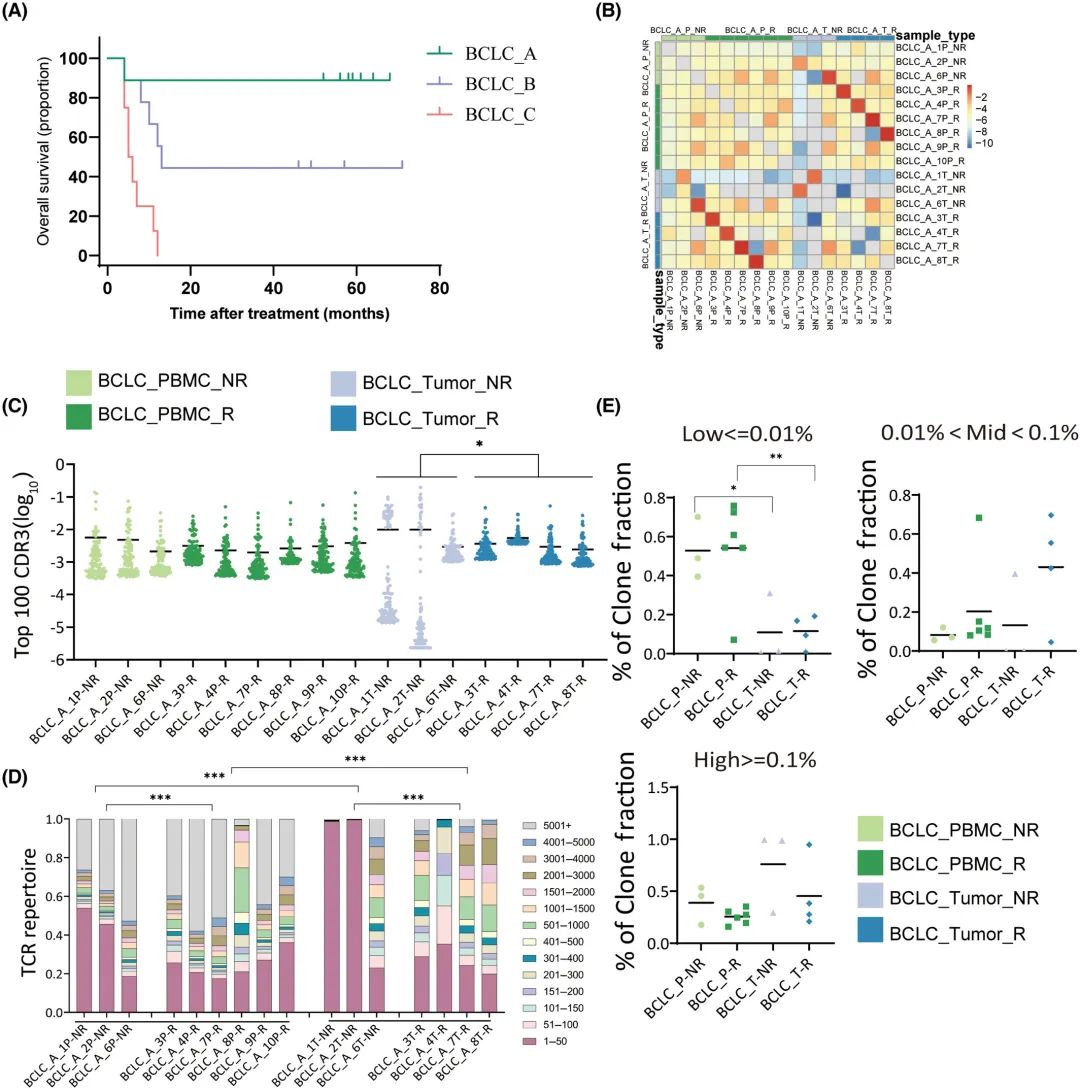
图6
肿瘤复发患者的TCR克隆性也低于非复发患者(图7A)。Shannon指数、D75和Singleton指数分析的TCR多样性在PBMC中高于肿瘤,与肿瘤复发无关(图7B-D)。根据逆辛普森指数(Inverse-Simpson Index)和基尼-辛普森指数(Gini-Simpson Index),与非复发患者的肿瘤相比,PBMC的TCR多样性更高,但没有观察到统计学意义(图7E、F)。在PBMC (P=0.02)和肿瘤(P=0.686)中,复发组中6位疏水氨基酸的频率低于非复发组,这加强了先前关于疏水氨基酸在激活自反应性T细胞中发挥作用的报道(图7G,H)。
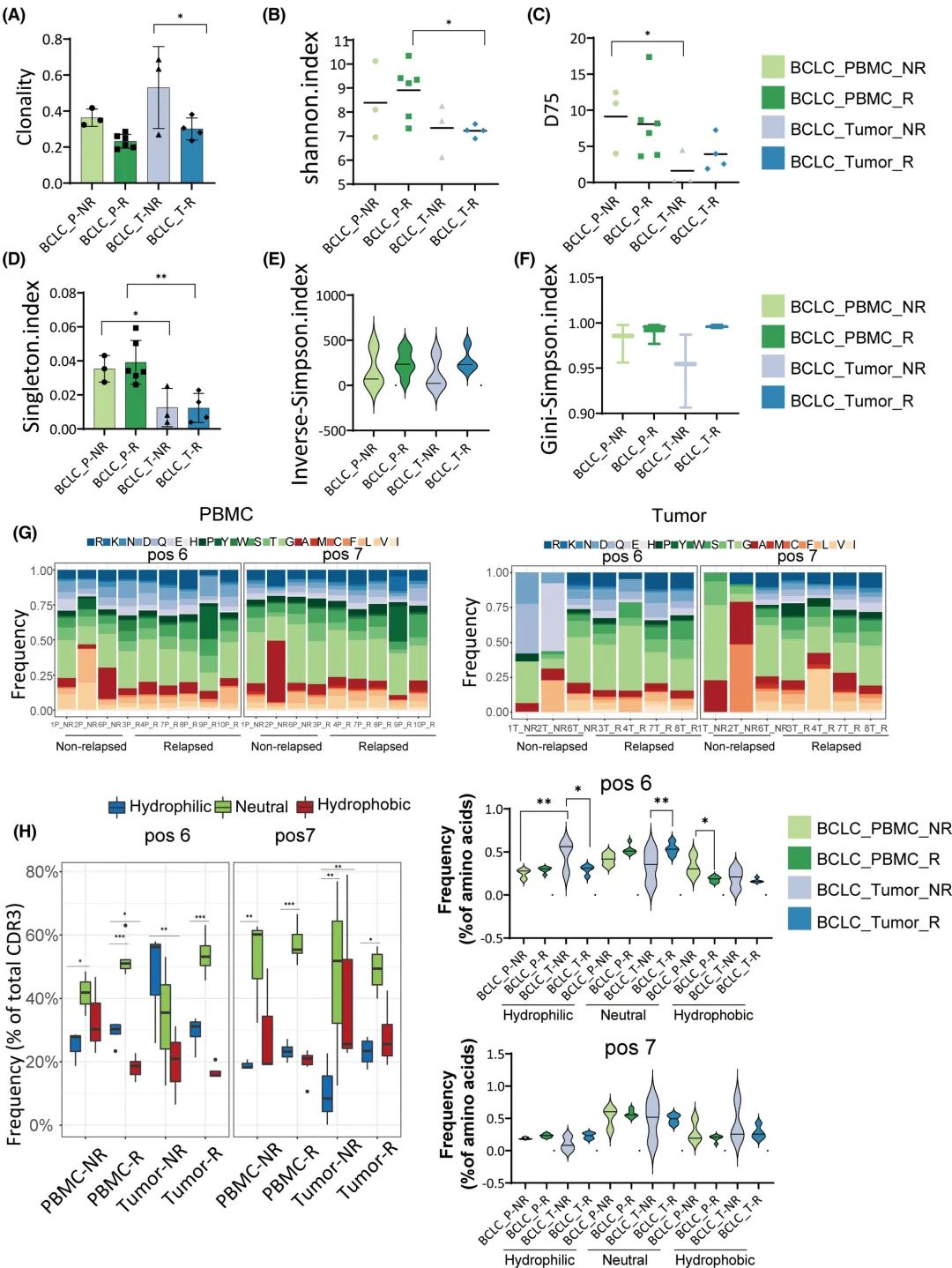
图7
5.1例肿瘤复发患者的TCR谱分析
为了研究肿瘤复发患者TCR基因库的时空分布,通过收集了1例复发患者(BCLC_A_4)的复发肿瘤原位置(T2)和新位置(T3)以及PBMCs (P2)进行TCR测序,并与原肿瘤(T1)、原PBMCs (P1)和原邻近组织(A1)进行比较。TCR克隆型在P1和P2之间显示出更高程度的重叠(图8A);这可能是由于P1和P2中丰富的CATSDPSTGTTGELFF CDR3序列所致(图8B)。克隆性显示P1高于P2,但差异无统计学意义(图8C)。T1的克隆性高于T2和T3(图8C), T1的多样性低于T2和T3(图8D,E),但差异无统计学意义。无论克隆性和多样性如何,T2和T3之间没有显著差异(图8D,E),表明TCR谱在原发肿瘤和复发肿瘤之间可能存在很大差异。每个样品中TRBV和TRBJ的重组情况如图8F所示。Jensen-Shannon差异似乎表明T1、T2和T3之间的V和J基因的使用具有更高的相似性(图8G),这衡量了两个概率分布的相似性。
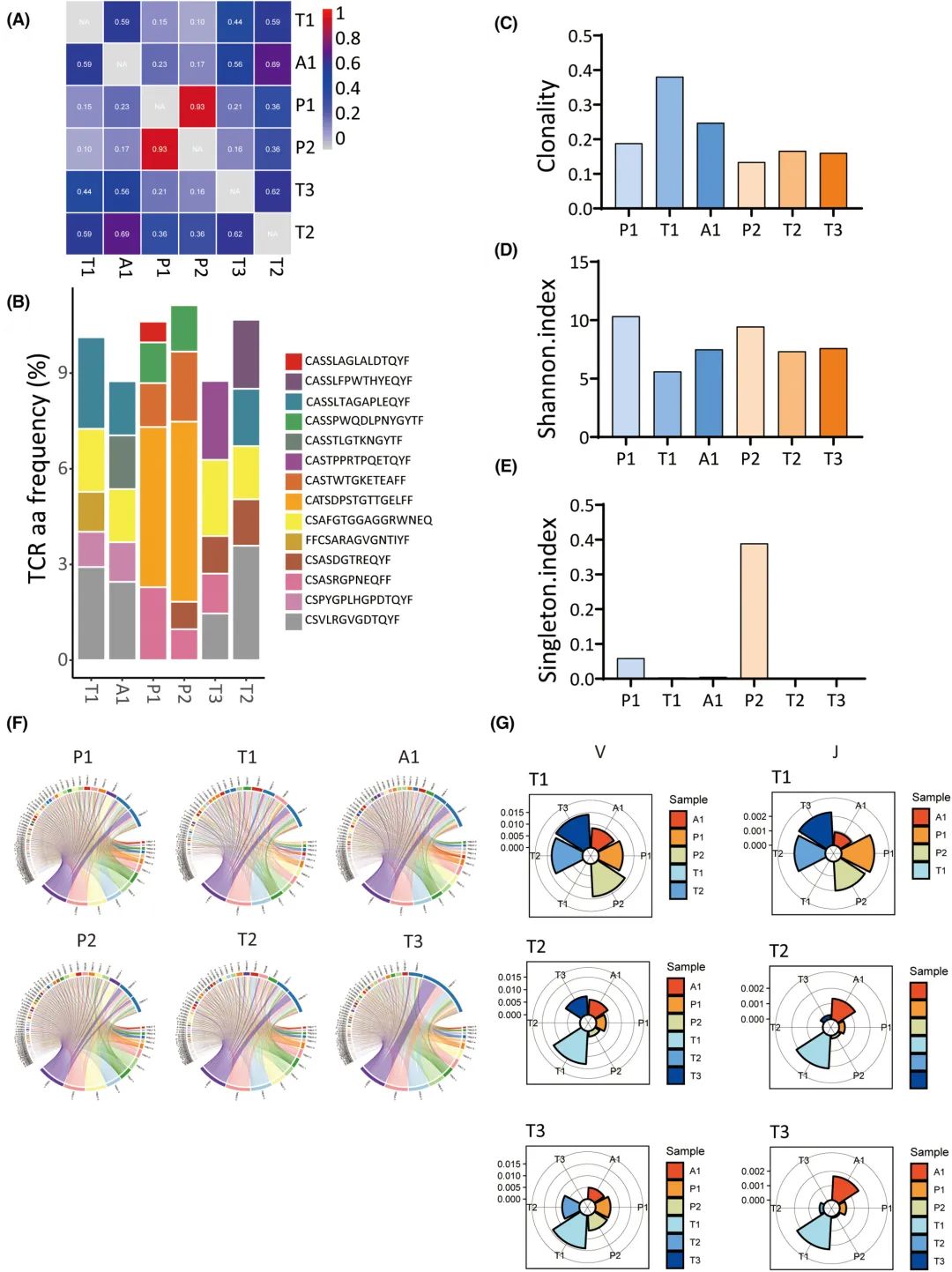
图8
研究结论
该研究阐明了不同BCLC分期的HCC肿瘤组织、癌旁组织及外周血单核细胞中TCR特征,同时进行了时间上不同分期的纵向比对和空间上不同样本的横向比对,从而揭示了HCC不同时期TCR特征。相比早期和中期,BCLC_C期外周血T细胞的TCR克隆性显著增加,多样性显著减少,提示PBMC比肿瘤组织能更好地描绘HCC患者不同肿瘤分期的TCR特征。通过明确了HCC患者TCR与预后的关系,患者TCR克隆性较高,肿瘤复发风险较低,预后较好。推测早期组织中TCR的克隆性可成为预测患者术后复发的重要指标。
参考文献
Li R, Wang J, Li X, Liang Y, Jiang Y, Zhang Y, Xu P, Deng L, Wang Z, Sun T, Wu J, Xie H, Wang Y. T-cell receptor sequencing reveals hepatocellular carcinoma immune characteristics according to Barcelona Clinic liver cancer stages within liver tissue and peripheral blood. Cancer Sci. 2023 Nov 14. doi: 10.1111/cas.16013. Epub ahead of print. PMID: 37962061.

杭州艾沐蒽生物科技有限公司成立于2016年,是国际前沿的专注于免疫驱动医学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组基因高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子(纳斯达克代码:GTH)使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®肿瘤早筛、单细胞测序、TCR-T和抗体发现等平台管线。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。


