在健康人和癌症患者中对免疫退化和免疫发病机理的讨论一直存有争议。另外,新的免疫疗法已经成为许多老年癌症患者的治疗方法,化疗对T细胞再生的作用需要进一步研究。作者使用下一代免疫测序技术研究了来自健康个体和癌症患者的346份血液样本的T细胞受体(TCR)库指标,产出了包含约880万个TCR测序的数据集。该分析表明,T细胞多样性的下降和T细胞克隆性的增加是一个持续的过程,开始于40岁以上的健康个体。几十年来,与健康个体相比,未经治疗患者的血液和实体瘤中所展示TCR谱中多样性显著降低,克隆性显著提高。在老龄健康个体中T细胞多样性的减少本质上是由个体中丰富度的减少所导致的,而在癌症患者中,保留库均匀性的丧失是由其他因素所导致的。化疗没有损害血液中TCR库多样性恢复到治疗前的特定年龄水平。即使是70岁以上接受高T细胞毒性治疗的患者,也能重建其T细胞多样性,这表明胸腺活性反弹了,不仅是通过外周扩增来恢复T细胞数量。综上所述,这些数据表明人类TCR指标在衰老个体中逐渐恶化,但在老年癌症患者中,对于特定年龄的TCR指标在T细胞消耗治疗后也是可以恢复的。
随着时间的推移,免疫功能的下降被认为是随着年龄增长感染、自身免疫和癌症发生率随之增加。从骨髓来源的造血干细胞产生naïve T细胞库的胸腺从儿童到成年经历了明显的衰退。
T细胞重构是适应性免疫应答恢复的一个关键特征,它有两个主要组成部分:新T细胞的胸腺输出和预先存在的T细胞的外周稳态扩张。在探索随时间推移的免疫库指标变化的过程中,从动物模型中推断是没有用的,因为尽管许多免疫学原理在不同物种之间是共享的,但典型动物模型的T细胞系统的大小和寿命与人类系统有着根本的不同。对人类免疫老化和免疫重建的研究给出了不一致的结果,部分原因是使用了应谨慎解释的方法,如T细胞受体切除圈(TREC)测量。
2014年,Britanova等人进行的一项下一代测序(NGS)研究分析了39名健康个体,为年龄依赖性TCR库免疫动力学研究设定了基准。与之前使用不太精确的技术的研究相反,该小组发现T细胞多样性随着时间的推移呈线性减少,在40岁时已经明显减少。
与健康人群不同的是,癌症患者在细胞毒性治疗(尤其是T细胞毒性治疗)后是否能够恢复TCR库仍然存在争议,在这项对346个TCR谱的综合分析中,作者发现了与治疗无关的癌症患者免疫早衰的明确证据。作者发现接受T细胞毒性治疗的老年患者也在很大程度上重建了他们的年龄特异性TCR库,这有力地支持了在淋巴细胞被治疗诱导减少后,重新激活胸腺产生的假设。
1.收集患者样本
2.(NGS)的T细胞受体(TRB)库进行多重PCR
3.(NGS)新一代测序
4.谱系指标的计算
5.产生概率计算
6.数据分析
7.数据可用性
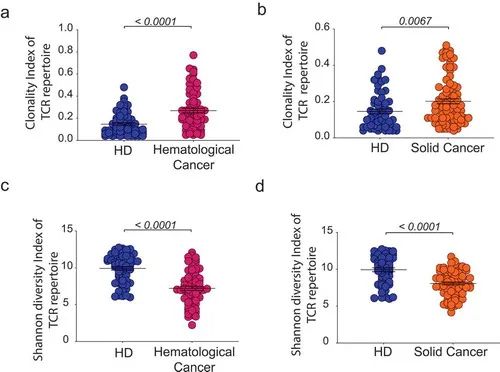
图1 癌症患者与健康个体间T细胞库指标的比较。
首先,作者选取85名未经治疗的血液癌(hemC)患者和108名实体瘤(solC)患者接受了NGS外周血T细胞库分析,并将其T细胞空间与95名健康人(HD)进行了比较。为了解释由于年龄差异而导致的免疫库差异,作者比较了患者亚群(分别为hemC和solC)与年龄匹配的HDs亚群。与HD患者相比,未经治疗的血液(但非T细胞)癌症患者表现出更高的克隆性和更低的T细胞多样性(p < 0.0001)(图1a,c)。因为这些患者有原发性和/或继发性淋巴器官浸润,可能会损害造血前体向胸腺的迁移和/或外周T细胞的扩增。同时与各自年龄匹配的HDs亚群比,未经治疗的实体恶性肿瘤患者表现出更多的克隆性(p = 0.0067)和更少的多样性(p < 0.0001)(图1b,d)。这些表明,与血液癌或实体癌患者相比,HD的外周血TCR谱更多样化,分布更均匀。
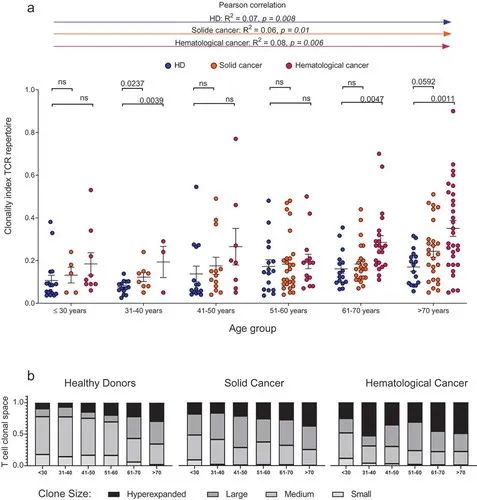
图2.健康个体和癌症患者年龄相关TCR库克隆
随后,将患者和心脏病患者被分为10岁年龄组,从30岁以下到70岁以上。作为对年龄相关指标的粗略估计,计算了T细胞的克隆性和多样性(图2a和3a)。
在癌症患者中,与HD患者相比,克隆性的增加开始于更早的年龄组(图2a).平均克隆空间分布表明,在60岁以下的老年HD患者中,small 克隆仍占约15%的T细胞空间,而在30岁以上的癌症患者中,small T细胞克隆的可以忽略不计(图2b)。
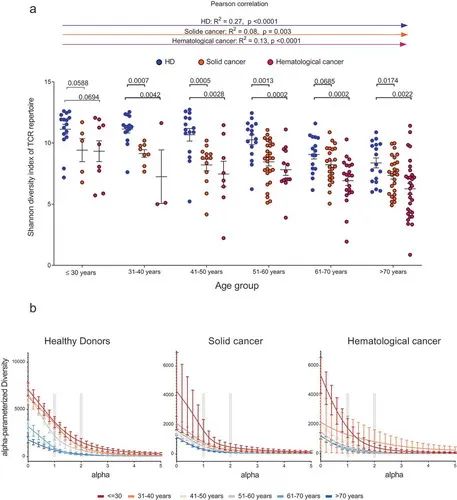
图3.健康个体和癌症患者年龄相关TCR库多样性
与先前发表的数据一致,10名健康供者的T细胞库随着年龄的增加而明显收缩,多样性下降,大约在40岁以后开始(相关系数R2=0.27, p<0,图3a,b)。对于实体肿瘤患者或血液癌患者,观察到T细胞库多样性与年龄有相同下降,但斜率更陡(实体癌相关系数R2=0.08, p=0.003,血液癌相关系数R2=0.13, p<0.01,图3a,b)。
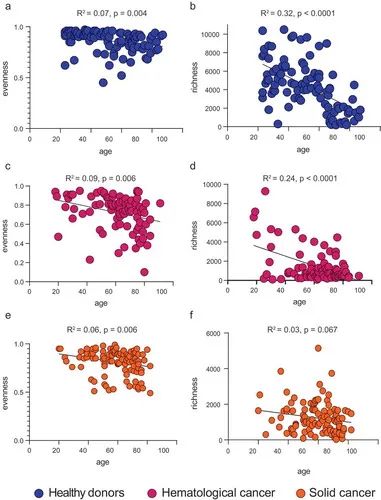
图4.龄与TCR库均匀度/丰富度的相关性。
作者通过剖析了多样性的单个参数(丰富度和均匀度),更好地解释随着年龄的增长多样性的下降(图4)。健康衰老过程中多样性的减少似乎最能解释为丰富度的减少,因为随着时间的推移,这些谱系保持相对均匀(图4a,b)。在衰老的癌症患者中,丰富度和均匀度的减少都导致了T细胞多样性的减少(图4c,d)。
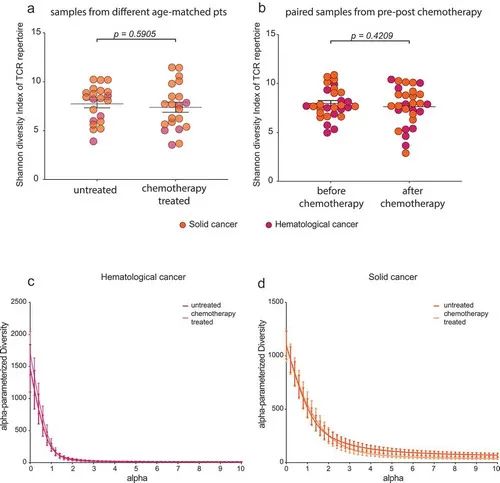
图5.化疗对肿瘤患者T细胞多样性的影响。
注:图5和图6所示的分析包括两个不同的亚队列:
(i)根据年龄和肿瘤类型匹配的患者,未经治疗或接受化疗(标记为“来自不同年龄匹配患者的样本”)。
(ii)化疗前后采集成对样本的患者(标记为“化疗前后的成对样本”)。
接下来,作者对中位年龄为60岁的癌症患者化疗后的T细胞再生潜力进行了研究。在这些患者中,疾病和限于特定年龄的T细胞库的差异在治疗开始前就已经可以辨别出来。作者调查了一组经过各种化疗的癌症患者(主要是实体瘤),并将其与疾病和年龄匹配的未治疗癌症患者的对照队列进行了比较(图5a和6a)。显示在T细胞库多样性或克隆性方面,接受治疗和未接受治疗的患者之间没有显著差异(图5a和6a)。
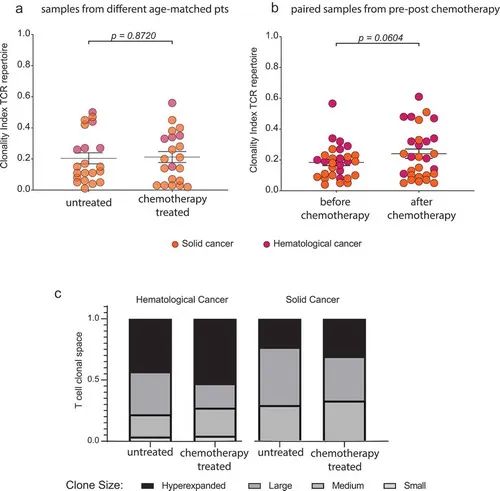
图6.化疗对肿瘤患者T细胞克隆的影响。
在接受氟达拉滨或苯达莫司汀治疗的慢性淋巴细胞白血病(CLL)患者和接受替莫唑胺治疗的脑肿瘤患者中进行的这项分析表明,即使在接受T细胞毒性治疗的老年患者中,T细胞库也在很大程度上恢复到治疗前的特定年龄的多样性/克隆性(图5b和6b)。有在氟达拉滨治疗的血液病CLL患者队列中,治疗后的克隆性呈上升趋势(图6b),但多样性指标保持稳定(图5b)。综合两个队列,化疗后的多样性或克隆性没有明显的剧烈变化(图5c,d)、(图6c)。
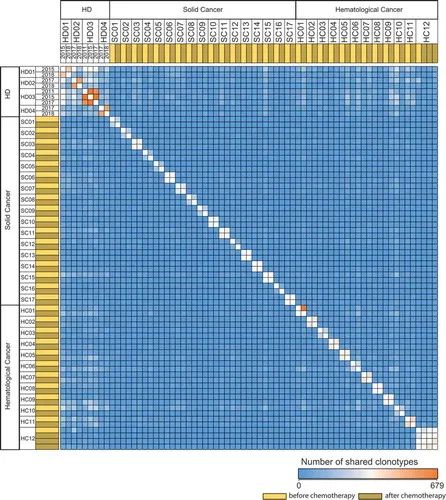
图7.T细胞库在健康个体和癌症患者化疗前后重叠。
在两个队列(胶质母细胞瘤,CLL)中,使用配对的治疗前和治疗后血液样本进行的库重叠分析显示几乎没有克隆重叠,而在几个月到几年的时间里记录的HD的对照TCR库显示出明显的克隆重叠,即使经过多年的重新采样(图7)。这证实了作者的假设,即高血液毒性治疗后TCR库多样性和均匀性的完全重建是由于胸腺活性的反弹,而不是外周T细胞的扩增。
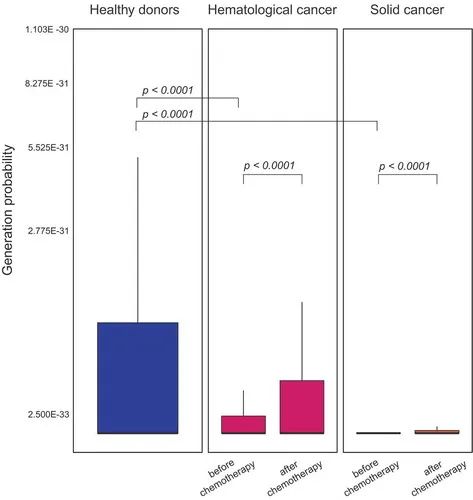
图8.TCR库的生成概率。
作者观察到未经治疗的癌症患者的T细胞产生概率比健康受试者低,这表明癌症患者的克隆扩增更多。此外,与我们的假设一致,我们观察到明显的转变(hemC:p=1.3E−15,solC:p < 2.2E−16),在癌症患者队列中,在治疗间隔内,中位生成概率增加(图8)。这一数据表明,血毒化疗可以消除周围的T细胞克隆,然后通过胸腺产生反弹来重建细胞库。
癌症患者的年龄、疾病和治疗相关的T细胞免疫损伤具有临床相关性,因为它决定了对感染(特别是病毒再激活和机会性感染)的易感性以及抗肿瘤免疫控制。
NGS免疫测序是一项用于T细胞库指标分析的先进技术,具有精确评估免疫老化,癌症相关免疫抑制或治疗后免疫重建的潜力。它允许同时从单个组织样本中识别数万到数百万个T细胞受体(TCR)重排。通过这种方式,该技术使深入和高通量表征大型谱系成为可能,随着时间的跟踪监测,并整合所有信息,以获得定量和可靠的指标,如克隆性和多样性指数或克隆区间分布。
NGS数据作为迄今为止最广泛的公开访问的T细胞免疫库数据库,并被科学界用于进一步分析。在这篇论文中提出的生物信息学分析可以集中表现了三个基本发现:1)T细胞空间的质量随着年龄的增长而恶化,这可以通过多样性的丧失和克隆性的增加来证明:2)年龄依赖性的T细胞指标损伤在癌症患者中比在健康受试者中更为明显;3)年龄特异性的库指标在淋巴细胞减少治疗后甚至可以在老年癌症患者中完全恢复。这些发现为癌症患者的免疫老化、致癌和免疫重建开辟了有趣的新视角,并影响作者对免疫和细胞毒性癌症治疗算法的思考方式。这一研究的一个重要方面(与之前发表的研究23,24相反)是作者的NGS数据表明,胸腺对成人(甚至是70岁以上的年龄组)T细胞毒性化疗后的免疫重建有重要贡献。
随着科学界越来越多地使用TCR测序,以及自身免疫、疫苗接种和感染领域越来越多的研究问题得到解决,作者的数据可能会为TCR库的年龄特异性偏差提供新的证据。
参考文献
Donjete Simnica, Nuray Akyüz, Simon Schliffke, Malte Mohme, Lisa v.Wenserski, Thorben Mährle, Lorenzo F. Fanchi, Katrin Lamszus & Mascha Binder (2019)
T cell receptor next-generation sequencing reveals cancer-associated repertoire metrics and reconstitution after chemotherapy in patients with hematological and solid tumors,OncoImmunology, 8:11, e1644110, DOI:10.1080/2162402X.2019.1644110

杭州艾沐蒽生物科技有限公司成立于2016年,是国内前沿的专注于免疫基因组学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子(纳斯达克代码:GTH)使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®疾病早筛、单细胞测序、TCR-T药物开发等平台管线。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。
艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。


