
еОЯеРНпЉЪSingle-cell sequencing reveals effects of chemotherapy on the immune landscape and TCR/BCR clonal expansion in a relapsed ovarian cancer patient
иѓСеРНпЉЪеНХзїЖиГЮжµЛеЇПжП≠з§ЇеМЦзЦЧеѓєе§НеПСеНµеЈҐзЩМжВ£иАЕеЕНзЦЂжЩѓиІВеТМTCR/ BCRеЕЛйЪЖжЙ©еҐЮзЪДељ±еУН
жЬЯеИКпЉЪFrontiers in immunology
ељ±еУНеЫ†е≠РпЉЪ8.713
еПСи°®жЧґйЧіпЉЪ2022-09-28
иГМ
жЩѓ
зЩМзЧЗе§НеПСеТМеМЦзЦЧиАРиНѓжШѓйЂШзЇІеИЂжµЖжґ≤жАІеНµеЈҐзЩМ(HGSOC)жВ£иАЕж≠їдЇ°зЪДдЄїи¶БеОЯеЫ†гАВзДґиАМпЉМеЕНзЦЂзОѓеҐГеЬ®е§НеПСеМЦзЦЧиАРиНѓжВ£иАЕиВњзШ§ињЫе±ХдЄ≠зЪДзЛђзЙєдљЬзФ®дїНзДґйЪЊдї•жНЙжСЄгАВз†Фз©ґTMEеПКеЕґеѓєеМЦзЦЧеє≤йҐДзЪДеК®жАБеПНеЇФеѓєдЇОйШРжШОHGSOCе§НеПСеТМйЪЊж≤їжАІзЪДжЬЇеИґиЗ≥еЕ≥йЗНи¶БгАВ
з†Фз©ґжЦєж≥Х
-
жФґйЫЖжВ£иАЕж†ЗжЬђеТМHGSOC scRNA-seqжХ∞жНЃ
-
еНХзїЖиГЮжВђжµЃжґ≤зЪДеИґе§З
-
еНХзїЖиГЮRNA-seqгАБTCRseqеТМBCR-seqжЦЗеЇУзЪДеИґе§З
-
еЕНзЦЂзїДзїЗеМЦе≠¶жЯУиЙ≤
-
еНХзїЖиГЮеЇПеИЧжХ∞жНЃе§ДзРЖ
-
йЫЖжИРгАБйЩНзїіеТМжЧ†зЫСзЭ£иБЪз±ї
-
еЈЃеЉВи°®иЊЊеЯЇеЫ†йЙіеЃЪеПКеЯЇеЫ†йЫЖеѓМйЫЖеИЖжЮР
-
G2/MзЫЄиѓЖеИЂ
-
еНХзїЖиГЮиљ®ињєеИЖжЮР
-
CellChatеИЖжЮР
-
CNVеИЖжЮР
-
жµБеЉПзїЖиГЮжЬѓеИЖжЮР
-
зїЖиГЮеЫ†е≠РжµЛеЃЪ
-
TCGAжХ∞жНЃеИЖжЮР
-
еНХзїЖиГЮTCRеТМBCRжµЛеЇПжЦЗеЇУзЪДе§ДзРЖ
-
еНХзїЖиГЮTCRеТМBCRеЕЛйЪЖеЮЛеИЖжЮР
-
еНХзїЖиГЮTCR/BCR V(D)JжµЛеЇПеПКеИЖжЮР
-
зФЯе≠ШеИЖжЮР
-
зїЯиЃ°еИЖжЮРеТМжХ∞жНЃеПѓиІЖеМЦ
зїУжЮЬ
01 е§НеПСеМЦзЦЧиАРиНѓеНµеЈҐзЩМжВ£иАЕеНХеПСзЧЕеПШеТМиЕєж∞ізЪДзїЖиГЮзїДжИР
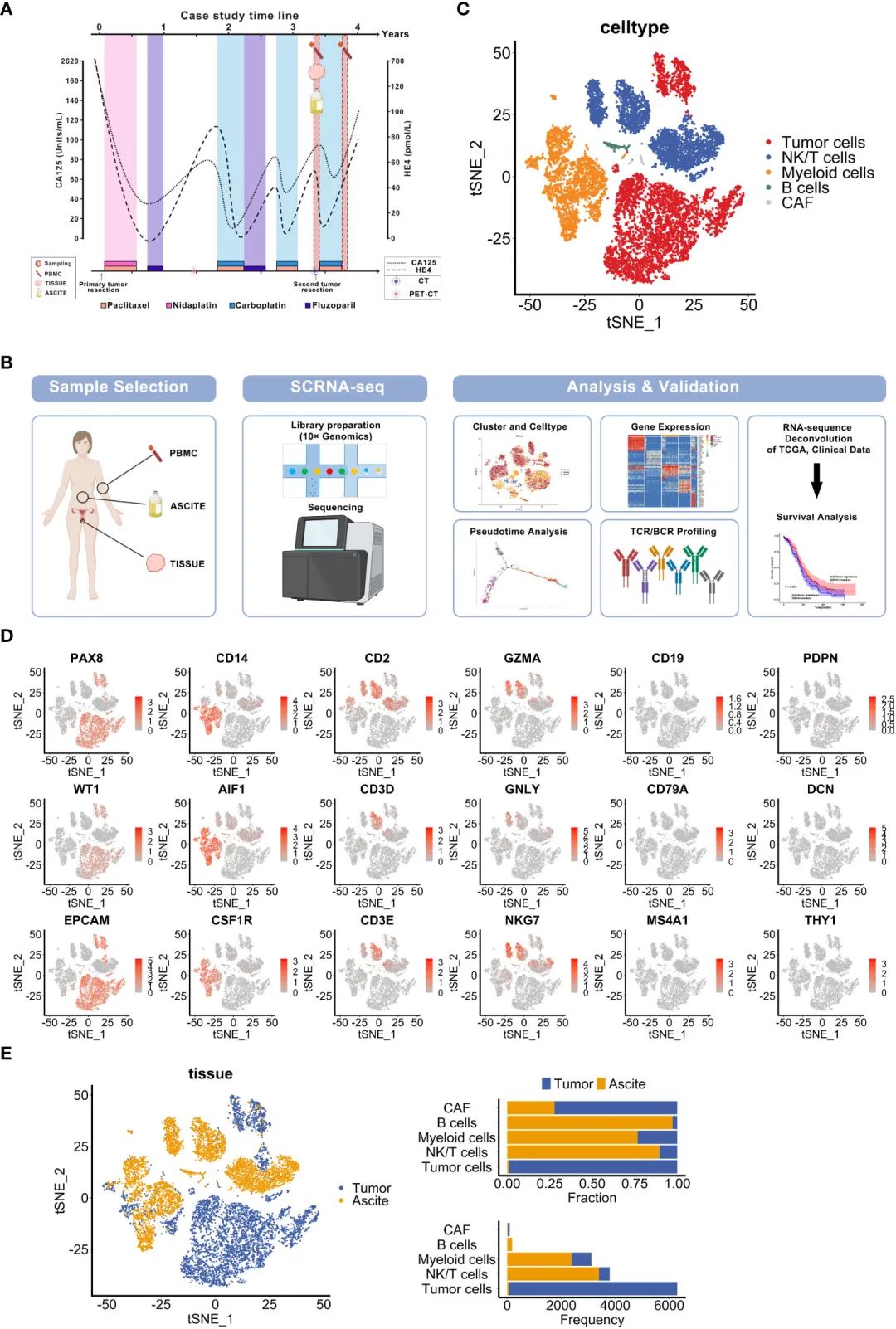
дЄЇдЇЖйШРжШОеНµеЈҐзЩМжВ£иАЕзЪДзЙєеЊБпЉМе∞љзЃ°жО•еПЧдЇЖж†ЗеЗЖеТМеєњж≥ЫзЪДж≤їзЦЧпЉМдљЖзїПеОЖдЇЖдїОеМЦзЦЧжХПжДЯеИ∞иАРиНѓзЪДйАРжЄРиљђеПШеТМиВњзШ§еПНе§Не§НеПСпЉМиѓДдЉ∞дЇЖIIICжЬЯHGSOCжВ£иАЕгАВжВ£иАЕжЬАеИЭжО•еПЧдЇЖжЬАдЉШжЙЛжЬѓеЗПеОЛпЉМйЪПеРОжО•еПЧдЇЖзіЂжЭЙйЖЗиБФеРИе•ИиЊЊйУВж≤їзЦЧпЉМ17дЄ™жЬИеРОй¶Цжђ°е§НеПСпЉМжПРз§ЇйУВжХПжДЯе§НеПСжАІеНµеЈҐзЩМгАВдЄНеєЄзЪДжШѓпЉМе•єеПИзїПеОЖдЇЖдЄЙжђ°е§НеПСпЉМи°АжЄЕCA125/HE4еТМељ±еГПе≠¶жШЊз§ЇеЖНжђ°дЄКеНЗпЉМжѓПжђ°е§НеПСжЧґе•єзЪДPFSеПШзЯ≠(дїО7дЄ™жЬИеИ∞4дЄ™жЬИеИ∞2дЄ™жЬИ)пЉМи°®жШОе•єеЗЇзО∞дЇЖеМЦзЦЧиАРиНѓ(еЫЊ1A)гАВ
дЄЇдЇЖи°®еЊБињЩдЇЫж†ЈеУБзЪДзїЖиГЮжИРеИЖпЉМдљњзФ®10x Genomicsеє≥еП∞зФЯжИРеєґеИЖжЮРдЇЖеНХзїЖиГЮиљђељХзїДи∞±(еЫЊ1B)гАВеЯЇдЇОеЈ≤зЯ•зЪДзїЖиГЮз±їеЮЛж†ЗиЃ∞пЉМйАЪињЗеѓєеИЖеЄГйЪПжЬЇйВїе±ЕеµМеЕ•(t-SNE)жШЊз§ЇзЪД5зІНзїЖиГЮз±їеЮЛињЫи°МдЇЖиѓЖеИЂеТМеИЖз±ї:иВњзШ§зїЖиГЮ(EPCAM, PAX8, WT1)пЉМйЂУзїЖиГЮ(CD14, AIF1, CSF1R)пЉМ NK/TзїЖиГЮ(CD2, CD3E, CD3D, GZMA, GNLY, NKG7)пЉМ BжЈЛеЈізїЖиГЮ(CD19, CD79A, MS4A1)еТМзЩМзЧЗзЫЄеЕ≥жИРзЇ§зїізїЖиГЮ(cas) (PDPN, DCN, THY1)(еЫЊ1C, D)гАВдЄОеЕИеЙНHGSOCеНХзїЖиГЮжµЛеЇПжК•еСКзЫЄдЉЉпЉМдЄКзЪЃзЩМзїЖиГЮжШѓиВњзШ§зїДзїЗдЄ≠жЬАдЄ∞еѓМзЪДзїЖиГЮжИРеИЖпЉМеЕґжђ°жШѓйЂУзїЖиГЮгАВдЄОдї•еЊАзЪДз†Фз©ґзЫЄеПНпЉМеЕНзЦЂзїЖиГЮеЬ®иЕєж∞ідЄ≠еН†дЄїеѓЉеЬ∞дљНпЉМдљЖеЬ®дљЬиАЕзЪДз†Фз©ґдЄ≠еЊИе∞СеЬ®иВњзШ§дЄ≠еПСзО∞гАВCAFsеЬ®иВњзШ§зїДзїЗеТМиЕєж∞ідЄ≠еЭЗеСИз®АзЦПеИЖеЄГ(еЫЊ1E)гАВж≠§е§ЦпЉМдЄОиЕєж∞ізЫЄжѓФпЉМиВњзШ§дЄ≠зЪДTзїЖиГЮиЊГе∞С(еЫЊ1E)гАВеЫ†ж≠§пЉМињЩдЇЫеПСзО∞жПРз§ЇдЄКзЪЃзїЖиГЮеТМеЕНзЦЂзїЖиГЮеЬ®е§НеПСдЄ≠зЪДжљЬеЬ®дљЬзФ®гАВ
еЫЊ1
02 е§НеПСжАІзЧЕеПШжИЦиЕєж∞ідЄКзЪЃиВњзШ§зїЖиГЮзЪДеКЯиГљеТМзФЯзЙ©е≠¶зЙєеЊБ
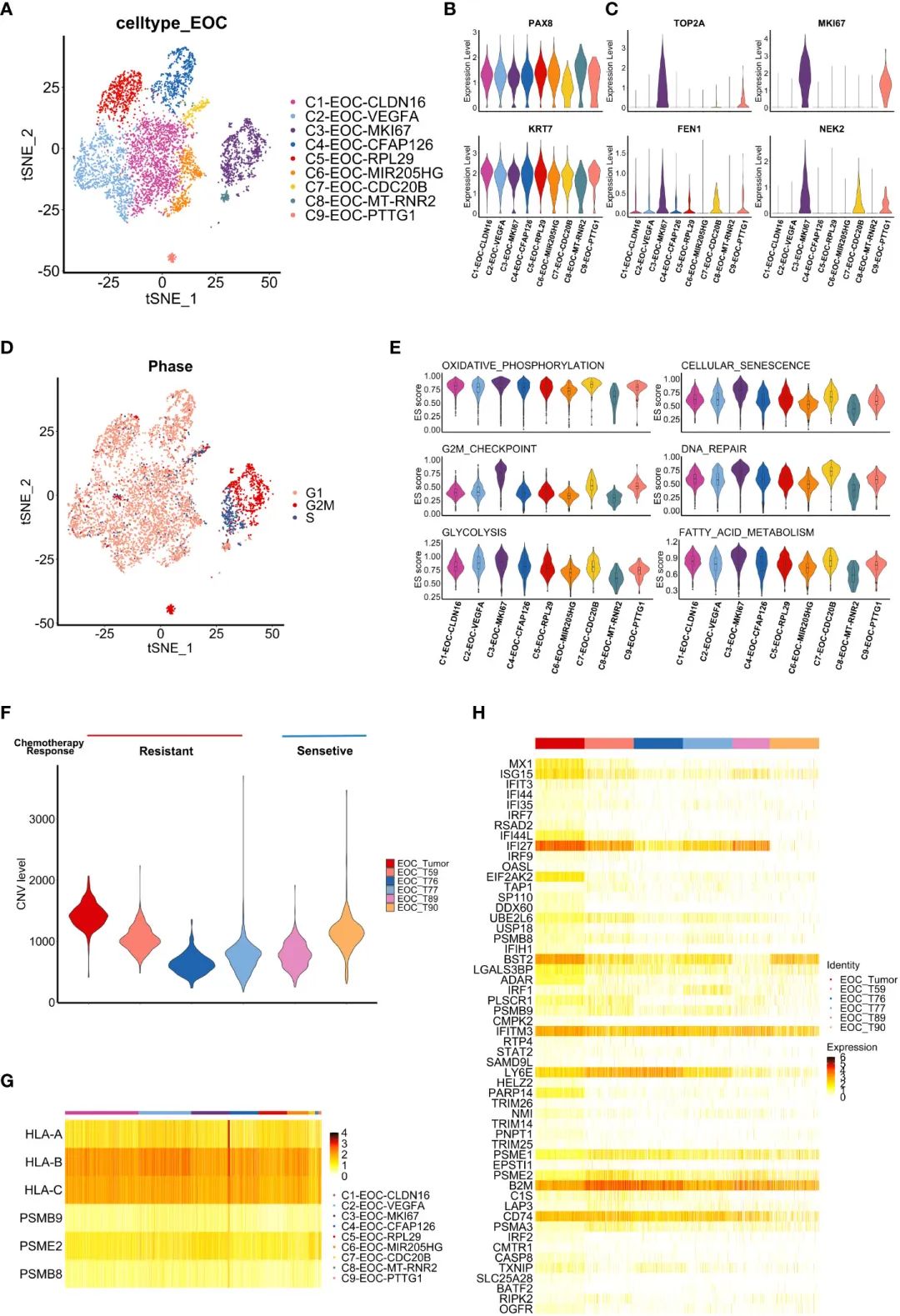
жО•дЄЛжЭ•пЉМдљЬиАЕеИЖжЮРдЇЖе§НеПСзЪДе≠§зЂЛжАІиВњзШ§еТМиЕєж∞ідЄ≠зЩМзїЖиГЮзЪДеЫЇжЬЙзЙєеЊБгАВеПСзО∞дЇЖ9дЄ™дЄКзЪЃжБґжАІзїЖиГЮз∞З(еЫЊ2A)гАВиЊУеНµзЃ°дЄКзЪЃ(FTE)ж†ЗењЧзЙ©PAX8еТМKRT7еЬ®жЙАжЬЙдЇЪзЊ§дЄ≠еЭЗињЗи°®иЊЊпЉМжПРз§ЇиВњзШ§еПѓиГљиµЈжЇРдЇОFTE(еЫЊ2B)гАВж≠§е§ЦпЉМC3-EOC-MKI67 (EC3)дЇЪзЊ§жШЊз§ЇеЗЇжЫійЂШзЪДеМЦзЦЧиАРиНѓзЫЄеЕ≥еЯЇеЫ†(FEN1гАБNEK2гАБTOP2AеТМMKI67)зЪДи°®иЊЊ(еЫЊ2C)гАВеИ©зФ®SeuratзЪДCellCycleScoringеКЯиГљпЉМз°ЃеЃЪEC3дЇЪзЊ§зїЖиГЮдЄїи¶Бе§ДдЇОSжЬЯеТМG2/MжЬЯпЉМи°®жШОеЃГдїђеЕЈжЬЙйЂШеҐЮжЃЦзКґжАБ(еЫЊ2D)гАВEC3еЬ®ж∞ІеМЦз£ЈйЕЄеМЦгАБзїЖиГЮи°∞иАБгАБG2/Mж£АжЯ•зВєгАБDNAдњЃе§НйАФеЊДгАБз≥ЦйЕµиІ£еТМиДВиВ™йЕЄдї£и∞Ґз≠ЙеЗ†дЄ™йАФеЊДдЄ≠пЉМзІНзЊ§и°®зО∞еЗЇзЫЄеѓєиЊГйЂШзЪДеѓМйЫЖ(еЫЊ2E)гАВињЩдЇЫзїУжЮЬжПРз§ЇпЉМEC3зїЖиГЮзЪДеҐЮжЃЦгАБйЂШдї£и∞ҐеТМиАРиНѓзЙєжАІеПѓиГљдЄОеНµеЈҐзЩМзЪДињЫе±ХеТМе§НеПСжЬЙеЕ≥гАВ
CNVеИЖжЮРзїУжЮЬжШЊз§ЇпЉМдљЬиАЕзЪДж†ЈжЬђ(EOC_Tumor) CNVж∞іеє≥еНЗйЂШ(еЫЊ2F)гАВж≠§е§ЦпЉМдљЬиАЕињШжОҐиЃ®EC3з∞ЗжШѓеР¶жШѓеМЦзЦЧиАРиНѓиВњзШ§зЪДзЙєеЊБжАІз∞ЗгАВжАїдєЛпЉМињЩдЇЫзїУжЮЬжПРз§ЇMKI67йШ≥жАІзЪДзЩМзїЖиГЮеПѓиГљжЬЙеК©дЇОHGSOCзЪДеМЦзЦЧиАРиНѓгАВ
жО•дЄЛжЭ•пЉМдљЬиАЕиѓДдЉ∞дЇЖзЩМзїЖиГЮдЄ≠жКЧеОЯеСИйАТзЫЄеЕ≥еЯЇеЫ†зЪДи°®иЊЊгАВдЄОдєЛеЙНзЪДжК•йБУзЫЄдЉЉпЉМHLA-BеТМHLA-CеЬ®дЇЪз∞ЗдЄ≠жЩЃйБНи°®иЊЊжШОжШЊ(еЫЊ2G)гАВж≠§е§ЦпЉМеє≤жЙ∞зі†(IFN)йАЪиЈѓзЫЄеЕ≥еЯЇеЫ†еЬ®е§Іе§ЪжХ∞иВњзШ§зїЖиГЮдЇЪз∞ЗдЄ≠еЭЗеМАеѓМйЫЖгАВдї£и°®IFNйАЪиЈѓж†ЄењГеЯЇеЫ†зЪДIFNеЇФз≠ФзЫЄеЕ≥еЯЇеЫ†(е¶ВIFI27гАБIFITM3гАБLY6E)еЬ®иВњзШ§зїЖиГЮдЄ≠жШЊиСЧеНЗйЂШ( и°•еЕЕеЫЊS1HгАВдЄЇдЇЖй™МиѓБжИСдїђзЪДеПСзО∞,дљЬиАЕеЬ®GEOжХ∞жНЃеЇУ(GSE154600)дЄ≠еѓєињЩдЇЫеЯЇеЫ†зЪДи°®иЊЊињЫи°МдЇЖи°®еЊБпЉМеєґиОЈеЊЧдЇЖзЫЄдЉЉзЪДи°®иЊЊи∞±(еЫЊ2H)гАВдЄЇдЇЖињЫдЄАж≠•йҐДжµЛIFNзЫЄеЕ≥еЯЇеЫ†еЬ®HGSOCдЄ≠зЪДжљЬеЬ®еКЯиГљпЉМдљЬиАЕдљњзФ®OV-TCGAжХ∞жНЃйЫЖињЫи°МдЇЖеЯЇдЇОињЩдЇЫеЯЇеЫ†зЪДзФЯе≠ШеИЖжЮРпЉМзїУжЮЬи°®жШОIFNзЫЄеЕ≥еЯЇеЫ†зЪДйЂШи°®иЊЊдЄОжЫіе•љзЪДйҐДеРОзЫЄеЕ≥(log-rankж≥ХпЉМP= 0.039 и°•еЕЕеЫЊSI)гАВеЫ†ж≠§пЉМIFNи°®иЊЊи∞±(еЫЊ2H)зЪДеѓМйЫЖеПѓиГљжПРз§Їиѓ•жВ£иАЕеЕНзЦЂеЇФз≠ФиЊГеЉЇпЉМйҐДеРОиЊГе•љгАВзДґиАМпЉМиѓ•жВ£иАЕзЪДPFS3йАРжЄРзЉ©зЯ≠пЉМйЬАи¶БињЫдЄАж≠•з†Фз©ґиВњзШ§еЕНзЦЂеЊЃзОѓеҐГ(TIME)гАВ
еЫЊ2
03 й™®йЂУзїЖиГЮеЬ®TIMEдЄ≠зЪДзїДжИРеТМдљЬзФ®зЪДиІ£еЙЦ
дЄЇдЇЖжЫіе•љеЬ∞йШРжШОTIMEпЉМдљЬиАЕеИЖжЮРдЇЖзђђеЫЫзЦЧз®ЛеМЦзЦЧеЙНжФґйЫЖзЪДж†ЈжЬђдЄ≠зЪД17301дЄ™еЕНзЦЂзїЖиГЮпЉМеЕґдЄ≠910дЄ™жЭ•иЗ™иВњзШ§зїЖиГЮпЉМ5949дЄ™жЭ•иЗ™иЕєж∞ізїЖиГЮпЉМ10442дЄ™жЭ•иЗ™pbmcзїЖиГЮгАВж†єжНЃеЕИеЙНи°®еЊБзЪДж†ЗиЃ∞зЙ©йЙіеЃЪеЗЇеЫЫзІНдЄїи¶БзЪДзїЖиГЮз±їеЮЛпЉМеМЕжЛђTзїЖиГЮ(CD3D, CD3G, CD2)пЉМ NKзїЖиГЮ(NKG7, GNLY, KLRD1, KLRF1)пЉМ BзїЖиГЮ(MS4A1, CD19, CD79A, CD79B)еТМй™®йЂУзїЖиГЮ(CD14, AIF1, CSF1R)(и°•еЕЕеЫЊS2A-C)гАВTзїЖиГЮеТМй™®йЂУзїЖиГЮжШѓиЕєж∞іеТМиВњзШ§дЄ≠еН†дЉШеКњзЪДеЕНзЦЂзїЖиГЮ(и°•еЕЕеЫЊ S2D)пЉМињЩдЄОеЕґдїЦз†Фз©ґдЄАиЗігАВ
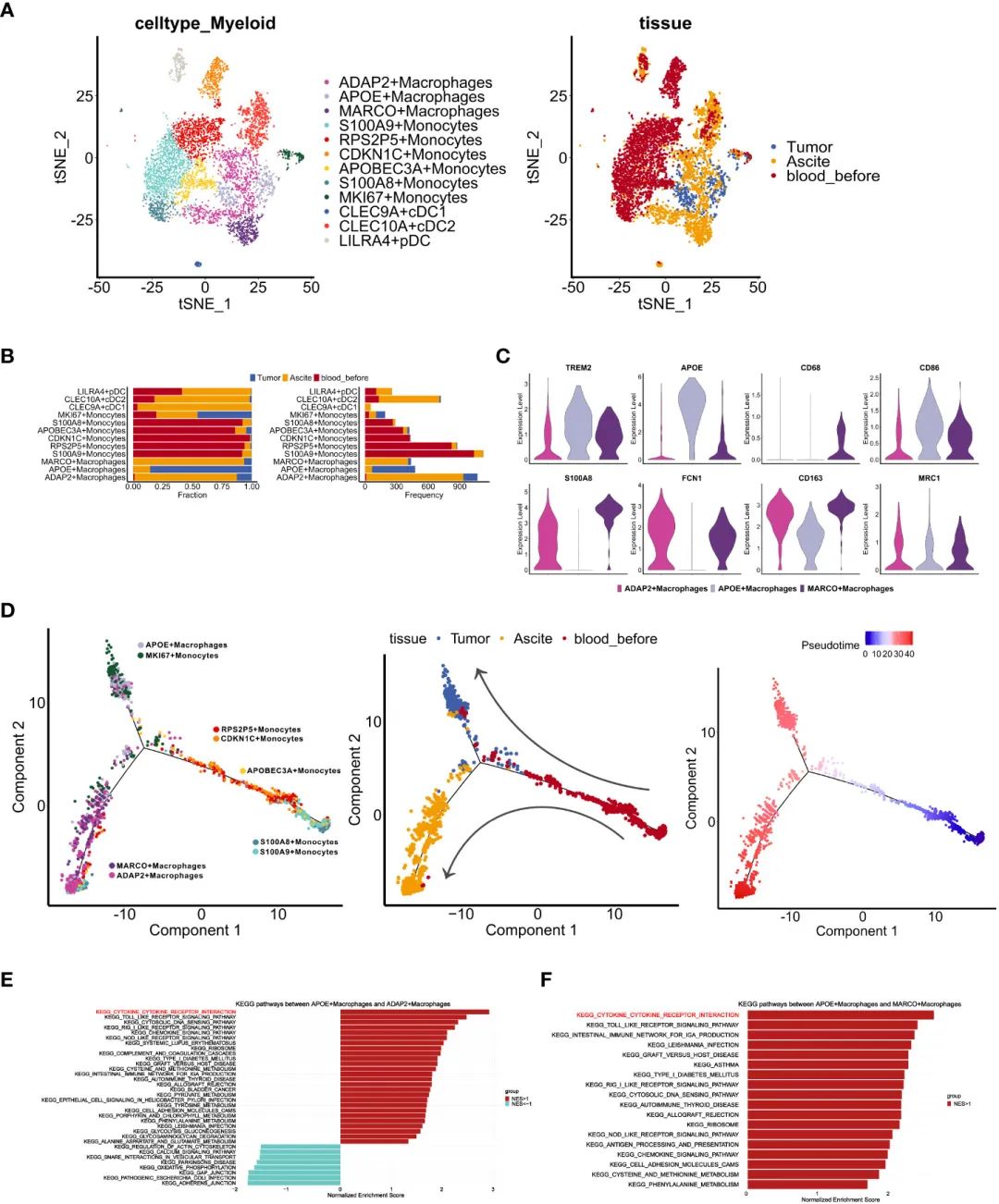
жО•дЄЛжЭ•пЉМдљЬиАЕеѓєй™®йЂУзїЖиГЮињЫи°МиБЪз±їеИЖжЮРпЉМеПСзО∞дЇЖ12дЄ™з∞З(еЫЊ3A)гАВеАЉеЊЧж≥®жДПзЪДжШѓпЉМMKI67еНХж†ЄзїЖиГЮеТМAPOEеЈ®еЩђзїЖиГЮдЄїи¶БжЭ•иЗ™иВњзШ§пЉМиАМADAP2еТМMARCOеЈ®еЩђзїЖиГЮдЄїи¶БжЭ•иЗ™иЕєж∞і(еЫЊ3B)гАВдљњзФ®еЕИеЙНжК•еСКдЄ≠йЙіеЃЪзЪДж†ЗиЃ∞зЙ©пЉМдљЬиАЕеПСзО∞APOEеЈ®еЩђзїЖиГЮи°®зО∞еЗЇTAMж†ЈзЙєеЊБ(TREM2, APOE)пЉМиАМADAP2еЈ®еЩђзїЖиГЮйЂШеЇ¶и°®иЊЊMDSCж†ЈзЙєеЊБ(S100A8, FCN1)(еЫЊ3C)гАВж≠§е§ЦпЉМињЩдЄ§дЄ™йЫЖзЊ§жШЊз§ЇйЂШи°®иЊЊM2ж†ЈзЙєеЊБ(CD163, MRC1)пЉМиАМиЕєж∞іжЭ•жЇРзЪДMARCOеЈ®еЩђзїЖиГЮйЂШи°®иЊЊеЕЈжЬЙM1- (CD68, CD86)еТМM2ж†ЈзЙєеЊБзЪДMDSCж†ЈзЙєеЊБ(еЫЊ3C)гАВжО•дЄЛжЭ•пЉМдљЬиАЕйАЪињЗдЉ™жЧґйЧіеИЖжЮРжΥ糥дЇЖжЭ•иЗ™дЄНеРМйГ®дљНзЪДй™®йЂУзїЖиГЮзЪДиљ®ињєгАВйЩ§дЇЖMKI67еНХж†ЄзїЖиГЮе§ЦпЉМPBMCжЭ•жЇРзЪДеНХж†ЄзїЖиГЮеИЖдЄЇиЕєж∞іеЄЄй©їеЈ®еЩђзїЖиГЮзЊ§(ADAP2еТМMARCOеЈ®еЩђзїЖиГЮ)еТМиВњзШ§еЄЄй©їеЈ®еЩђзїЖиГЮзЊ§(MKI67еНХж†ЄзїЖиГЮеТМAPOEеЈ®еЩђзїЖиГЮ)(еЫЊ3D)пЉМињЩи°®жШОе§ЦеС®еНХж†ЄзїЖиГЮеПѓиГљињБзІїеИ∞иЕєж∞іеТМиВњзШ§пЉМеєґеЬ®TIMEдЄ≠襀жХЩиВ≤дЄЇдЄНеРМзЪДдЇЪеЮЛгАВ
дЄЇдЇЖжППињ∞еЈ®еЩђзїЖиГЮеЬ®иЕєж∞іеТМиВњзШ§дЄ≠зЪДдЄНеРМеКЯиГљпЉМжИСдїђжѓФиЊГдЇЖдЄНеРМдЇЪзЊ§дЄ≠еѓМйЫЖзЪДKEGGйАЪиЈѓгАВдЄОAPOEз∞ЗзЫЄжѓФпЉМADAP2еТМMARCOз∞ЗеЭЗи°®зО∞еЗЇиЊГдљОзЪДзїЖиГЮеЫ†е≠РеПЧдљУзЫЄдЇТдљЬзФ®еѓМйЫЖ(еЫЊ3E, F)пЉМи°®жШОиЕєж∞ідЄ≠еЈ®еЩђзїЖиГЮзЪДжіїеМЦеТМзїЖиГЮжѓТжАІеПЧжНЯгАВ
еЫЊ3
04 ќ≥ќіTзїЖиГЮзЪДжКСеИґзКґжАБжЬЙеК©дЇОиЕєж∞ізЪДеЕНзЦЂжКСеИґзОѓеҐГ
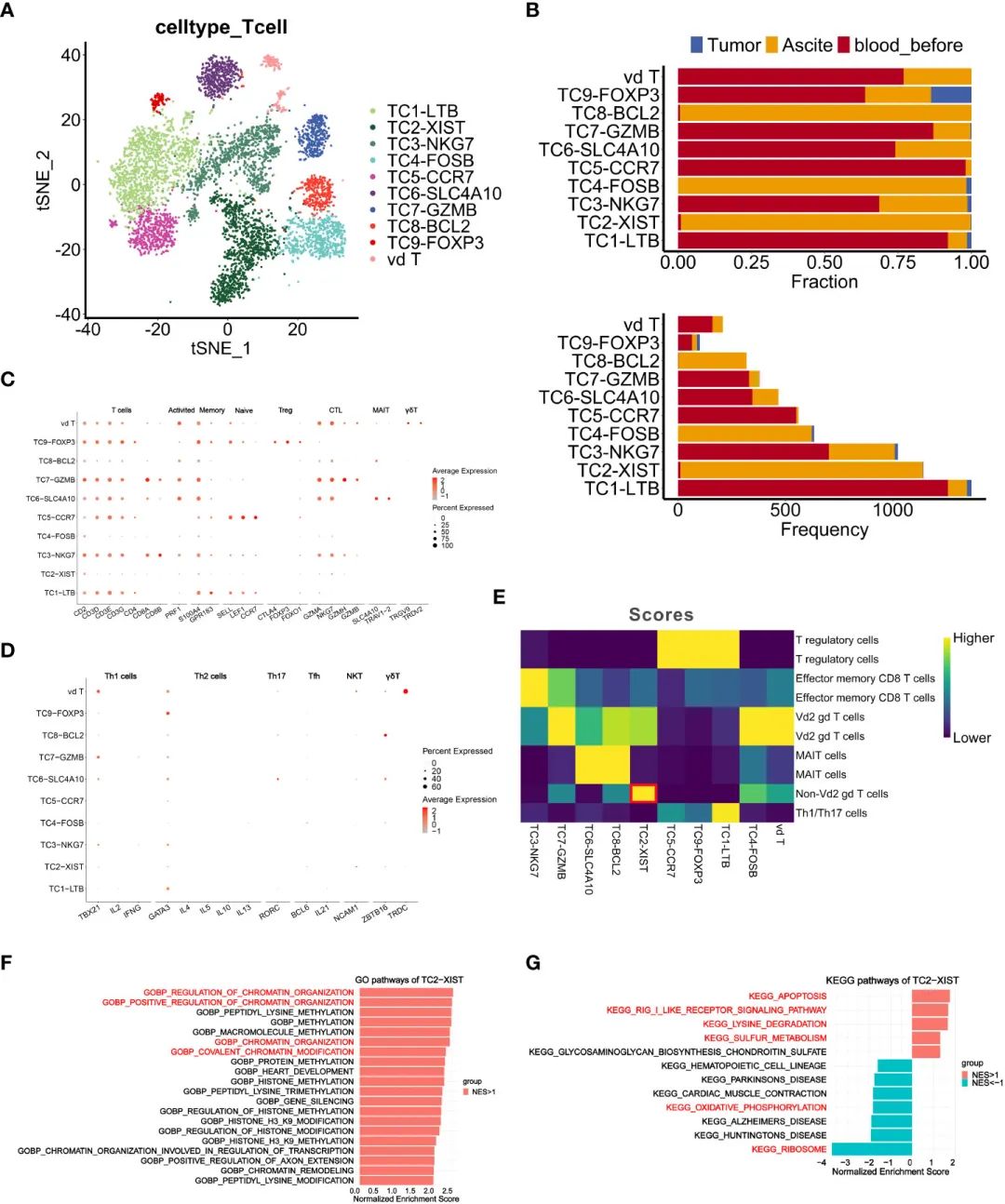
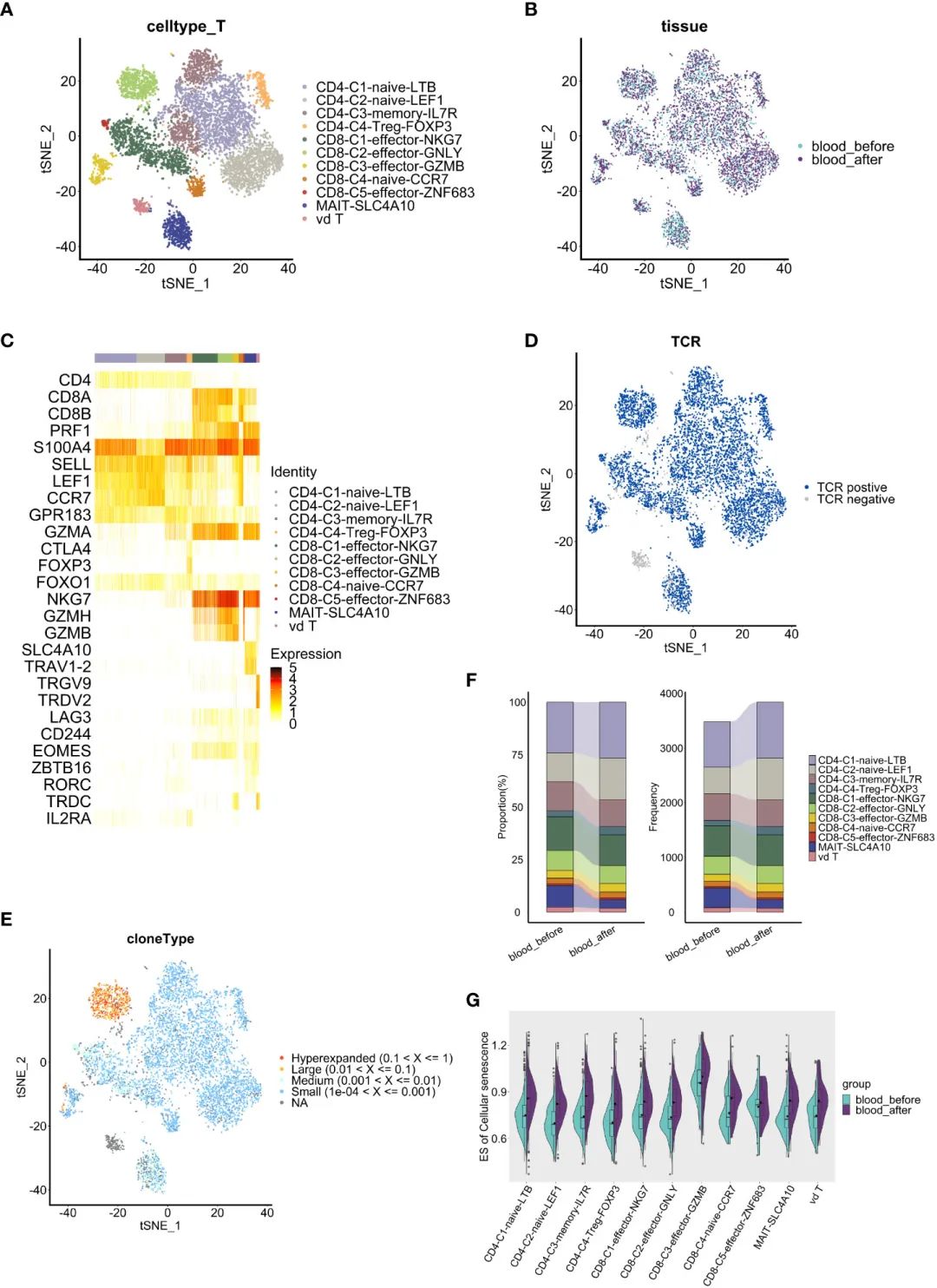
дЄЇдЇЖйШРжШОTзїЖиГЮеЬ®TMEдЄ≠зЪДдљЬзФ®пЉМжИСдїђж†єжНЃиВњзШ§гАБиЕєж∞іеТМPBMCsзїЖиГЮи°®йЭҐж†ЗењЧзЙ©зЪДи°®иЊЊеѓєTзїЖиГЮињЫи°МдЇЖиБЪз±ї(еЫЊ4AгАБB)гАВ7дЄ™TзїЖиГЮз∞ЗзЪДзЙєеЊБе¶ВдЄЛ:жіїеМЦTзїЖиГЮ(PRF1)гАБиЃ∞ењЖTзїЖиГЮ(S100A4гАБGPR183)гАБna√ѓve TзїЖиГЮ(SELLгАБLEF1гАБCCR7)гАБTregsзїЖиГЮ(CTLA4гАБFOXP3гАБFOXO1)гАБзїЖиГЮжѓТжАІTжЈЛеЈізїЖиГЮ(CTL) (GZMAгАБNKG7гАБGZMHгАБGZMB)гАБз≤ШиЖЬзЫЄеЕ≥дЄНеПШTзїЖиГЮ(MAIT) (SLC4A10гАБTRAV1-2)еТМќ≥ќіTзїЖиГЮ(TRGV9гАБTRDV2)(еЫЊ4C)гАВTC2-XIST (TC2)гАБTC4-FOSB (TC4)еТМTC8- bcl2 (TC8)з∞ЗдЄїи¶БжЭ•жЇРдЇОиЕєж∞іпЉМеЕґдїЦз∞ЗдЄїи¶БжЭ•жЇРдЇОPBMCs(еЫЊ4B)гАВеАЉеЊЧж≥®жДПзЪДжШѓпЉМTC2еТМTC4йЫЖзЊ§зЪДзЙєзВєжШѓTзїЖиГЮж†ЗењЧзЙ©дљОи°®иЊЊ(еЫЊ4C, D)пЉМе¶ВRORC, TRDCеТМZBTB16гАВ
зФ±дЇОќ≥ќіTзїЖиГЮеЕЈжЬЙCD4еТМCD8иіЯи°®иЊЊзЪДзЙєеЊБпЉМдљЬиАЕдљњзФ®RеМЕSingleRе∞ЖTC4ж≥®йЗКдЄЇVd2 ќ≥ќіTзїЖиГЮпЉМе∞ЖTC2ж≥®йЗКдЄЇйЭЮVd2 ќ≥ќіTзїЖиГЮ(еЫЊ4E)пЉМжПРз§ЇTC2еПѓиГљдї£и°®дЄАдЄ™жЦ∞зЪДTзїЖиГЮдЇЪзЊ§гАВж≠§е§ЦпЉМеѓєTC2з∞ЗзЪДеЯЇеЫ†йЫЖеѓМйЫЖеИЖжЮРжШЊз§ЇпЉМжЯУиЙ≤иі®зїДзїЗи∞ГжОІеЯЇеЫ†жШЊиСЧеѓМйЫЖпЉМдїОиАМжЪЧз§ЇеЕґеܮ嚥жИРиЕєж∞ідЄ≠TзїЖиГЮеЕНзЦЂзЊ§иРљдЄ≠зЪДжљЬеЬ®дљЬзФ®(еЫЊ4F)гАВжЬЙиґ£зЪДжШѓпЉМTC2з∞ЗдЄ≠жШЊиСЧеѓМйЫЖзЪДйАФеЊДеМЕжЛђеЗЛдЇ°гАБRIG-I-ж†ЈеПЧдљУдњ°еПЈдЉ†еѓЉгАБиµЦж∞®йЕЄйЩНиІ£еТМз°Ђдї£и∞ҐйАФеЊДпЉМиАМж†Єз≥ЦдљУеТМж∞ІеМЦз£ЈйЕЄеМЦ(OXPHOS)йАФеЊДеИЩеСИзО∞дљОж∞іеє≥еѓМйЫЖ(еЫЊ4G)гАВйЙідЇОOXPHOSйАЪиЈѓжШѓTIMEеЖЕTзїЖиГЮзЪДзЙєеЊБжАІдї£и∞Ґи°®еЮЛпЉМеЕґдљОж∞іеє≥еѓМйЫЖпЉМдЄОеЗЛдЇ°йАЪиЈѓзЪДйЂШеѓМйЫЖеТМж†Єз≥ЦдљУеКЯиГљйАЪиЈѓзЪДдљОеѓМйЫЖдЄАиµЈпЉМи°®жШОTC2зЪДеЕНзЦЂеКЯиГљеЗПеЉ±гАВ
еЫЊ4
05 еМЦзЦЧиѓ±еѓЉPBMCи°НзФЯTзїЖиГЮи°∞иАБеПКTCRеЕЛйЪЖжЙ©еҐЮ
еЬ®е§ЦеС®и°АжЇРжАІTзїЖиГЮдЄ≠пЉМдљЬиАЕж†єжНЃеЕЄеЮЛж†ЗиЃ∞з°ЃеЃЪдЇЖ11дЄ™дЇЪзЊ§(еЫЊ5A-C)гАВCD4+зїЖиГЮеМЕжЛђиЃ∞ењЖжАІCD4+ TзїЖиГЮ(S100A4+GPR183+)гАБи∞ГиКВжАІCD4+ TзїЖиГЮ(Treg) (FOXP3+IL2RA+)еТМи∞ГиКВжАІCD4+ TзїЖиГЮ(CCR7+SELL+) (CD4-C1-na√ѓve-LTBеТМCD4-C2-na√ѓve-LEF1зїДжИР)гАВCD8+ TзїЖиГЮзЪД5дЄ™дЇЪзЊ§пЉМеМЕжЛђna√ѓve CD8+TзїЖиГЮ(CCR7+ SELL+)еТМ4дЄ™CD8+ TзїЖиГЮжХИеЇФдЇЪзЊ§(CD8-c1-effector-NKG7гАБCD8-c2-effector-GNLYгАБCD8-c3-effector-GMZBеТМCD8-c5-effector-ZNF683)и°®иЊЊйЂШж∞іеє≥зЪДGZMAеТМNKG7гАВж≠§е§ЦпЉМдљЬиАЕињШеЃЪдєЙдЇЖдЄАдЄ™MAITе≠РйЫЖ(SLC4A10+TRAV1-2+)еТМдЄАдЄ™ќ≥ќіTе≠РйЫЖ(TRGV9+TRDV2+)гАВеЬ®жЙАжЬЙCD8+ TзїЖиГЮдЄ≠еЭЗж£АжµЛеИ∞иАЧзЂ≠ж†ЗењЧзЙ©LAG3гАБCD244еТМEOMESзЪДи°®иЊЊ(еЫЊ5C)пЉМеЕґдЄ≠CD8+-c2-effector-GNLYзїДTCRеЕЛйЪЖжЙ©еҐЮжЬАдЄЇеєњж≥Ы(еЫЊ5DгАБE)гАВ
ињЫдЄАж≠•ињЫи°МеМЦзЦЧеЙНеРОзїЖиГЮжѓФдЊЛеИЖжЮРгАВеЬ®CD8+ TзїЖиГЮдЄ≠пЉМеМЦзЦЧеРОC3-effector-GZMB (4.1% vs 3.7%)еТМc5-effector-znf683 (0.8% vs 0.7%)зЊ§дљУеҐЮеК†пЉМc1-effector- NKG7 (14.7% vs 16.0%)еТМc2-effector-GNLY (8.4% vs 9.4%)зЊ§дљУеЗПе∞С(еЫЊ5F)гАВйЗНи¶БзЪДжШѓпЉМCD8+ GZMB TзїЖиГЮеТМCD8+ ZNF683 TзїЖиГЮ襀聧䪯жШѓиАЧе∞љжИЦиАЧе∞љж†ЈзїЖиГЮпЉМе∞љзЃ°еЃГдїђеЕЈжЬЙзїЖиГЮжѓТжАІеКЯиГљ)гАВеЫ†ж≠§пЉМCD8+ TзїЖиГЮдЇЪзЊ§дЄ≠зїЖиГЮжѓФдЊЛзЪДеПШеМЦи°®жШОеЕґиґЛеРСдЇОи°∞зЂ≠зКґжАБпЉМињЩеПѓиГљеПНжШ†дЇЖеМЦзЦЧзЪДзіѓзІѓжХИеЇФгАВ
жО•дЄЛжЭ•пЉМдЄЇдЇЖз†Фз©ґеМЦзЦЧжШѓеР¶дЉЪдњГињЫTзїЖиГЮи°∞иАБпЉМдљЬиАЕйЗЗзФ®GSVAжЦєж≥ХжѓФиЊГдЇЖpbmcи°НзФЯзЪДTзїЖиГЮз∞ЗдЄ≠зїЖиГЮи°∞иАБеЯЇеЫ†йЫЖ(жЭ•иЗ™KEGG, hsa04218)зЪДеѓМйЫЖж∞іеє≥гАВTзїЖиГЮи°∞иАБзЪДзЙєеЊБжШѓеКЯиÚ姱и∞ГеТМзїИжЬЂеИЖеМЦзїЖиГЮзЪДзІѓзіѓпЉМеЬ®CD8 -c3-effector-GMZB TзїЖиГЮз∞ЗдЄ≠пЉМи°∞иАБзЫЄеЕ≥еЯЇеЫ†зїДжШЊиСЧеѓМйЫЖ(еЫЊ5G)гАВ
еАЉеЊЧж≥®жДПзЪДжШѓпЉМеМЕжЛђCD8-C3-Effector-GZMBеЬ®еЖЕзЪДжЙАжЬЙTзїЖиГЮз∞ЗеЬ®еМЦзЦЧеРОйГљиОЈеЊЧдЇЖжЫійЂШзЪДзїЖиГЮи°∞иАБзЫЄеЕ≥еЯЇеЫ†зЪДеѓМйЫЖпЉМињЩеЉЇзГИжЪЧз§ЇеМЦзЦЧдњГињЫеєґеК†йАЯдЇЖTзїЖиГЮзЪДи°∞иАБ(еЫЊ5G)гАВеЫ†ж≠§пЉМдљЬиАЕзЪДз†Фз©ґзїУжЮЬи°®жШОпЉМеМЦзЦЧиѓ±еѓЉдЇЖи°∞иАБж†ЈTзїЖиГЮпЉМеМЕжЛђCD8-C3-Effector-GZMB TзїЖиГЮпЉМињЩеПѓиГљжШѓHGSOCдЄ≠еЕЈжЬЙиАЧе∞љи°®еЮЛзЪДеКЯиÚ姱и∞ГдЇЪзЊ§гАВ
еЫЊ5
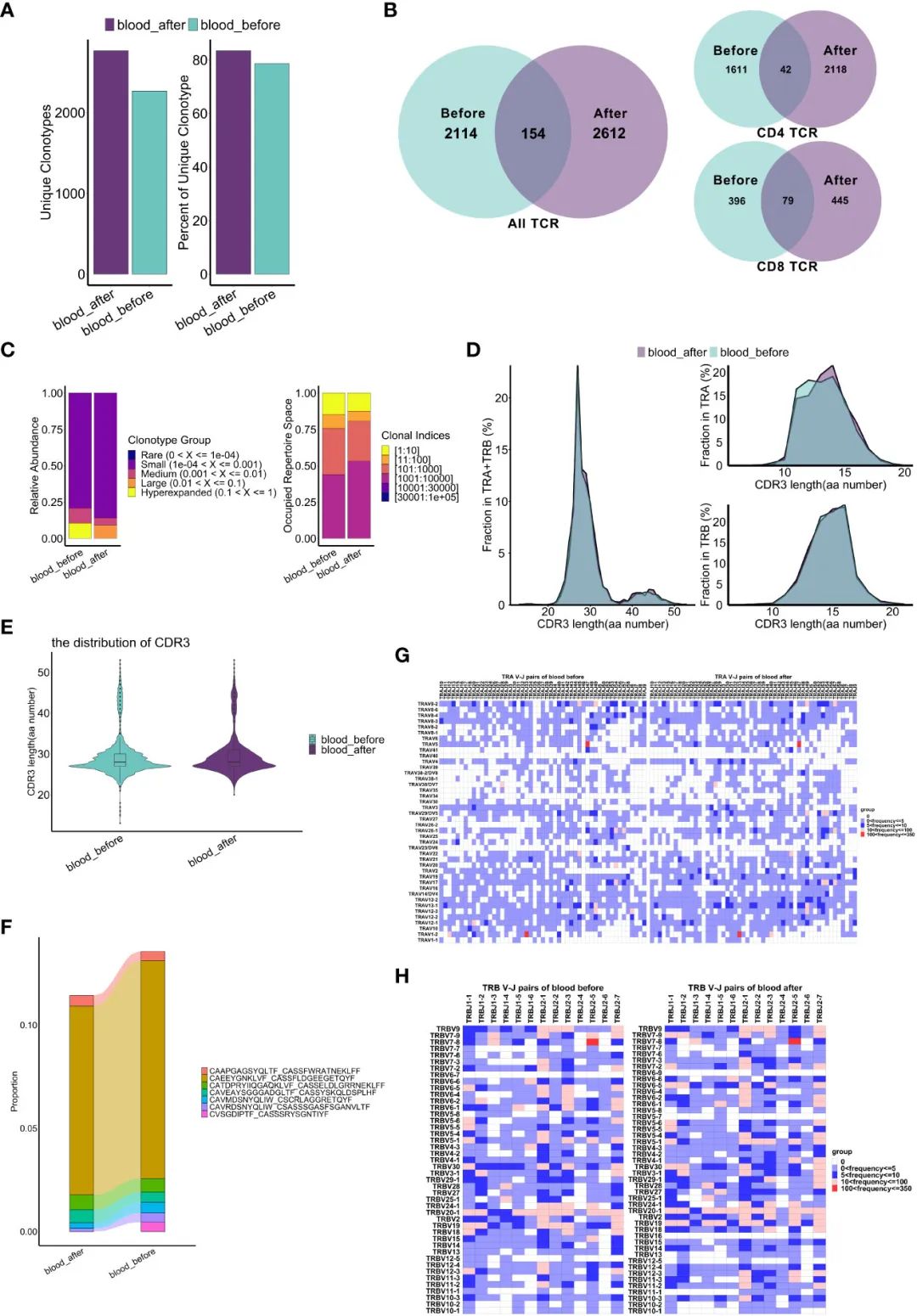
еМЦзЦЧжШѓеР¶дЉЪеЉХиµЈTCRеЕЛйЪЖжЙ©еҐЮзЪДжФєеПШе∞ЪдЄНжЄЕж•ЪгАВеЫ†ж≠§пЉМдљЬиАЕеИЖжЮРдЇЖеМЦзЦЧжЬЯйЧіTCRеЇУзЪДеК®жАБгАВеАЉеЊЧж≥®жДПзЪДжШѓпЉМињШдљЬиАЕиІВеѓЯеИ∞еМЦзЦЧеРОзЛђзЙєTзїЖиГЮеЕЛйЪЖеЮЛзЪДжХ∞йЗПеТМжѓФдЊЛеҐЮеК†пЉМеН†жЙАжЬЙеЕЛйЪЖеЮЛзЪД70%дї•дЄК(еЫЊ6A)гАВеМЦзЦЧеЙНеРОеЕ±жЬЙ154зІНдЄНеРМзЪДеЕЛйЪЖеЮЛ(еЫЊ6B)гАВињЩдЇЫжХ∞жНЃеЉЇзГИи°®жШОеМЦзЦЧжФєеПШдЇЖTCRеЕЛйЪЖжЙ©еҐЮгАВжЬЙиґ£зЪДжШѓпЉМдЄОCD8+ TзїЖиГЮзЫЄжѓФпЉМCD4+ TзїЖиГЮзЪДе§Ъж†ЈжАІжМЗжХ∞(Shannon, Simpson, ChaoеТМACEжМЗжХ∞)жЫійЂШгАВCD4+ TзїЖиГЮз∞ЗеЖЕеЕЛйЪЖйЗНеП†дЄНжШОжШЊпЉМиАМCD8+TзїЖиГЮз∞ЗеЖЕе≠ШеЬ®иЊГеЉЇзЪДйЗНеП†пЉМзЙєеИЂжШѓCD8-c1-effectorNKG7еТМCD8-c2-effector-GNLYзїЖиГЮдєЛйЧі(и°•еЕЕеЫЊS7E, F)гАВж≠§е§ЦпЉМйЂШжЙ©еҐЮзЪДеЕЛйЪЖеЮЛзЫЄеѓєдЄ∞еЇ¶дЄЛйЩНпЉМдљОеЕЛйЪЖжМЗжХ∞зЪДеЕЛйЪЖеЮЛеЬ®еМЦзЦЧеРОеН†жНЃжЫіе§ЪзЪДеЇУз©ЇйЧі(еЫЊ6CеТМи°•еЕЕеЫЊS7BгАБD)пЉМжПРз§ЇTCRеЕЛйЪЖжЙ©еҐЮзЪДеПШеМЦеПѓиГљдЄОдљОеЕЛйЪЖжМЗжХ∞зЪДеЕЛйЪЖеЮЛжЬЙеЕ≥гАВеЫ†ж≠§пЉМеМЦзЦЧдЉЉдєОиѓ±еѓЉдЇЖжЙАжЬЙTзїЖиГЮзЪДTCRеЕЛйЪЖжЙ©еҐЮпЉМеєґдЄФеѓєCD4+ TCRзЪДељ±еУНжЫідЄЇжШОжШЊгАВ
зФ±дЇОдЇТи°•еЖ≥еЃЪеМЇ3 (CDR3)жШѓзЫіжО•дЄОжКЧеОЯжО•иІ¶зЪДTCRеМЇеЯЯпЉМеЫ†ж≠§еЬ®TCRдЄОиВљMHCе§НеРИзЙ©дєЛйЧізЪДзЫЄдЇТдљЬзФ®дЄ≠иµЈзЭАйЗНи¶БдљЬзФ®пЉМжИСдїђжО•дЄЛжЭ•з†Фз©ґдЇЖеМЦзЦЧжШѓеР¶жФєеПШдЇЖдЄНеРМеЕЛйЪЖеЮЛдЄ≠ќ±/ќ≤йУЊеЖЕCDR3зЪДеИЖеЄГгАВеМЦзЦЧеЙНеРОCDR3 ќ±/ќ≤йУЊж∞®еЯЇйЕЄ(aa)йХњеЇ¶еИЖеЄГеЯЇжЬђдЄАиЗіпЉМ27aaжШѓжЬАеЄЄиІБзЪДйХњеЇ¶(еЫЊ6D, E)гАВдЉШеКњCDR3еЇПеИЧзЪДеЕЛйЪЖеЮЛеЗПе∞СпЉМеМЦзЦЧеРОCVSGDIPTF_CASSSRYSGNTIYFеЇПеИЧжґИ姱(еЫЊ6F)гАВV(D)JйЗНжОТжШѓTCR/BCRе§Ъж†ЈжАІзЪДеЯЇз°АпЉМдљњT/BзїЖиГЮеѓєе§ЪзІНжКЧеОЯдЇІзФЯеЕНзЦЂеПНеЇФгАВеЫ†ж≠§пЉМдљЬиАЕињЫдЄАж≠•еИЖжЮРдЇЖеМЦзЦЧеЙНеРОќ±йУЊеТМќ≤йУЊдЄКV-JеѓєзЪДеБПеАЪгАВжЬЙиґ£зЪДжШѓпЉМTRAV5 – TRAJ47гАБTRAV1-2-TRAJ33еТМTRAV17-TRAJ54ињЩдЄЙеѓєдљњзФ®йҐСзОЗжЬАйЂШзЪДќ±йУЊеЬ®еМЦзЦЧеРОдњЭжМБдЄНеПШпЉМиАМеЕґдїЦиЊГе∞СдљњзФ®зЪДќ±йУЊеЬ®еМЦзЦЧеРОеПШеМЦжЫіе§І(еЫЊ6G)гАВеЬ®ќ≤йУЊдЄ≠пЉМTRBV7-8-TRBJ2-5гАБTRBV20-1-TRBJ2-7еТМTRBV20-1TRBJ2-1жШѓеМЦзЦЧеЙНеРОдљњзФ®жЬАе§ЪзЪДдЄЙдЄ™V-JеѓєпЉМиАМеЕґдїЦиЊГе∞СдљњзФ®зЪДV-JеѓєеИЩеПСзФЯдЇЖжШЊиСЧеПШеМЦ(еЫЊ6H)гАВжАїдєЛпЉМеЯЇдЇОеЕЛйЪЖеЮЛеТМCDR3еИЖжЮРпЉМињЩдЇЫеПСзО∞и°®жШОTCRеЇУзЪДеПШеМЦеПѓиГљдЄОдљОйҐСV-JеѓєзЪДдљОжЙ©еҐЮеЕЛйЪЖеЮЛжЬЙеЕ≥гАВ
еЫЊ6
06 еМЦзЦЧиѓ±еѓЉBзїЖиГЮжіїеМЦпЉМжФєеПШBCRеЕЛйЪЖжЙ©еҐЮ
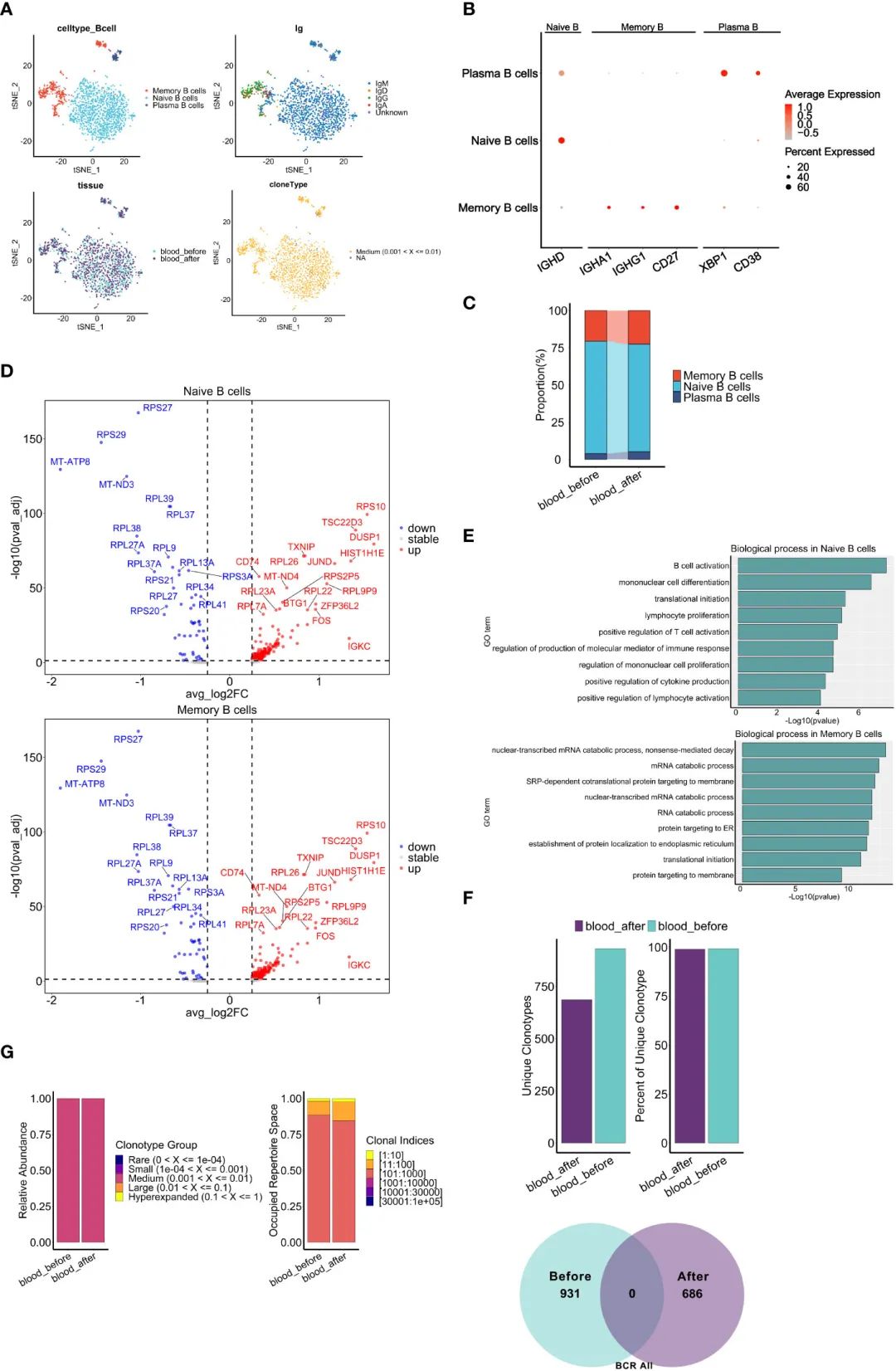
дЄЇдЇЖиѓДдЉ∞еМЦзЦЧеѓєе§ЦеС®и°АBзїЖиГЮи°®еЮЛеТМеКЯиГљзЪДељ±еУНпЉМдљЬиАЕеИЖжЮРдЇЖscRNA-seqеТМscBCR-seqжХ∞жНЃгАВеЕ±иОЈеЊЧ1690дЄ™BзїЖиГЮпЉМеєґдњЭзХЩ1631дЄ™еЕЈжЬЙеЕ®йХњйЂШжХИйЕНеѓєзЪДIGH-IGK/IGLйУЊзЪДзїЖиГЮдЊЫињЫдЄАж≠•еИЖжЮРгАВж†єжНЃеЕЄеЮЛж†ЗиЃ∞зЪДи°®иЊЊпЉМе∞ЖBзїЖиГЮеИЖдЄЇдЄЙдЄ™дЄНеРМзЪДдЇЪзЊ§:na√ѓve BзїЖиГЮ(IGHD)пЉМиЃ∞ењЖBзїЖиГЮ(CD27, IGHA1, IGHG1)еТМжµЖзїЖиГЮ(CD38, XBP1)(еЫЊ7A, B)гАВna√ѓve BзїЖиГЮзФ±IgMгАБIgDгАБIgGеТМIgAеРМеЮЛзїДжИРпЉМеН†е§ЦеС®и°АBзїЖиГЮзЪДе§Іе§ЪжХ∞гАВжЙАжЬЙBзїЖиГЮеЭЗдЄЇдЄ≠дљНжЙ©еҐЮ(еЫЊ7A)гАВеМЦзЦЧеРОжµЖзїЖиГЮ(5.10% vs 3.92%)еТМиЃ∞ењЖBзїЖиГЮ(22.45% vs 20.54%)зЪДзЩЊеИЖжѓФеҐЮеК†пЉМna√ѓve BзїЖиГЮзЪДзЩЊеИЖжѓФдЄЛйЩН(72.45% vs 75.54%)(еЫЊ7C)пЉМжПРз§ЇеМЦзЦЧиѓ±еѓЉзЪДжЦ∞жКЧеОЯеПѓиГљеѓЉиЗіna√ѓve BзїЖиГЮеРСжµЖзїЖиГЮжИЦиЃ∞ењЖBзїЖиГЮеИЖеМЦгАВдЄОNF-kBдњ°еПЈйАЪиЈѓ(CD74)гАБMAPKдњ°еПЈйАЪиЈѓ(FOSгАБDUSP1)зЫЄеЕ≥зЪДеЗ†дЄ™еЕ≥йФЃеЯЇеЫ†еЬ®еМЦзЦЧеРОna√ѓveеТМиЃ∞ењЖзїЖиГЮдЄ≠еЭЗжШЊиСЧдЄКи∞ГпЉМжПРз§ЇеМЦзЦЧеПѓиГљиѓ±еѓЉBзїЖиГЮжіїеМЦгАБеҐЮжЃЦеТМжИРзЖЯ(еЫЊ7D)гАВеИ©зФ®RеМЕClusterprofilerпЉМдљЬиАЕињШеПСзО∞еМЦзЦЧеРОna√ѓve BзїЖиГЮдЄ≠е§ЪзІНзВОзЧЗеПНеЇФйАЪиЈѓжШЊиСЧеѓМйЫЖпЉМиАМиЃ∞ењЖBзїЖиГЮдЄ≠иЫЛзЩљеРИжИРеТМRNAеИЖиІ£дї£и∞ҐйАЪиЈѓеѓМйЫЖ(еЫЊ7E)гАВ
жО•дЄЛжЭ•пЉМдљЬиАЕжОҐиЃ®дЇЖеМЦзЦЧжЬЯйЧіBCRи∞±зЪДеК®жАБеПШеМЦгАВжЬЙиґ£зЪДжШѓпЉМдљЬиАЕињШиІВеѓЯеИ∞еМЦзЦЧеЙНеРОзЛђзЙєеЕЛйЪЖеЮЛзЪДжѓФдЊЛдЄАиЗіпЉМеєґдЄФж≤°жЬЙеЕ±дЇЂзЛђзЙєеЕЛйЪЖеЮЛ(еЫЊ7F)пЉМињЩи°®жШОBCRеЕЛйЪЖжЙ©еҐЮзЪДжШЊиСЧеПШеМЦеПѓиГљдЄїи¶БељТеЫ†дЇОеМЦзЦЧгАВеАЉеЊЧж≥®жДПзЪДжШѓпЉМеЕЛйЪЖеЮЛзЪДзЫЄеѓєдЄ∞еЇ¶еТМзЫЄеЇФеЕЛйЪЖжМЗжХ∞зЪДеН†зФ®з©ЇйЧіж≤°жЬЙжШОжШЊеҐЮеК†(еЫЊ7G)пЉМињЩдЄОTCRеИЖжЮРзЪДзїУжЮЬ(еЫЊ6C)дЄНеРМгАВ
еЫЊ7
зїУиЃЇ
йАЪињЗжХіеРИжЭ•иЗ™йЕНеѓєиЕєж∞ігАБиВњзШ§еТМе§ЦеС®и°Аж†ЈжЬђзЪДеНХзїЖиГЮRNAгАБTCRеТМBCRи∞±зЪДж®™жЦ≠йЭҐеИЖжЮРпЉМдЄЇдЄАдЄ™жЬЙеЗ†дЄ™е§НеПСеС®жЬЯеТМеМЦзЦЧиАРиНѓзЪДHGSOCжВ£иАЕзЪДTMEжПРдЊЫдЇЖйЗНи¶БзЪДиІБиІ£гАВ
жП≠з§ЇдЇЖTCRеТМBCRеЕЛйЪЖжЙ©еҐЮзЪДеПѓеПШеПШеМЦпЉМдЄЇдЇЖиІ£еЃњдЄїжКЧиВњзШ§еЕНзЦЂжЬЇеИґеТМеМЦзЦЧиѓ±еѓЉзЪДеЕНзЦЂйЗН忯商еЃЪдЇЖеЯЇз°АгАВ
дљЬиАЕзЪДз†Фз©ґдєЯдЄЇжЈ±еЕ•жΥ糥е§НеПСйУВиАРиНѓHGSOCзЪДзЩМеПШеТМеЕНзЦЂзОѓеҐГжПРдЊЫдЇЖеПѓиГљпЉМињЩеПѓиГљжЬЙеК©дЇОеЉАеПСжЦ∞зЪДеМЦзЦЧиНѓзЙ©иБФеРИжКЧи°∞иАБиНѓзЙ©пЉМдї•жФєеЦДеНµеЈҐзЩМжВ£иАЕзЪДйҐДеРОеТМжАїзФЯе≠ШжЬЯгАВ
еПВиАГжЦЗзМЃ
Ren Y, Li R, Feng H, Xie J, Gao L,Chu S, Li Y, Meng F and Ning Y (2022)Single-cell sequencing reveals effects of chemotherapy on the immune landscape and TCR/BCR clonal expansion in a relapsed ovarian cancer patient.Front. Immunol. 13:985187.doi: 10.3389/fimmu.2022.985187

жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РпЉИзЇ≥жЦѓиЊЊеЕЛдї£з†БпЉЪGTHпЉЙдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ |TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ

