
ABSTRACT
背景:免疫检查点抑制剂(ICIs)已经彻底改变了癌症治疗。然而,它们与一系列独特的副作用有关,称为免疫相关不良事件(irAEs),如果不及时治疗,可引起严重的发病率,并迅速发展为严重或危及生命的事件。因此,在免疫治疗开始之前确定irAEs的预测性生物标志物是一个关键的研究领域。T细胞受体-(TCRB)变量(TRBV)基因的多态性与自身免疫性疾病有关,并可能与irAEs有机制联系。然而,TCRB位点的重复性质和不完整的基因组组装过去阻碍了TRBV多态性的评估。
患者及方法:作者使用了一种新的方法,对来自外周血总RNA的重排TCRB链进行长扩增子下一代测序,以评估接受免疫治疗的癌症患者中TRBV多态性与irAEs之间的联系。通过使用多重PCR创建了跨越三个β链互补决定区(CDR)区域的扩增子,除了CDR3分析外,还可以检测种系编码框架和CDR1和CDR2区域的多态性。所得到的扩增子通过Ion Torrent测序,为每个个体构建的TRBV等位基因图谱与irAE注释相关,以确定与严重irAE(≥3级)相关的单倍型。
结果:研究纳入了81例在接受癌症免疫治疗时发生irAEs的患者。通过对81个TRBV等位基因的主成分分析和k-means聚类,鉴定出了6个主要的TRBV单倍型。发现该队列中有三分之一的人具有TRBV等位基因单倍型,似乎可以预防严重的irAEs。
结论:这些数据表明,长扩增子TCRB全库测序可以潜在地识别与严重irAEs风险相关的TRBV单倍型组。种系编码TRBV多态性可作为严重irAEs的预测性生物标志物。
01 研究背景
免疫检查点抑制剂(ICIs)通过逆转肿瘤诱导的免疫系统抑制,从而释放强大的细胞毒性T细胞介导的抗肿瘤反应,在癌症治疗中创造了一个范式转变。介导持久无进展生存的T细胞反应也可能促进T细胞对一些患者健康组织的破坏,从而产生一系列独特的副作用,称为免疫相关不良事件(irAEs)。这些irAEs可影响多个器官,如果不及时治疗,可能会迅速恶化,导致严重的发病率、永久性损伤,甚至死亡。尽管在辅助治疗中使用ICI具有一致的无复发生存(RFS)益处,但与ICI治疗相关的irAEs的发病率和发病率是显著的,这表明迫切需要识别严重irAEs(≥3级)风险的患者。
此外,在新辅助药物和辅助药物使用扩大的趋势的推动下,随着推荐使用ICIs的癌症适应症的数量持续增长,ICIs的医疗负担也将成比例地增加。鉴于irAEs的有效管理依赖于早期识别和及时干预,因此迫切需要识别有严重irAEs风险的患者。然而,到目前为止,还缺乏可靠的生物标志物来预测高危患者。
为了克服WGS检测TRBV多态性的挑战,作者开发了一种通过外周血白细胞重排TCRB链的下一代测序(NGS)检测TRBV多态性的方法。这代表了第一个基于NGS的方法,允许TRB位点的单倍型水平分辨率。在这项研究中,通过评估TRBV多态性与严重irAEs之间的联系,使用从81名在ICI治疗期间经历不同严重程度irAEs的个体中收集的外周血样本。
02 研究方法
1.队列选择和描述
收集81例在肿瘤免疫治疗过程中出现不同程度irAEs的白人患者外周血样本。
2.文库制备及测序
提取RNA后进行逆转录获得cDNA,通过多重PCR获得覆盖TCRβ三个互补决定区(CDR)的约330bp长扩增子并测序,每个文库达到约150万次原始读取。
3.81例患者样本单倍型群鉴定
4.免疫相关不良事件的预测
03 结果
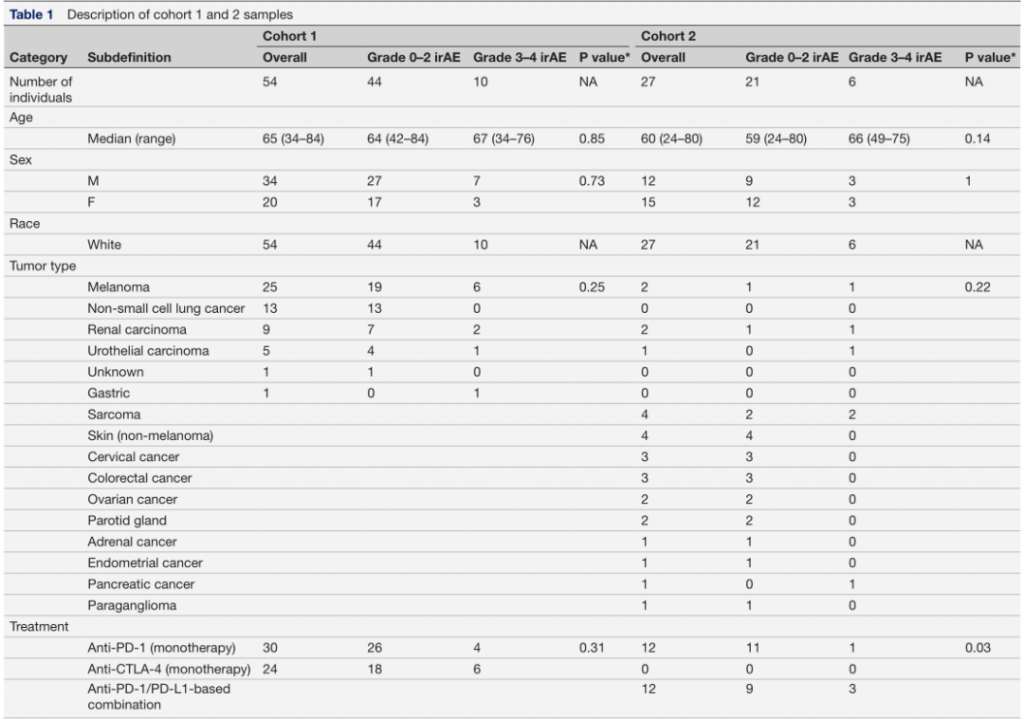
TCRB受体库用于构建每个样本的可变基因等位基因谱,然后作者将数据细分为六种主要类型的等位基因谱,作者称之为单倍型组。每个样本的等位基因谱,按单倍型组排序,如图1A所示,并附有关键注释。作者根据一般原则将每个样本分为无/轻度irAEs(≤2级)或严重irAEs(≥3级),即2级或更低级别的irAEs(心肌炎、神经系统和血液系统irAEs除外)不会增加发病率,并且通常无需对治疗方案进行重大修改即可控制,而3级或更高级别的irAEs可能会显著增加发病率并需要终止治疗。
作者还观察到严重irAEs的发生率在六个单倍型组中差异显著:一个单倍型组(组2)的成员,占33%的样本,似乎不受严重irAEs的影响(0%的频率;图1B单倍型2(红色),而其他单倍型组中14-44%的患者有严重的irAEs (p=4.4E−4,Fisher精确检验)。
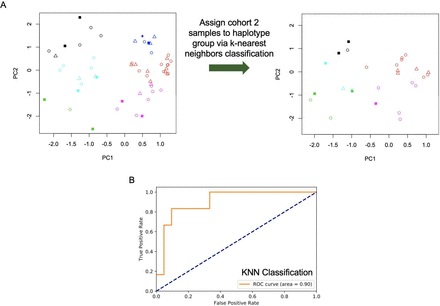
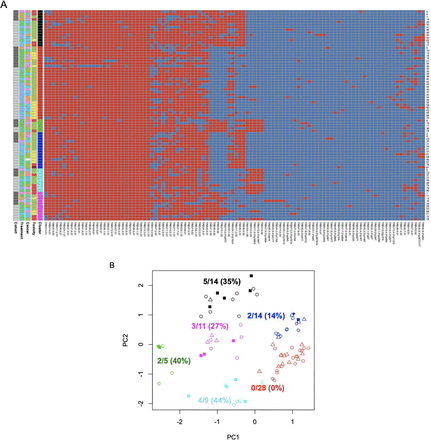
为了评估这一发现的稳健性,作者检查了队列1的样本是否可以用于预测队列2的严重irAEs 。通过对队列1样本重复主成分分析和k均值聚类,然后使用得到的单倍型标签通过k近邻分析将队列2样本分配到单倍型群体。通过再次观察到irae在单倍型群体中的非随机分布(图2A, p=0.03, Fisher精确检验),没有被归类为单倍型群体2的样本有严重的irAEs。作为补充方法,询问是否使用k近邻分类器训练队列1等位基因谱和irAE标签(0:irAE≤2级;1:irAE≥3级)可以预测队列2患者样本中是否存在严重irAE。从接受者-操作者特征曲线(曲线下面积为0.90,图2B)的分析可以看出,分类器能够预测队列2中的irAEs。
最后,为了深入了解irAEs在单倍型群体之间差异分布的基础,通过询问是否存在将单倍型群体2与其他单倍型群体区分开来的等位基因谱特征。正如之前的工作所示,22个单倍型组2的成员比其他单倍型组的成员拥有更少的独特等位基因和不常见等位基因(定义为存在于样本集的50%以下)。这表明单倍型组2成员对该队列中常见的等位基因单倍型倾向于纯合,而其他组的成员具有更高的TRBV等位基因杂合性,并且携带罕见的TRBV单倍型(在线补充文件1;第2组独特等位基因数和罕见等位基因数与其他组比较,P值分别为1.7E−4和3.6E−13,Student’s t检验)。
04 结论
ICI是一类有效的免疫治疗药物,用于治疗多种癌症,尽管ICI相关的irAEs仍然是一个关键的挑战。作者的研究结果支持了TCRB基因座内的遗传变异有助于ICIs治疗后的irAEs的观点。作者的样本集包括使用单一和联合检查点阻断剂治疗多种癌症的个体,这表明TRBV多态性的预测价值并不局限于单一癌症类型或免疫治疗方案。据推测,在自身反应性TRBV等位基因携带者中,VDJ重组,即可变(V)、多样性(D)和连接(J)免疫球蛋白基因片段之间的体细胞重组,经常产生自身抗原识别的TCR,其中一些不能通过胸腺阴性选择消除。目前的T细胞成熟模型表明,具有自身反应性TCR的T细胞要么被胸腺阴性选择完全消除,要么作为失活的T细胞在周围持续存在。假设后者可能被ICIs重新激活以介导irAEs。第二种相容的可能性是,ICIs降低了胸腺阴性选择的功效,导致自身反应性TRBV等位基因携带者产生不成比例的大量自身反应性T细胞。
总之,使用长扩增子TCRB全库测序识别严重irAE风险个体的能力有可能通过降低irAE发病率和实现利用更多样化的免疫检查点调节剂的个性化免疫治疗方案来改善患者的预后。
参考文献
Stephen B, Hajjar J, Sarda S, et al. T- cell receptor beta variable gene polymorphism predicts immune- related adverse events during checkpoint blockade immunotherapy. Journal for ImmunoTherapy of Cancer 2023;11:e007236. doi:10.1136/jitc-2023-007236
