
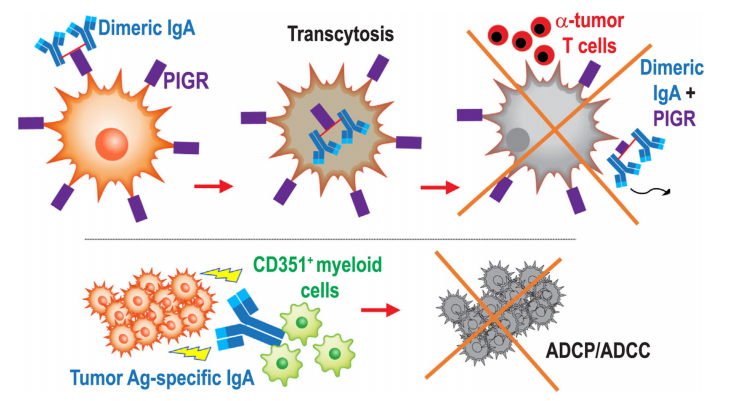
йҐШ зЫЃпЉЪдЄНеЖН襀圚иІЖпЉЪBзїЖиГЮдїЛеѓЉзЪДжКЧиВњзШ§еЕНзЦЂ еПСи°®жЬЯеИКпЉЪSemin Immunol еПСи°®жЧ•жЬЯпЉЪ2023еєі1жЬИ еЬ®жКЧиВњзШ§з†Фз©ґйҐЖеЯЯпЉМTзїЖиГЮеЕНзЦЂжШѓељУдєЛжЧ†жДІзЪДдЄїиІТпЉМдљЖжШѓињСжЬЯз†Фз©ґеПСзО∞пЉМеЬ®TзїЖиГЮжњАжіїжШЊиСЧзЪДиВњзШ§дЄ≠пЉМBзїЖиГЮзЪДжњАжіїеРМж†ЈдЄКи∞ГгАВеЫ†ж≠§йТИеѓєжКЧиВњзШ§з†Фз©ґдЄ≠иВњзШ§BзїЖиГЮеТМTзїЖиГЮеНПеРМдљЬзФ®зЪДз†Фз©ґеЉАеІЛ襀жМБзї≠еЕ≥ж≥®гАВињСеєіжЭ•дЄЙзЇІжЈЛеЈізїУTLS (tertiary lymphoid structure) жИРдЄЇдЇЖжКЧиВњзШ§з†Фз©ґзЪДйЗНзВєеЕ≥ж≥®еѓєи±°пЉМTLSеЖЕеѓМеРЂќ±ќ≤ TзїЖиГЮгАБBзїЖиГЮгАБDCзїЖиГЮгАБеЈ®еЩђзїЖиГЮз≠ЙдЄАз≥їеИЧеЕНзЦЂзЫЄеЕ≥зїЖиГЮпЉМз†Фз©ґеПСзО∞BзїЖиГЮдїЛеѓЉзЪДжКЧиВњзШ§дљУжґ≤еЕНзЦЂеПНеЇФдЄОжЫіе•љзЪДйҐДеРОзЫЄеЕ≥гАВжЬђжЦЗйАЪињЗеИЖжЮРдЇЇз±їеТМе∞ПйЉ†иВњзШ§зЪДеЕНзЦЂзФЯзЙ©е≠¶дєЛйЧізЪДеЈЃеЉВпЉМиЃ®иЃЇеЕ≥дЇОдЄЙзЇІжЈЛеЈізїУжЮДеЬ®жКЧиВњзШ§еЕНзЦЂдЄ≠зЪДдљЬзФ®гАВ еЕИеЙНзЪДе∞ПйЉ†ж®°еЮЛз†Фз©ґи°®жШОпЉМзШ§еЇКдЄКзЪДBзїЖиГЮеЕЈжЬЙиВњзШ§дњГињЫеТМеЕНзЦЂжКСеИґдљЬзФ®гАВдљЖжЬАињСдЄАз≥їеИЧеЕ≥дЇОдЇЇз±їиВњзШ§зЪДз†Фз©ґи°®жШОжЬЙBзїЖиГЮеТМжµЖзїЖиГЮ浪洶зЪДиЃЄе§ЪдЇЇз±їиВњзШ§еЊАеЊАжЬЙжЫіе•љзЪДйҐДеРОгАВйЩ§жЈЛеЈізШ§е§ЦпЉМBзїЖиГЮ浪洶еТМиВњзШ§еК†йАЯзФЯйХњдєЛйЧізЪДдЉЧе§ЪзЛђзЂЛеЕ≥иБФдЄАзЫіе±АйЩРдЇОе∞ПйЉ†иВњзШ§ж®°еЮЛгАВиВњзШ§жіїжАІзЪДдњГињЫдЄїи¶БељТеЫ†дЇОеЕЈжЬЙеЕНзЦЂжКСеИґжіїжАІзЪДBзїЖиГЮзЊ§пЉЪзІ∞дЄЇи∞ГиКВжАІBзїЖиГЮжИЦBregзїЖиГЮгАВе∞ПйЉ†ж®°еЮЛжѓФдЇЇз±їзЩМзЧЗж®°еЮЛињЫе±Хи¶БењЂеЊЧе§ЪпЉМеєґдЇІзФЯеПѓиГљжЬЙеИ©дЇОBregзїЖиГЮеПСиВ≤зЪДзВОзЧЗеПНеЇФгАВеЫ†ж≠§пЉМIgдЇЪеЮЛеЬ®еПѓзІїж§НиВњзШ§ж®°еЮЛдЄ≠еН†дЄїеѓЉеЬ∞дљНпЉМеєґдЄФеЬ®е§Іе§ЪжХ∞иљђеЯЇеЫ†иВњзШ§жШУжДЯе∞ПйЉ†дЄ≠еН†дЄїеѓЉеЬ∞дљНпЉМдљЖе∞ПйЉ†йАЪеЄЄеѓєиљђжНҐеЮЛIgMзЪДеЕНзЦЂеОЯжАІеЊИеЈЃгАВзЫЄжѓФдєЛдЄЛпЉМеЬ®дЇЇз±їжБґжАІиВњзШ§дЄ≠пЉМиљђжНҐеЮЛIgAеТМIgGзїУеРИзЪДйЭЮиљђжНҐеЮЛIgMжКЧдљУеН†дЄїеѓЉеЬ∞дљНгАВжАїдєЛпЉМжЬАињСзЪДз†Фз©ґи°®жШОе∞ПйЉ†ж®°еЮЛеТМдЇЇз±їзЩМзЧЗжВ£иАЕдєЛйЧіе≠ШеЬ®жШЊиСЧеЈЃеЉВпЉМдЄ§иАЕдљУжґ≤еПНеЇФе§ІзЫЄеЊДеЇ≠гАВ 1.еРМеЮЛиљђжНҐжКЧдљУе¶ВдљХеЬ®дЇЇз±їзЩМзЧЗдЄ≠еПСжМ•еЕНзЦЂеОЛеКЫ жЬАињСеѓєиВњзШ§еЯЇеЫ†зїДеЫЊи∞±жХ∞жНЃеЇУдЄ≠жХ∞зЩЊзІНдЇЇз±їиВњзШ§ињЫи°МеИЖжЮРпЉМиѓБеЃЮдЇЖ32зІНдЇЇз±їиВњзШ§з±їеЮЛдЄ≠еєњж≥Ые≠ШеЬ®зЪДBзїЖиГЮеЕЛйЪЖеҐЮжЃЦгАБеРМеЮЛиљђжНҐеТМиґЕдљУзїЖиГЮз™БгАВеЕґдїЦз†Фз©ґе∞ПзїДеЬ®дЇЇеНµеЈҐзЩМзїЖиГЮи°®йЭҐеПСзО∞дЇЖйЭґеРСиЗ™иЇЂжКЧеОЯдї•еПКеЬ®е§Іе§ЪжХ∞еНµеЈҐзЩМдЄ≠еПСзО∞иВњзШ§еЖЕжКЧдљУеИЖж≥МзїЖиГЮпЉМињЩдЇЫзїЖиГЮ襀еЕЛйЪЖжЙ©еҐЮпЉМеЕґдЄ≠дЄАдЇЫзїЖиГЮеИЖж≥МйТИеѓєиВњзШ§зїЖиГЮи°®йЭҐзЪДMMP14жКЧдљУгАВжЬЙз†Фз©ґеПСзО∞еП™жЬЙдЄКзЪЃеЖЕTзїЖиГЮдЄОBзїЖиГЮ浪洶зЫЄеЕ≥жЧґпЉМдЄКзЪЃеЖЕTзїЖиГЮжЙНеѓєеНµеЈҐзЩМйҐДеРОжЬЙйҐДжµЛдїЈеАЉгАВињЩдЇЫеПСзО∞и°®жШОпЉМеҐЮеЉЇдљУжґ≤еЕНзЦЂзЪДеЕНзЦЂзЦЧж≥ХеПѓиГљжѓФдЄУйЧ®йТИеѓєTзїЖиГЮзЪДеє≤йҐДжЫіжЬЙжХИпЉМзЙєеИЂжШѓеѓєдЇОеѓєеЕНзЦЂж£АжЯ•зВєжКСеИґеЙВжЬЙиАРиНѓжАІзЪДжБґжАІиВњзШ§гАВ зФ±иВњзШ§еЇКдЇІзФЯзЪДIgAдїЛеѓЉзЪДзђђдЇМзІНжКЧиВњзШ§жіїжАІзЪДжЬЇеИґжШѓйАЪињЗдЇМиБЪдљУIgA(еМЕжЛђJйУЊ)дЄОе§ЪиБЪдљУIgA (PIGR)еПЧдљУзЪДзїУеРИдїЛеѓЉзЪДпЉМињЩдЇЫеПЧдљУжЩЃйБНи°®иЊЊдЇОеНµеЈҐзЩМзїЖиГЮи°®йЭҐгАВиБЪдљУIgAдЄОPIGRзЪДзїУеРИйАЪињЗжБґжАІдЄКзЪЃзїЖиГЮеЉХеПСиГЮеРЮдљЬзФ®пЉМдїОиАМеЉХиµЈиљђељХеПШеМЦпЉМжЛЃжКЧRASйАЪиЈѓпЉМеєґдљњиВњзШ§зїЖиГЮеѓєTзїЖиГЮзЪДзїЖиГЮжЇґиІ£жЭАдЉ§жХПжДЯ(еЫЊ1)гАВдљЬиАЕеПСзО∞PIGR襀IgAеН†жНЃеРОпЉМиВњзШ§зїЖиГЮдЄ≠зЪДеє≤жЙ∞зі†еТМиВњзШ§еЭПж≠їеЫ†е≠РйАФеЊД襀жњАжіїдЄОеЗЛдЇ°еТМеЖЕиі®зљСеЇФжњАйАФеЊДжЬЙеЕ≥гАВж≠§е§ЦпЉМBзїЖиГЮеТМжµЖзїЖиГЮзЪДзІѓзіѓйҐДжµЛдЇЖжЙАжЬЙзїДзїЗе≠¶дЇЪеЮЛе≠РеЃЂеЖЕиЖЬзЩМзЪДжЫійЂШе≠ШжіїзОЗпЉМдљЖеЬ®йЂШзЇІеИЂе≠РеЃЂеЖЕиЖЬеЮЛеТМжµЖжґ≤жАІиВњзШ§дЄ≠пЉМиВњзا浪洶TзїЖиГЮж≤°жЬЙжШЊиСЧзЪДйҐДжµЛдїЈеАЉгАВжАїдєЛпЉМеЬ®дЄНдЊЭиµЦжКЧеОЯиѓЖеИЂзЪДжГЕеЖµдЄЛпЉМPIGRдЊЭиµЦзЪДIgAйАЪињЗиВњзШ§зїЖиГЮиГЮеРЮеПѓдї•жШОжШЊжЛЃжКЧжБґжАІиВњзШ§зЪДињЫе±ХгАВ
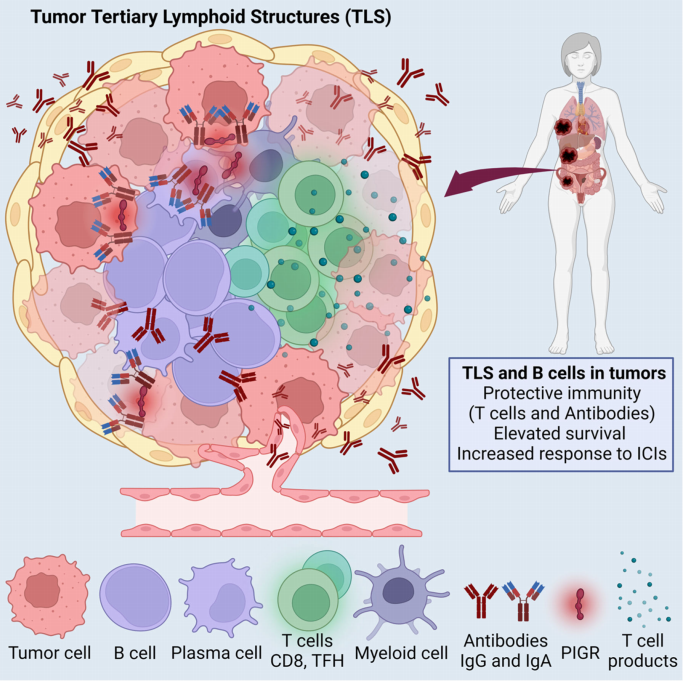
еЫЊ1 2.TLSеПѓйҐДжµЛе§ЪзІНдЇЇз±їиВњзШ§зЪДеЕНзЦЂж≤їзЦЧжХИжЮЬеТМзФЯе≠ШжЬЯеїґйХњ TLSжШѓжМЗеЬ®зЧЕзРЖзФЯзРЖзОѓеҐГдЄЛпЉМжЈЛеЈізїЖиГЮеЬ®йЭЮжЈЛеЈіеЩ®еЃШеЖЕиБЪйЫЖ嚥жИРзЪДжЬЙзїДзїЗзЪДеЉВдљНжЈЛеЈізїУжЮДгАВжИРзЖЯзЪДTLSеМЕжː襀TзїЖиГЮеМЕеЫізЪДBзїЖиГЮеМЇеЯЯеТМзФЯеПСдЄ≠ењГпЉМжЩЃйБНе≠ШеЬ®дЇОе§ЪдЄ™зШ§зІНдЄ≠пЉМжШѓиВњзШ§зїЖиГЮдЄОеЕНзЦЂзїЖиГЮзЫЄдЇТдљЬзФ®зЪДйЗНи¶БеЬЇжЙАпЉМдЄОжВ£иАЕйҐДеРОеѓЖеИЗзЫЄеЕ≥гАВе§Ъй°єз†Фз©ґзїУжЮЬи°®жШОTLSзЪДе≠ШеЬ®дЄОйҐДеРОеСИж≠£зЫЄеЕ≥пЉМеН≥дљњжШѓеЯЇзЇњж∞іеє≥зЪДTLSеТМиЊГе∞СзЪДBзїЖиГЮ浪洶пЉМдєЯйҐДз§ЇзЭАеѓєдЄНеРМ嚥еЉПзЪДеЕНзЦЂж≤їзЦЧжЬЙжЫіе•љзЪДеПНеЇФгАВдЊЛе¶ВпЉМеЬ®йїСиЙ≤зі†зШ§гАБиВЊзЩМеТМиВЙзШ§дЄ≠пЉМTLSеПѓйҐДжµЛеЕНзЦЂж£АжЯ•зВєйШїжЦ≠зЪДж≤їзЦЧеПНеЇФгАВжЫіеѓЖйЫЖзЪДBзїЖиГЮ浪洶еТМиВњзШ§еЖЕTLSдєЯйҐДжµЛе§НеПСжАІеНµеЈҐзЩМжВ£иАЕжО•еПЧдљОзФ≤еЯЇеМЦиНѓзЙ©еК†еЕНзЦЂж£АжЯ•зВєйШїжЦ≠еРОзЪДжМБдєЕдЄіеЇКеПНеЇФгАВж≠§е§ЦпЉМеЬ®жО•еПЧжКЧPD-L1йШїжЦ≠ж≤їзЦЧзЪДиВЇзЩМжВ£иАЕдЄ≠дєЯеПСзО∞дЇЖдЄОTLSе≠ШеЬ®зЫЄеЕ≥зЪДBзїЖиГЮеТМжµЖзїЖиГЮзЙєеЊБгАВеЫ†ж≠§пЉМBзїЖиГЮгАБжµЖзїЖиГЮеТМTLSзЪД嚥жИРеПѓдї•дљЬдЄЇиѓЖеИЂжКЧиВњзШ§еЕНзЦЂзЦЧж≥ХжЬЙжХИзЪДзФЯзЙ©е≠¶ж†ЗењЧзЙ©гАВ з†Фз©ґеЫҐйШЯеПСзО∞иЕєиЕФеЖЕиВњзШ§ж®°еЮЛжѓФдЊІиЕєиВњзШ§жЫіеЃєжШУдЇІзФЯTLSпЉМдЄФиДЊиДПйЩДињСжШѓињЩTеТМBзїЖиГЮзЪДдЄїи¶БеВ®е≠ШеМЇгАВеП¶дЄАзїДз†Фз©ґе∞ПзїДеПСзО∞дЄ§зІНдЄНеРМзЪДеЕНзЦЂзїЖиГЮ浪洶殰еЉПпЉЪ1.еЕЈжЬЙеЕНзЦЂзїУжЮДеЊЃзОѓеҐГзЪДиВњзШ§еМЕжЛђTLSдЄ≠зЪДжµЖзїЖиГЮдЇІзФЯIgGеТМIgA ¬†2.еЬ®еЕЈжЬЙеЕНзЦЂжОТжЦ•еЊЃзОѓеҐГзЪДиВњзШ§дЄ≠пЉМеЕНзЦЂзїЖиГЮеТМTLSдљНдЇОзШ§еЇКе§ЦгАВ
еЫЊ2 3.иВњзШ§еЖЕTLSе¶ВдљХжМБзї≠й©±еК®жКЧиВњзШ§еЕНзЦЂ зЫЃеЙНеЕ≥дЇОTLSзЪДе≠ШеЬ®жШѓеР¶дЄОеЕНзЦЂдњЭжК§жЬЙеЕ≥е∞ЪдЄНжЄЕж•ЪгАВжКЧиВњзШ§жіїжАІжЬАжШОжШЊзЪДжЬЇеИґжШѓдЇІзФЯеРМеЮЛиљђжНҐжКЧдљУпЉМиѓ•жКЧдљУеПѓдї•йЭґеРСиВњзШ§зїЖиГЮи°®йЭҐгАВзФ±дЇОиВњзШ§еЊЃзОѓеҐГдЄ≠е≠ШеЬ®TLSе§ЦзЪДжµЖзїЖиГЮеТМиі®жѓНзїЖиГЮпЉМзЙєеЉВжАІTLSи°НзФЯжКЧдљУзЪДжКЧиВњзШ§жіїжАІињШжЬ™ж≠£еЉПиѓБжШОгАВеП¶дЄАзІНжљЬеЬ®зЪДеЕНзЦЂдњЭжК§жЬЇеИґжШѓеЬ®йЂШеЖЕзЪЃе∞ПйЭЩиДЙзЪДињЗжї§дЄЛпЉМеЬ®йВїињСиВњзШ§еЊЃзОѓеҐГдЄ≠дњЭжК§иВњзШ§еПНеЇФжАІTзїЖиГЮеЕНеПЧеЕНзЦЂжКСеИґдњ°еПЈ(еН≥PD-L1жИЦCD277пЉМжИЦжЭ•иЗ™еЕНзЦЂжКСеИґй™®йЂУзїЖиГЮзЪДдњ°еПЈ)зЪДељ±еУНгАВж≠§е§ЦпЉМйАЪињЗйВїињСBзїЖиГЮзЪДжКЧеОЯеСИйАТжіїжАІжИЦеЕґеЕ±еИЇжњАеИЖе≠РзЪДи°®иЊЊдЇІзФЯзЪДеЯЇз°АжњАжіїдњ°еПЈеПѓдї•зїіжМБињЩдЇЫжЈЛеЈізїЖиГЮзЪДжіїжАІпЉМйШ≤ж≠ҐзїЖиГЮеЇФжњАжИЦеЕґдїЦеЖЕеЬ®йАФеЊДеЉХиµЈзЪДзШЂзЧ™гАВињЩзІНеПѓиГљзЪДжЬЇеИґеТМжШОжШЊзЪДжКЧдљУдЇІзФЯйГљжДПеС≥зЭАBзїЖиГЮеЬ®дЇЇз±їзЩМзЧЗеПНеЇФдЄ≠еЕЈжЬЙдЄїи¶БзЪДжКЧиВњзШ§жіїжАІпЉМиАМдЄНжШѓBзїЖиГЮеЕЈжЬЙдњГиВњзШ§дљЬзФ®гАВ еЕНзЦЂдњЭжК§жЬЇеИґдєЯеПѓиГљдЄОйВїињСиВњзШ§зїДзїЗдЄ≠зЪДжЧБиІВиАЕжХИеЇФжЬЙеЕ≥пЉМеѓЉиЗізВОзЧЗеЊЃзОѓеҐГжѓФеЕґдїЦиВњзШ§еМЇеЯЯжЫідЄНеЕБиЃЄиВњзШ§зїЖиГЮзФЯйХњгАВињЩеПѓдї•йАЪињЗжЦ∞зЪДз©ЇйЧіеИЖе≠РеИЖжЮРжКАжЬѓињЫи°Мз†Фз©ґпЉМиѓ•жКАжЬѓжПРдЊЫжДЯеЕіиґ£еМЇеЯЯзЪДиљђељХзїДе≠¶еИЖжЮРпЉМйАЪињЗе§ЪдЄ™ж†ЗиЃ∞зЪДжЯУиЙ≤жЭ•иѓЖеИЂгАВеП¶е§ЦпЉМ¬†TLSзЪД嚥жИРдЄОеПСе±ХжШѓдЄАдЄ™е§Ъж≠•й™§гАБеК®жАБеПШеМЦињЗз®ЛпЉМеЕНзЦЂзїЖиГЮи°НзФЯзЪДдњГзВОдњ°еПЈдљЬдЄЇиѓ±еѓЉеЙВпЉМжіїеМЦзЪДжИРзЇ§зїізїЖиГЮйАЪињЗеїЇзЂЛеєґзїіжМБжЈЛеЈізїЖиГЮзїУжЮДжИЦдЇІзФЯеЕ≥йФЃзЪДиґЛеМЦеЫ†е≠РжЭ•еЕЕељУзїДзїЗиАЕпЉМе∞Же§ЪзІНзїЖиГЮжЛЫеЛЯеИ∞зЫЄеЇФдљНзљЃпЉМињЩдЇЫзїЖиГЮйАЪињЗеєњж≥ЫзЪДзїЖиГЮйЧізЫЄдЇТдљЬзФ®пЉМжЬАзїИеИЖеМЦжИРзЖЯпЉМеєґеПСжМ•еЕНзЦЂжХИеЇФгАВеЬ®TLSдЄ≠пЉМдЄНеРМеЕНзЦЂзїЖиГЮеПКеЕґдЇІзЙ©дєЛйЧізЫЄдЇТдЇ§жµБзЪДжЬЇеИґдЇЯеЊЕжЊДжЄЕпЉМдї•еИ©зФ®ињЩдЇЫзЫЄдЇТдЊЭиµЦзЪДеПНеЇФзЪДеИґеЃЪжЦ∞еє≤йҐДжО™жЦљгАВ 4.TLS嚥жИРиГљеР¶дљЬдЄЇдЄАзІНеЕНзЦЂзЦЧж≥Х TLSжПРдЊЫдЇЖеЕНзЦЂзїЖиГЮдњЭжМБжКЧиВњзШ§жіїжАІзЪДжЮҐзЇљпЉМжЈ±еЕ•иЃ§иѓЖдЄНеПѓеИЗйЩ§иВњзШ§дЄ≠TLS嚥жИРзЪДжЦєеЉПпЉМеПѓиГљжЬЙеК©дЇОжЦ∞зЪДж≤їзЦЧжЙЛжЃµеЬ∞еЉАеПСгАВиЩљзДґеЕ≥дЇОTLSеЬ®жМБзї≠зВОзЧЗзОѓеҐГдЄ≠зЪД嚥жИРеЈ≤жЬЙеЕ±иѓЖпЉМдљЖдЄНеРМзЪДдљЬиАЕйЗЗзФ®дЇЖдЄНеРМзЪДжЦєж≥ХжЭ•й©±еК®TLS嚥жИРгАВдЊЛе¶ВпЉМStorkusе∞ПзїДзЪДеЉАеИЫжАІз†Фз©ґеЉЇи∞ГдЇЖSTINGжњАеК®еЙВдњГињЫиВњзШ§и°АзЃ°ж≠£еЄЄеМЦпЉМдїОиАМеѓЉиЗіTLS嚥жИРгАВдЄФжЇґзШ§зЧЕжѓТж≤їзЦЧеЬ®дњГињЫзїЖиГЮеЫ†е≠РеТМиґЛеМЦеЫ†е≠РзОѓеҐГжЦєйЭҐеПѓиГљеЕЈжЬЙз±їдЉЉзЪДдљЬзФ®пЉМеєґеЕЈжЬЙеҐЮеЉЇжКЧеОЯжЙ©жХ£зЪДдЉШеКњгАВз†Фз©ґи°®жШОпЉМељУдљњзФ®и°АзЃ°йЭґеРСиВљжЬЙжХИеЬ∞дЉ†йАТеИ∞иВњзШ§и°АзЃ°жЧґпЉМTNF-ќ±еЃґжЧПжИРеСШLIGHTдєЯдњГињЫTLSеНПи∞ГгАВиѓ•з≥їзїЯдЄ≠зЪДTLS嚥жИРеПСзФЯеЬ®TзїЖиГЮжґМеЕ•еРОпЉМеєґдЄФеПѓдї•йАЪињЗж£АжЯ•зВєжКСеИґжЭ•еҐЮеЉЇпЉМдїОиАМжПРйЂШдЄіеЇКеЙНж®°еЮЛзФЯе≠ШзОЗгАВ жЬАињСзЪДз†Фз©ґеПСзО∞пЉМеѓЉиЗіTLS嚥жИРзЪДдЄАдЄ™йЗНи¶БеЫ†зі†жШѓйАЪињЗSATB1зЪДеЖЕеЬ®и°®иЊЊйЩНдљО襀жњАжіїзЪДCD4+TзїЖиГЮзЪДеИЖеМЦиљђеМЦдЄЇTfhзїЖиГЮгАВињЩжШѓйАЪињЗSATB1зЪДеЖЕеЬ®и°®иЊЊеЗПе∞СиАМеПСзФЯзЪДпЉМSATB1жШѓжКСеИґICOSзЪДеЯЇеЫ†зїДзїДзїЗиАЕпЉМжШѓTжї§ж≥°и∞ГиКВзїЖиГЮжЬЙжХИеИЖеМЦжЙАењЕйЬАзЪДпЉМTжї§ж≥°и∞ГиКВзїЖиГЮжШѓдЄАзІНжЛЃжКЧTfhзїЖиГЮжіїжАІзЪДзїЖиГЮз±їеЮЛгАВTfhзїЖиГЮдЇІзФЯдЄАзІНиґЛеМЦеЫ†е≠РзОѓеҐГпЉМдњГињЫTLSзЪДиЗ™еПС嚥жИРпЉМеМЕжЛђLIGHTзЪДеИЖж≥МеТМIL-21зЪДдЇІзФЯпЉМIL-21жњАжіїBзїЖиГЮпЉМдї•еУНеЇФTfhзїЖиГЮдЇІзФЯзЪДCXCL13гАВиЗ™дљУTfhзїЖиГЮиґ≥дї•иѓ±еѓЉTLSзЪД嚥жИРпЉМиАМеєЉз®ЪCD4 TзїЖиГЮдЄНдЉЪиѓ±еѓЉињЩдЇЫдљЬзФ®гАВеЬ®зїУзЫіиВ†зЩМдЄіеЇКеЙНж®°еЮЛзЪДзЛђзЂЛз†Фз©ґињЫдЄАж≠•иѓБеЃЮдЇЖTfhзїЖиГЮеЬ®TLSеПСзФЯдЄ≠зЪДеЕ≥йФЃдљЬзФ®пЉМзРЖиЃЇдЄКеПѓдї•е∞ЖTfhзїЖиГЮж≥®еЕ•иљђзІїжАІзЩМзЧЗжИЦз≤ШйЩДеЬ®дЄНеПѓеИЗйЩ§йГ®дљНзЪДиВњзШ§дЄ≠пЉМдї•й©±еК®TLSзїДи£ЕпЉМдЄЇйАЪињЗPD-1йШїжЦ≠з≠ЙйАФеЊДиОЈжХСзЪДTзїЖиГЮеИЫйА†дЄАдЄ™еЕБиЃЄзЪДзОѓеҐГпЉМдїОиАМжАїдљУдЄКеїґзЉУжБґжАІињЫе±ХгАВ жАїдєЛпЉМTLSзЪД嚥жИРйЬАи¶БдЄАдЄ™еЕЈжЬЙж≠£з°ЃзїЖиГЮеЫ†е≠РеТМиґЛеМЦеЫ†е≠РзЪДйЂШеЇ¶зВОзЧЗзОѓеҐГзЪДеНПи∞ГгАВеЫ†ж≠§пЉМеПѓиГљжЬЙдЄНеРМзЪДжЦєеЉПжЭ•еНПи∞ГињЩдЇЫжЈЛеЈіж†ЈзїУжЮДпЉМдљЖCXCL13еТМTfhзїЖиГЮеѓєдЇОзФЯеПСдЄ≠ењГзЪД嚥жИРеТМзїіжМБиµЈзЭАйЗНи¶БдљЬзФ®гАВ ¬†5.иЃ∞ењЖBзїЖиГЮеЬ®дЄНеРМжБґжАІиВњзШ§дЄ≠зЪДдљЬзФ® иЃ∞ењЖBзїЖиГЮжШѓдЄАзІНеК®жАБзЪДжИРзЖЯBзїЖиГЮзЊ§дљУпЉМеЃГдїђеПѓдї•йЗНжЦ∞ињЫеЕ•зФЯеПСдЄ≠ењГпЉМдї•еУНеЇФжМБзї≠зЪДиВњзШ§жКЧеОЯгАВиЃ∞ењЖBзїЖиГЮеПѓдї•ињЕйАЯдЇІзФЯжКЧдљУеИЖж≥МзїЖиГЮпЉМињЩзІНзїЖиГЮйАЪеЄЄе≠ШеЬ®дЇОе§ЪдЄ™иВњзШ§еМЇеЯЯгАВиЃ∞ењЖBзїЖиГЮеѓњеСљдєЯеЊИйХњпЉМеПѓдї•е≠ШеЬ®еЗ†еНБеєігАВеЫ†ж≠§пЉМBзїЖиГЮиЃ∞ењЖеПНеЇФеПѓиГљжѓФTзїЖиГЮй©±еК®зЪДеПНеЇФжЫіжМБдєЕеТМжЬЙжХИгАВж≠§е§ЦпЉМиЃ∞ењЖBзїЖиГЮеПѓдї•еРСе±АйГ®TзїЖиГЮйАТеСИжКЧеОЯпЉМињЩдєЯеПѓиГљдљњиВњзШ§жґИйААгАВињЩзІНжХИеЇФеЬ®TLSдЄ≠пЉМTзїЖиГЮеПѓдї•жО•жФґжњАжіїдњ°еПЈпЉМзїіжМБжХИеЇФжіїжАІзЪДеЯЇз°АеЯЇи∞ГпЉМиАМйЂШеЖЕзЪЃе∞ПйЭЩиДЙеПѓдї•дњЭжК§еЃГдїђеЕНеПЧTLSе§ЦеЕНзЦЂжКСеИґзљСзїЬзЪДељ±еУНгАВиЃ∞ењЖBзїЖиГЮеЬ®жЈЛеЈізШ§дЄ≠зЪДдљЬзФ®еПѓиГљжШѓзЫЄеПНзЪДгАВдЊЛе¶ВпЉМSungaleeз≠ЙдЇЇдљњзФ®йЗНзО∞дЇЖжї§ж≥°жАІжЈЛеЈізШ§зЪДж†ЗењЧжАІBCL2жіїеМЦжШУдљНзЙєеЊБзЪДе∞ПйЉ†ж®°еЮЛпЉМиѓБжШОдЇЖBзїЖиГЮйЗНе§НињЫеЕ•зФЯеПСдЄ≠ењГдЄОжБґжАІзЙєеЊБзЪДиОЈеЊЧжЬЙеЕ≥пЉМеєґдЄФжШѓињЩзІНзЦЊзЧЕињЫе±ХжЙАењЕйЬАзЪДгАВжЬАињСзЪДз†Фз©ґи°®жШОпЉМеЉВеЄЄзЪДиЃ∞ењЖBзїЖиГЮпЉМжШѓеЉ•жЉЂжАІBзїЖиГЮжЈЛеЈізШ§зЪДиµЈжЇРзїЖиГЮгАВ ињСеєіжЭ•пЉМз†Фз©ґйАРжЄРеПСзО∞е∞ПйЉ†еТМдЇЇдљУдєЛеЙНеЬ®еЕНзЦЂж∞іеє≥е≠ШеЬ®жШЊиСЧеЈЃеЉВпЉМе∞ПйЉ†дЄ≠еПСзО∞дЇЖBзїЖиГЮеЕНзЦЂеѓєиВњзШ§зЪДдњГињЫдљЬзФ®пЉМеЬ®дЇЇдљУзОѓеҐГдЄ≠еНіеСИзО∞жИ™зДґзЫЄеПНзЪДзїУиЃЇгАВеЫ†ж≠§BзїЖиГЮеЕНзЦЂзЫЄеЕ≥з†Фз©ґйАРжЄРеҐЮе§ЪпЉМињСжЬЯз†Фз©ґеПСзО∞пЉМBзїЖиГЮеТМжµЖзїЖиГЮзЪДжЄЧйАПпЉМдї•еПКињЩдЇЫзїЖиГЮеЬ®иВњзШ§еЊЃзОѓеҐГдЄ≠дЇІзФЯзЪДеРМеЮЛиљђжНҐжКЧдљУпЉМеПѓдї•еНПеК©еЕНзЦЂзЦЧж≥ХеПСжМ•еКЯжХИгАВеП¶е§ЦжЯРдЇЫиВњзШ§еП™жЬЙеЬ®BзїЖиГЮзЪДзІѓиБЪдЄЛпЉМTзїЖиГЮ浪洶жЙНеЕЈжЬЙйҐДжµЛдїЈеАЉгАВеЬ®IgдЇЪеЮЛжЦєйЭҐпЉМе∞ПйЉ†еТМдЇЇдєЯжЬЙжШЊиСЧдЄНеРМпЉМдЇЇдљУиВњзШ§дЄїи¶Бдї•IgAеТМIgGдљЬдЄЇдЄїеѓЉпЉМеЉАе±ХиВњзШ§еЕНзЦЂгАВTLSдЄ≠дєЯжШѓе¶Вж≠§пЉМдљЖTLSйЪПжИРзЖЯеЇ¶зЪДдЄНеРМпЉМеЕЈдљУеКЯиГљжЬЙжЙАеЈЃеЉВпЉМTLSзЪДеКЯиГљз†Фз©ґдєЯзІ∞дЄЇељУеЙНзЪДз†Фз©ґзГ≠зВєпЉМжѓФе¶ВиВњзШ§дЄ≠TLSдЄНеРМеЕНзЦЂзїЖиГЮжШѓе¶ВдљХеНПи∞ГеПСжМ•еКЯиГљпЉМTLSеЬ®иВњзШ§еЕНзЦЂеТМиВњзШ§йАГйАЄдЄ≠зЪДжЙЃжЉФдљХзІНиІТиЙ≤гАВ еПВиАГжЦЗзМЃпЉЪCONEJO-GARCIA J R, BISWAS S, CHAURIO R, et al. Neglected no more: B cell-mediated anti-tumor immunity [J]. Semin Immunol, 2023, 65: 101707.
