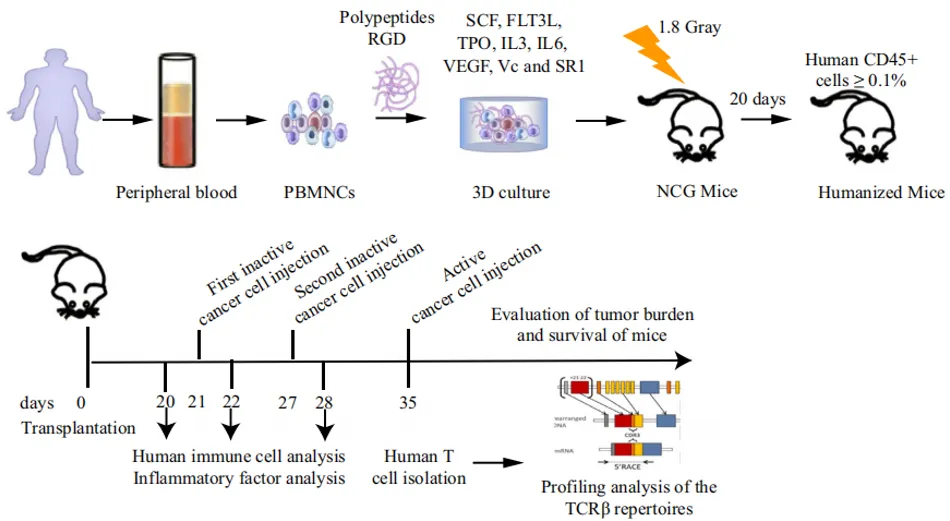
ињСеєіжЭ•пЉМеЫљеЖЕе§ЦеЕНзЦЂж≤їзЦЧеПСе±ХињЕзМЫпЉМ襀聧䪯жШѓзїІжЙЛжЬѓгАБжФЊе∞Дж≤їзЦЧгАБеМЦе≠¶ж≤їзЦЧдєЛеРОпЉМеѓєиВњзШ§жЬЙжШОз°ЃжХИжЮЬзЪДеПИдЄАйЗНи¶Бж≤їзЦЧжЦєж≥ХпЉМеєњж≥ЫеЇФзФ®дЇОе§ЪзІНжБґжАІиВњзШ§зЪДж≤їзЦЧпЉМжѓФе¶ВCAR-TгАБTCR-Tз≠ЙеЈ•з®ЛеМЦTзїЖиГЮеЕНзЦЂзЦЧж≥ХеЈ≤襀иѓБжШОеѓєжЯРдЇЫзЩМзІНеЕЈжЬЙиЙѓе•љзЪДжХИжЮЬгАВдљЖжШѓеЫ†зЉЇдєПиВњзШ§зЙєеЉВжАІпЉМзЫЃеЙНзЪДеЕНзЦЂзЦЧж≥ХжЬЙеЊЕињЫдЄАж≠•жΥ糥еТМз†Фз©ґпЉМдї•еҐЮеЉЇж≤їзЦЧжХИжЮЬгАВиЙЊж≤РиТљеЬ®еЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯжЈ±иАХе§ЪеєіпЉМеПѓеЬ®иѓ•йҐЖеЯЯз†Фз©ґдЄ≠жПРдЊЫзЛђзЙєзЪДжКАжЬѓдЉШеКњгАВ 2024еєі4жЬИ15жЧ•жµЩж±Яе§Іе≠¶еМїе≠¶йЩҐйЩДе±ЮзђђдЄАеМїйЩҐйїДж≤≥йЩҐйХњеЫҐйШЯеЬ®cancer innovationжЭВењЧеПСи°®йҐШдЄЇвАЬEstablishment of a humanized mouse model using¬†steadyвАРstate peripheral bloodвАРderived hematopoietic stem¬†and progenitor cells facilitates screening of¬†cancerвАРtargeted TвАРcell repertoiresвАЭзЪДжЦЗзЂ†пЉМиѓ•з†Фз©ґжПРеЗЇдЇЖдЄАзІНжЦ∞йҐЦз≠ЦзХ•пЉМеИ©зФ®еЕЈжЬЙдЄ™дљУзЙєеЉВжАІеЕНзЦЂжМЗзЇєзЪДдЇЇжЇРеМЦе∞ПйЉ†ж®°еЮЛжЭ•з≠ЫйАЙйЭґеРСзЩМзЧЗзЪДTCR-TзїЖиГЮпЉМдЄЇиЃЊиЃ°жВ£иАЕзЙєеЉВжАІйАВеЇФжАІеЕНзЦЂзЦЧж≥ХжПРдЊЫдЇЖжЦ∞зЪДжАЭиЈѓгАВжЦЗдЄ≠дљњзФ®иЙЊж≤РиТљзЪДImmuHub¬ЃTCRж£АжµЛз≥їзїЯпЉМжΥ糥дЇЖдЇЇжЇРеМЦе∞ПйЉ†ж®°еЮЛеЕНзЦЂеИЇжњАжЭ°дїґдЄЛзЪДеЕНзЦЂзЙєеЊБгАВ

1гАБжФґйЫЖдЇЇз±їе§ЦеС®и°АжЈЛеЈізїЖиГЮпЉМеЬ®дЄЙзїіеЯєеЕїз≥їзїЯдЄ≠жЙ©еҐЮеЗЇеЊ™зОѓйА†и°Аеє≤зїЖиГЮеТМз•ЦзїЖиГЮпЉИcHSPCsпЉЙгАВ 2гАБе∞ЖжЙ©еҐЮеРОзЪДзїЖиГЮеЇФзФ®дЇОжЮДеїЇдЇЇжЇРеМЦе∞ПйЉ†ж®°еЮЛпЉМдљње∞ПйЉ†дљУеЖЕжЛ•жЬЙдЇЇз±їеЕНзЦЂз≥їзїЯзЪДзЙєжАІгАВ 3гАБе∞ЖдЄ§зІНдЄНеРМзЪДиВњзШ§зїЖиГЮз≥їпЉИBзїЖиГЮеЙНдљУзЩљи°АзЧЕзїЖиГЮз≥їеТМдЄЙйШіжАІдє≥иЕЇзЩМзїЖиГЮз≥їпЉЙж≥®еЕ•дЇЇжЇРеМЦе∞ПйЉ†дљУеЖЕпЉМйАЪињЗжµБеЉПзїЖиГЮжЬѓж£АжµЛдЄНеРМжЧґйЧізВєзЪДдЇЇз±їеЕНзЦЂзїЖиГЮз±їеЮЛпЉМеМЕжЛђж†Сз™БзКґзїЖиГЮпЉИDCпЉЙгАБеНХж†ЄзїЖиГЮеТМTзїЖиГЮз≠ЙгАВ 4гАБеѓєеИЖз¶їзЪДдЇЇз±їTзїЖиГЮеПЧдљУпЉИTCRпЉЙќ≤йУЊињЫи°МйЂШйАЪйЗПжµЛеЇПеТМеИЖжЮРгАВ
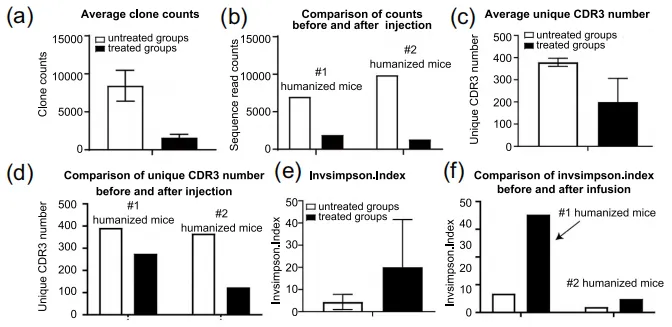
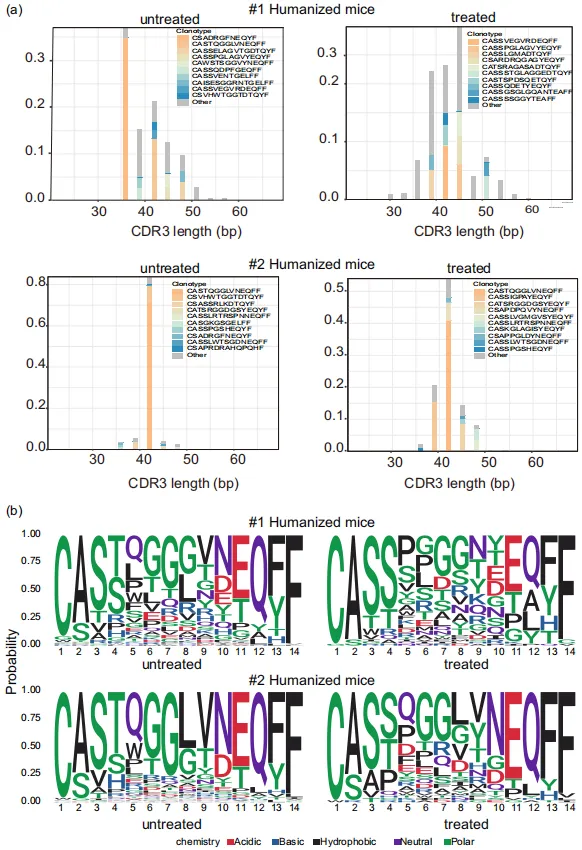
еЫЊ1.еЃЮй™МиЃЊиЃ° йАЪињЗзїЖиГЮеЫ†е≠РеИЖж≥МеК®еКЫе≠¶еИЖжЮРиѓБжШОдЇЖдЇЇжЇРеМЦе∞ПйЉ†ж®°еЮЛзЪДжИРеКЯеїЇзЂЛеТМеЕНзЦЂжњАжіїеРОпЉМдљЬиАЕйАЪињЗDCзїЖиГЮгАБеНХж†ЄзїЖиГЮеТМTзїЖиГЮжЭ•еИЖжЮРзЩМзїЖиГЮиЊУж≥®еРОзЪДеЕНзЦЂеЇФжњАеПНеЇФгАВйАЪињЗжµБеЉПзїЖиГЮеИЖжЮРеПСзО∞пЉМCD14еНХж†ЄзїЖиГЮеѓєеЕНзЦЂеИЇжњАеПНеЇФеЉЇзГИпЉМиАМйЂУз≥їDCзїЖиГЮпЉИmDCsпЉЙеТМжµЖзїЖиГЮж†ЈDCзїЖиГЮпЉИpDCsпЉЙеЬ®зђђдЄАжђ°иЊУж≥®еРОеПЧеИ∞жКСеИґпЉМеРДзІНдЇЇз±їTзїЖиГЮдЇЪзЊ§еЬ®еИЇжњАеРОи°®зО∞еЗЇдЄНеРМзЪДеК®жАБеПШеМЦгАВињЩдЇЫжХ∞жНЃињЫиАМжП≠з§ЇдЇЖеЕНзЦЂз≥їзїЯеѓєдЇЇжЇРеМЦе∞ПйЉ†йЭЮжіїжАІзЩМзїЖиГЮж≤їзЦЧзЪДзІѓжЮБеПНеЇФгАВ дљЬиАЕеїЇзЂЛдЇЖдЄ§зїДдЇЇжЇРеМЦе∞ПйЉ†ж®°еЮЛпЉМйЫМжАІ#1зїДеТМйЫДжАІ#2зїДпЉМжѓПзїДињЫдЄАж≠•еИЖдЄЇжО•еПЧйЭЮжіїжАІзЩМзїЖиГЮиЊУж≥®зЪДе§ДзРЖзїДеТМжЬ™жО•еПЧиЊУж≥®зЪДжЬ™е§ДзРЖзїДгАВ жЬ™е§ДзРЖзїДзЪДеЕЛйЪЖcountsжХ∞еТМзЛђзЙєCDR3ж†ЄйЕЄеЇПеИЧжХ∞йЗПеЭЗйЂШдЇОе§ДзРЖзїДпЉМжЧ†иЃЇжШѓ#1зїДињШжШѓ#2зїДпЉИеЫЊ2a-dпЉЙгАВдљњзФ®InvSimpsonжМЗжХ∞иѓДдЉ∞TCRеЇУе§Ъж†ЈжАІпЉМиѓ•жМЗжХ∞дЊІйЗНдЇОеПНжШ†йЂШйҐСеЕЛйЪЖзЪДе§Ъж†ЈжАІпЉМе§ДзРЖзїДзЪДе§Ъж†ЈжАІжШОжШЊйЂШдЇОжЬ™е§ДзРЖзїДпЉИеЫЊ2eгАБfпЉЙгАВ
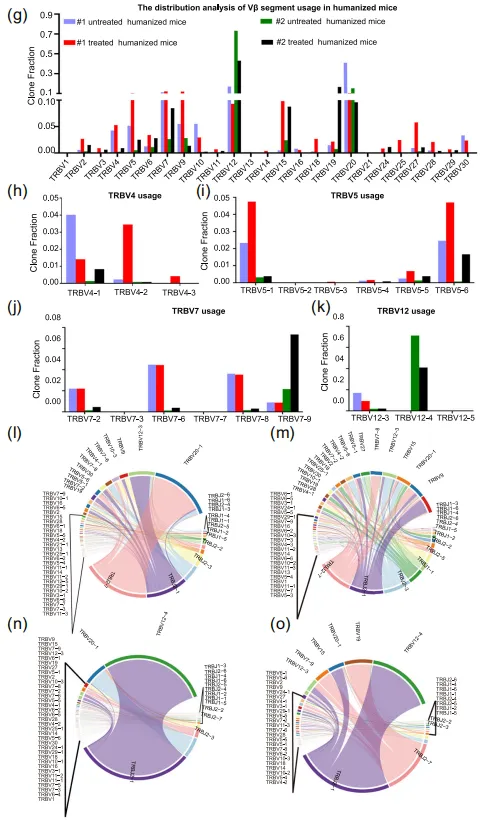
еЫЊ2 зЩМзїЖиГЮеИЇжњАеРОVJеЯЇеЫ†дљњзФ®жГЕеЖµдєЯеПСзФЯдЇЖеПШеМЦпЉИеЫЊ3g-oпЉЙгАВе§ДзРЖзїДзЪДVJеЯЇеЫ†еПКзїДеРИдљњзФ®жГЕеЖµзЫЄдЉЉпЉМи°®жШОеѓєзЫЄеРМжКЧеОЯзЪДеПНеЇФзЫЄдЉЉгАВеП¶е§Це§ДзРЖзїДдЄ≠ж£АжµЛеИ∞дЇЖжЬ™е§ДзРЖзїДдЄ≠ж≤°жЬЙзЪДжЦ∞еЮЛVJеЯЇеЫ†еПКзїДеРИпЉИе¶ВTRBV5-3гАБTRBV1гАБTRB5-3-TRBJ2-1пЉЙпЉМињЩеПѓиГљжШѓеЕНзЦЂзїЖиГЮеПНеЇФзЪДзїУжЮЬгАВињЩеѓєиЃЊиЃ°йТИеѓєзЙєеЃЪиВњзШ§зЪДеЈ•з®ЛеМЦTзїЖиГЮеЕЈжЬЙйЗНи¶БжДПдєЙпЉМе∞§еЕґжШѓжґЙеПКзЙєеЃЪV-JдљњзФ®ж®°еЉПзЪДжЙ©е§ІеМЦTRB V-JйЗНжОТзЙЗжЃµгАВ
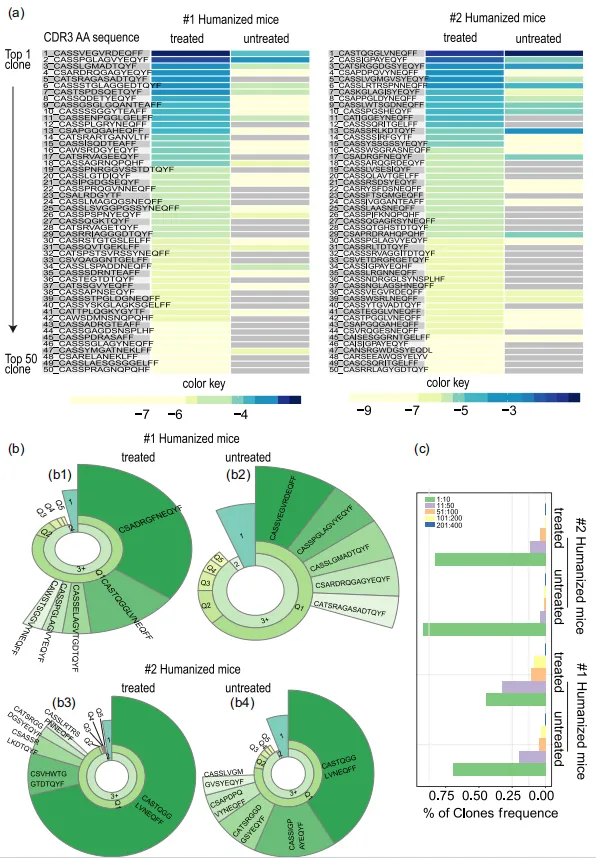
еЫЊ3 еЕЛйЪЖoverlapеИЖжЮРжШЊз§ЇпЉМжЬ™е§ДзРЖзїДе∞ПйЉ†ж†ЈжЬђйЧізЫЄдЉЉеЇ¶йЂШдЇОеРМдЄАдЊЫдљУжЭ•жЇРж†ЈжЬђпЉМиАМе§ДзРЖзїДдєЛйЧіеЈЃеЉВжШЊиСЧпЉИеЫЊ4aпЉЙпЉМи°®жШОзЩМзїЖиГЮеИЇжњАжШЊиСЧељ±еУНдЇЖеЕЛйЪЖеЮЛиМГеЫіпЉМеѓЉиЗіTCR-TзїЖиГЮе§Ъж†ЈжАІеҐЮеК†гАВ дљЬиАЕињЫдЄАж≠•ињЫи°МдЇЖеЕ±дЇЂеЕЛйЪЖеЮЛеИЖжЮРпЉМдї•йЙіеЃЪйАЪињЗдљУеЖЕиЗ™зДґеПНеЇФжЬЇеИґдЇІзФЯзЪДзЩМзЧЗеПНеЇФжАІTCR-TзїЖиГЮгАВеРДзїДдєЛйЧіжЬЙ11дЄ™йЗНеП†зЪДеЕЛйЪЖеЮЛпЉИеЫЊ4bпЉЙгАВ еРДзїДдєЛйЧіеП™жЬЙдљОйҐСйЗНеП†пЉМи°®жШОзЩМзїЖиГЮеИЇжњАеѓєTCR-TзїЖиГЮзЪДе§Ъж†ЈжАІжЬЙзЫЄељУе§ІзЪДељ±еУНгАВиѓ•з≠ЦзХ•жПРдЊЫдЇЖз≠ЫйАЙеЕ≥йФЃзЩМзЧЗеПНеЇФжАІTRB CDR3еЇПеИЧзЪДжЬЇдЉЪпЉМзДґеРОеПѓдї•е∞ЖеЕґеЇФзФ®дЇОеЈ•з®ЛеМЦTзїЖиГЮдљЬдЄЇCAR-TзїЖиГЮзЪДиЃЊиЃ°гАВ еП¶е§ЦйАЪињЗеѓєеЙН15-20дЄ™йЂШйҐСйЗНеП†еЕЛйЪЖеЮЛињЫи°МеИЖжЮРпЉМдљЬиАЕжП≠з§ЇдЇЖзЩМзїЖиГЮеИЇжњАеРОеЄЄиІБзЪДTRBи∞±гАВдЄ§зїДдЇЇжЇРеМЦе∞ПйЉ†еИЇжњАеЙНеРОзЪДйЂШйҐСеЕ±дЇЂеЕЛйЪЖзЪДйҐСзОЗеПСзФЯдЇЖеЊИе§ІеПШеМЦпЉИеЫЊ4cпЉМdпЉЙгАВдЄАдЇЫеЕЛйЪЖеЬ®е§ДзРЖеРОеѓМйЫЖпЉМињЩжДПеС≥зЭАеИЇжњАеѓЉиЗіеЃњдЄїеЗЇзО∞TзїЖиГЮеПНеЇФгАВ

еЫЊ4 ињљжЇѓе§ДзРЖзїДзЪДTOP50еЕЛйЪЖеЬ®жЬ™е§ДзРЖзїДж†ЈжЬђдЄ≠зЪДйҐСзОЗеИЖеЄГпЉМеПСзО∞ињЩдЇЫеЕЛйЪЖеЬ®жЬ™е§ДзРЖзїДдЄ≠йҐСзОЗиЊГдљОжИЦж£АжµЛдЄНеИ∞пЉИеЫЊ5aпЉЙпЉМи°®жШОзЩМзїЖиГЮиЊУж≥®еИЇжњАдЇІзФЯдЇЖжЦ∞зЪДTзїЖиГЮеЕЛйЪЖеЮЛпЉМеєґињЫдЄАж≠•дњГињЫдЇЖеЃГдїђзЪДдЉШеЕИжЙ©еҐЮпЉМеЫ†ж≠§жИРдЄЇе§ДзРЖзїДдЄ≠зЪДдЉШеКњеЕЛйЪЖгАВеЫЊ5bзЪДиЬЧзЙЫеЫЊдєЯиѓіжШОдЇЖзЩМзїЖиГЮиЊУж≥®еРОеОЯжЬђзЪДдЉШеКњеЕЛйЪЖжЙ©еҐЮз®ЛеЇ¶еҐЮеЉЇжИЦеЗЇзО∞дЇЖжЦ∞зЪДдЉШеКњеЕЛйЪЖгАВTOP10еЕЛйЪЖзЪДйҐСзОЗеН†жАїйҐСзОЗзЪД50%дї•дЄКпЉИеЫЊ6cпЉЙгАВ
еЫЊ6 CDR3ж†ЄиЛЈйЕЄйХњеЇ¶иМГеЫіеСИж≠£жАБеИЖеЄГпЉИйЂШжЦѓеИЖеЄГпЉЙпЉИеЫЊ7aпЉЙпЉМеЬ®жЙАжЬЙзїДдЄ≠иМГеЫіеЭЗеЬ®35bpиЗ≥45bpдєЛйЧігАВињШиІВеѓЯеИ∞йЂШжЦѓCDR3ж∞®еЯЇйЕЄйХњеЇ¶еИЖеЄГж®°еЉПпЉМCDR3еМЇеЯЯзЪДеЯЇеЇПеИЖжЮРжШЊз§ЇпЉМTзїЖиГЮзЪДж∞®еЯЇйЕЄдљњзФ®дЄНеРМпЉМзЩМзїЖиГЮеИЇжњАеѓЉиЗіж∞®еЯЇйЕЄдљњзФ®зЪДжШЊзЭАеПШеМЦпЉИеЫЊ7bпЉЙгАВ
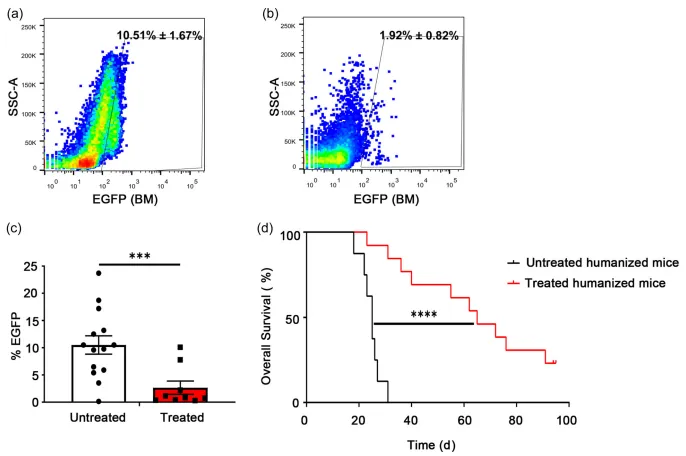
еЫЊ7 дЄЇдЇЖиѓДдЉ∞жЧ†жіїжАІзЩМзїЖиГЮиЊУж≥®жШѓеР¶еѓєиВњзШ§еЉВзІНзІїж§НзЙ©зЪДзФЯйХњеТМе∞ПйЉ†зЪДе≠ШжіїдЇІзФЯељ±еУНпЉМз†Фз©ґдЇЇеСШеРСе∞ПйЉ†ж≥®е∞ДжіїзЪДNAML-6-EGFPеТМMDA-MB-231-EGFPзїЖиГЮпЉМйАЪињЗзЫСжµЛеЩ®еЃШдЄ≠EGFPи°®иЊЊжЭ•иѓДдЉ∞иВњзШ§иіЯиНЈпЉИеЫЊ8a-cпЉЙгАВжµБеЉПзїЖиГЮжЬѓзїУжЮЬжШЊз§ЇпЉМжЬ™е§ДзРЖзЪДдЇЇжЇРеМЦе∞ПйЉ†й™®йЂУгАБиВЭиДПеТМиДЊиДПдЄ≠иВњзШ§зїЖиГЮжѓФдЊЛйЂШиЊЊ10.51% ¬±1.67%пЉМжПРз§ЇињЩдЇЫеЩ®еЃШеПѓиГљжШѓиВњзШ§зїЖиГЮе≠ШжіїзЪДеЊЃзОѓеҐГгАВжЧ†жіїжАІзЩМзїЖиГЮжО•зІНзїДе∞ПйЉ†дЄ≠иВњзШ§зїЖиГЮжХ∞йЗПжШЊиСЧеЗПе∞СпЉМжЪЧз§ЇеЬ®дЇЇжЇРеМЦе∞ПйЉ†ж®°еЮЛдЄ≠пЉМдљњзФ®жЧ†жіїжАІзЩМзїЖиГЮињЫи°МеЕНзЦЂжО•зІНеПѓиГљжЬЙжХИжКСеИґиВњзШ§зФЯйХњгАВзФЯе≠ШжЫ≤зЇњеИЖжЮРпЉИеЫЊ8dпЉЙжШЊз§ЇпЉМзїПињЗеЕНзЦЂжО•зІНзЪДдЇЇжЇРеМЦе∞ПйЉ†зФЯе≠ШжЬЯжШЊиСЧеїґйХњпЉМзФЯе≠ШзОЗйЂШдЇОеѓєзЕІзїДгАВ
еЫЊ8 жЬђз†Фз©ґйАЪињЗеИ©зФ®з®≥жАБе§ЦеС®и°АжЭ•жЇРзЪДcHSPCsеїЇзЂЛдЇЇжЇРеМЦе∞ПйЉ†ж®°еЮЛпЉМдЄЇз≠ЫйАЙйТИеѓєзЩМзЧЗзЪДTCR-TзїЖиГЮеЇУжПРдЊЫдЇЖжЦ∞йАФеЊДгАВеЯЇдЇОйЂШйАЪйЗПTCRжµЛеЇПпЉМдЄНдїЕеЬ®еИЖе≠Рж∞іеє≥дЄКйЙіеЃЪдЇЖжМЗеРСзЩМзЧЗжКЧеОЯеТМеЕЛйЪЖзЙєеЊБзЪДеПѓеПШеЇПеИЧпЉМињШйЙіеЃЪдЇЖиГље§ЯйЭґеРСзЩМзїЖиГЮзЪДзЩМзЧЗзЙєеЉВжАІTCR-TзїЖиГЮгАВйАЪињЗжѓФиЊГйЭЮжіїжАІзЩМзїЖиГЮиЊУж≥®еЙНеРОзЪДCDR3еЇПеИЧпЉМжП≠з§ЇдЇЖдЇЇжЇРеМЦе∞ПйЉ†дЄ≠TCR-TзїЖиГЮзЪДе§ЪзІНеЇПеИЧеПШеМЦеТМеЕНзЦЂе≠¶зЙєеЊБгАВињЩжЬЙеК©дЇОиЃЊиЃ°дЄ™жАІеМЦзЪДеЈ•з®ЛTзїЖиГЮпЉМжЬЙжЬЫеЬ®зЩМзЧЗж≤їзЦЧдЄ≠еПСжМ•йЗНи¶БдљЬзФ®гАВ жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљйЩЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂй©±еК®еМїе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДеЯЇеЫ†йЂШйАЪйЗПжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇNGS-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛSeq-MRD¬ЃпЉМеєґжОИжЭГж≥ЫзФЯе≠РдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-Traq¬ЃиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq¬Ѓ¬†|TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHub¬ЃеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier¬ЃиВњзШ§жЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TеТМжКЧдљУеПСзО∞з≠Йеє≥еП∞зЃ°зЇњгАВзЫЃеЙНдЄЇж≠ҐеПСи°®дЇЖжХ∞еНБзѓЗиЃЇжЦЗпЉМеЕґдЄ≠еМЕжЛђпЉЪNature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24), Nature Communications (IF:17)з≠Йе§ЪзѓЗйЂШеИЖжЭВењЧгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВиЙЊж≤РиТљдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХгАВ
