本篇论文对最新的TCR 二代测序(NGS)方法与常用的毛细管电泳(CE)方法进行了比较。NGS克隆性测定在用于初诊诊断目的时,与基于CE的测定具有相似的灵敏度,但CE测定显示相同大小的不同克隆重排不容易被区分,而NGS方法具有更高的特异性,能够检测到具体的克隆序列,结果更为准确。这将有利于使用NGS替代CE方法,进行初诊诊断的克隆检测。

克隆性检测是t淋巴细胞增生性疾病检查的一个重要组成部分。基于PCR的检测已成为T细胞克隆性评估的标准方法,利用共识引物扩增大部分TCR重排,随后通过毛细管电泳(CE)解析片段,以分析片段的分布模式。但是这种方法具有一些技术和实践限制,比如解释电泳迁移模式的限制,还有这种类型的测定也不提供已鉴定克隆重排的序列信息,并且样品之间的比较基于片段大小,其特异性有限,此外PCR/CE本质上不是定量的,因此不能用于MRD监测。
二代测序(NGS)技术使相对少量的起始材料能够进行高通量测序,并为克隆性评估和监测先前鉴定的克隆带来了独特的优势。
该研究评估了CE和NGS用于TRG克隆性分析的一致性和差异性,验证了基于NGS的TRG检测的稳健性能,并确定了与CE检测设计相关的潜在缺陷。对斯坦福卫生保健中心收集的各种患者样本进行检测,本研究共选取101份既往采用PCR/CE分析的DNA样本(包括48份外周血、46份福尔马林固定石蜡包埋(FFPE)组织和7份骨髓抽吸标本)。
1.收集患者样本
2.稀释研究
3.DNA提取和定量
4.PCR扩增与毛细管电泳-基于TRG克隆性分析
5.基于NGS的TRG基因重排分析
6.NGS数据分析与解释
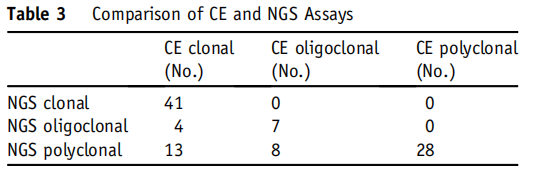
表3
表3总结了NGS结果以及它们与CE结果的比较。101个样本中有76个样本的NGS和CE具有一致性,总体分析准确率为75%。76个一致样本中,41个为单或双等位基因重排,7个为寡克隆,28个为多克隆。
以双管CE检测结果为确定克隆性的金标准,NGS检测的分析特异性为100%。
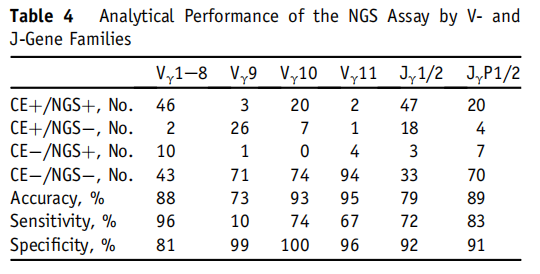
表4
为了进一步比较CE和NGS的结果,并探讨不一致的可能原因,作者对两种方法鉴定的V和J基因进行了检测。NGS确定的克隆序列的V-J基因同一性与CE推断的83%样品V基因峰一致(表4).
临床敏感性、特异性和准确性
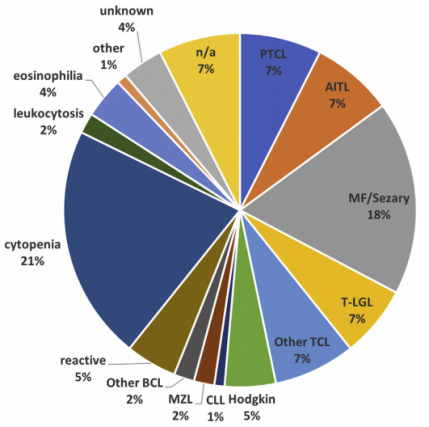
图1
注:本研究中纳入的患者的临床病理诊断。AITL血管免疫母细胞T细胞淋巴瘤,BCL b细胞淋巴瘤,CLL慢性淋巴细胞白血病,MF真菌病,MZL边缘区淋巴瘤,PTCL外周T细胞淋巴瘤,TCL T细胞淋巴瘤,T-LGL T细胞大颗粒淋巴细胞白血病。
图1总结了通过评估病理学和临床结果来确定的临床病理诊断。CE检测的临床敏感性为91%,特异性为75%,总的准确性为83%。NGS检测的临床敏感性为73%,特异性为91%,总体准确性为82%。
CE和NGS结果不一致的病例分析
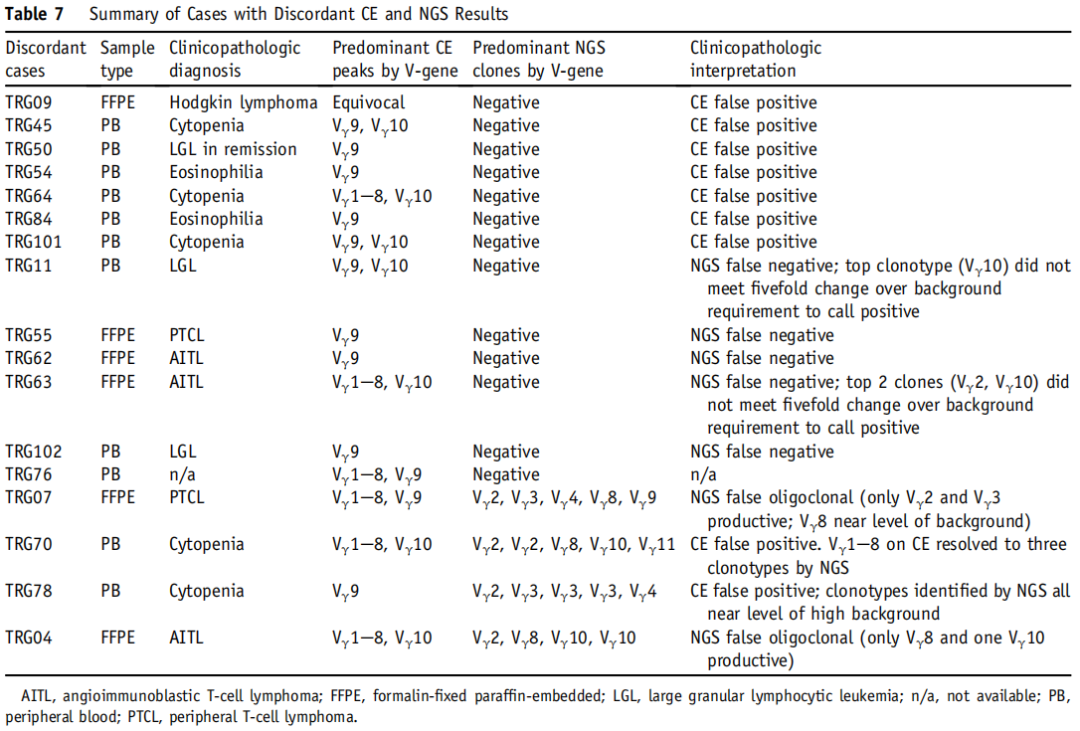
表7
CE和NGS结果不一致的病例总结如上表。二者的差异主要归因于双管CE检测与NGS检测的单管设计所导致的不完全的多克隆对称性。
在25个不一致的样本中,13个被CE解释为克隆,但被NGS称为多克隆。其中7例未显示任何血液淋巴样恶性肿瘤的临床病理证据,提示CE结果可能是假阳性。有临床病理证据支持的5个克隆样本中存在克隆t细胞恶性肿瘤,提示这些NGS结果可能是假阴性。最后一个CE阳性NGS阴性的样本没有临床病理学证据可供审查。
4个样本被CE称为克隆,但被NGS称为寡克隆。其中2例无血液淋巴样恶性肿瘤的临床病理证据,提示CE结果可能是假阳性。另两个样本显示CE鉴定的两个主峰和NGS鉴定的多种显著性克隆型,可能代表双克隆过程。这突出了CE检测的一个重要局限性,即在CE上显示相同大小的不同克隆重排不容易被区分。而NGS可以通过其独特的序列来区分这些克隆型。
8个样本被CE鉴定为寡克隆,NGS为多克隆。所有这些样本经CE检测均有Vγ9峰,但没有任何血液淋巴恶性肿瘤的临床病理证据。
59%的不一致样本涉及Vγ9的克隆CE峰,而NGS不视为主要的克隆型。有4例Vγ9重排不一致的病例通过单管TRG CE方法进一步证实为阴性。NGS检测通过其单管设计有效地解决了这一限制,在这种设计中,在包含所有可能重排的更稳健的多克隆背景下,不太可能出现虚假重排。事实上,根据我们的临床病理相关性,没有一个NGS结果被归因为假阳性。在排除潜在的CE假阳性结果后,NGS检测的总体准确率为89%,敏感性为79%,特异性为100%。
NGS克隆性测定在用于初诊诊断目的时,与基于CE的测定具有相似的灵敏度,但CE测定显示相同大小的不同克隆重排不容易被区分,而NGS方法具有更高的特异性,能够检测到具体的克隆序列,结果更为准确。这将有利于使用NGS替代CE方法,进行初诊诊断的克隆检测。
Chandler C Ho , Jack K Tung , James L Zehnder ,Bing M Zhang. Validation of a Next-Generation Sequencing-Based T-Cell Receptor Gamma Gene Rearrangement Diagnostic Assay: Transitioning from Capillary Electrophoresis to Next-Generation Sequencing. J Mol Diagn. 2021 Jul;23(7):805-815.
Seq-MRD®介绍
技术原理
检测类型
1.癌细胞克隆性检测
通过患者初诊或癌细胞高负荷时的骨髓样本,找到癌细胞特有的DNA“标签”序列。
2.MRD追踪检测
利用筛查出的DNA“标签”序列,在治疗期间或治疗后评估MRD水平,监测癌细胞含量,同时检测识别新出现的癌细胞序列。
适用人群
1. B系血液系统癌症
急性/慢性B淋巴细胞白血病、多发性骨髓瘤、B型淋巴瘤。
2. T系血液系统癌症
急性/慢性T淋巴细胞白血病、T型淋巴瘤。
意义
Seq-MRD®能提供高精度、高灵敏度的MRD检测解决方案,可帮助医生更准确地评估癌症患者的治疗反应和预后。这些技术在现代肿瘤治疗中扮演着越来越重要的角色,因为它们能够帮助医生识别那些患病复发风险高的患者,并为他们提供更个性化、更有针对性的治疗方案。
杭州艾沐蒽生物科技有限公司成立于2016年,是国内前沿的专注于免疫基因组学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子(纳斯达克代码:GTH)使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®疾病早筛、单细胞测序、TCR-T药物开发等平台管线。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。
艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。


