●肾移植是治疗终末期肾脏疾病的方法之一,然而,患者在接受肾移植后仍然面临着免疫排斥和免疫相关并发症的风险。免疫反应的发生和演化是肾移植后患者预后和移植器官生存的关键因素。传统的研究方法往往无法提供对免疫反应全面的了解,因此需要采用更加先进的技术来揭示其中的细节。
●免疫组库技术在肾移植后免疫反应研究中的应用:
免疫组库技术基于高通量测序技术,能够对免疫系统中的T细胞和B细胞受体进行全面的分析。通过免疫组库技术,可以获得大量的T细胞受体和B细胞受体的序列信息,并对其多样性和克隆动态进行分析。这使得我们能够深入了解肾移植后免疫反应的发生与演化。
#1

标题:Characterizing pre-transplant and post-transplant kidney rejection risk by B cell immune repertoire sequencing
通过B细胞免疫库测序描述移植前和移植后的肾排斥风险
发表期刊:Nature Communications
发表日期:2019年4月
影响因子:17.694
01
样本
来自27例特殊患者的83份外周血样本
02
背景
在研究中通过BCRseq来描述外周血免疫库,移植后发生排斥反应的个体在移植前免疫库具有更高多样性,在24个月的随访中也显示出某些克隆和IGHV基因的扩增。这些结果不仅有助于预测移植前排斥风险,还对检测引起排斥反应的特定抗原有具有临床意义。
03
实验方法学
BCRseq
分析
04
结果
1
B细胞免疫库测序
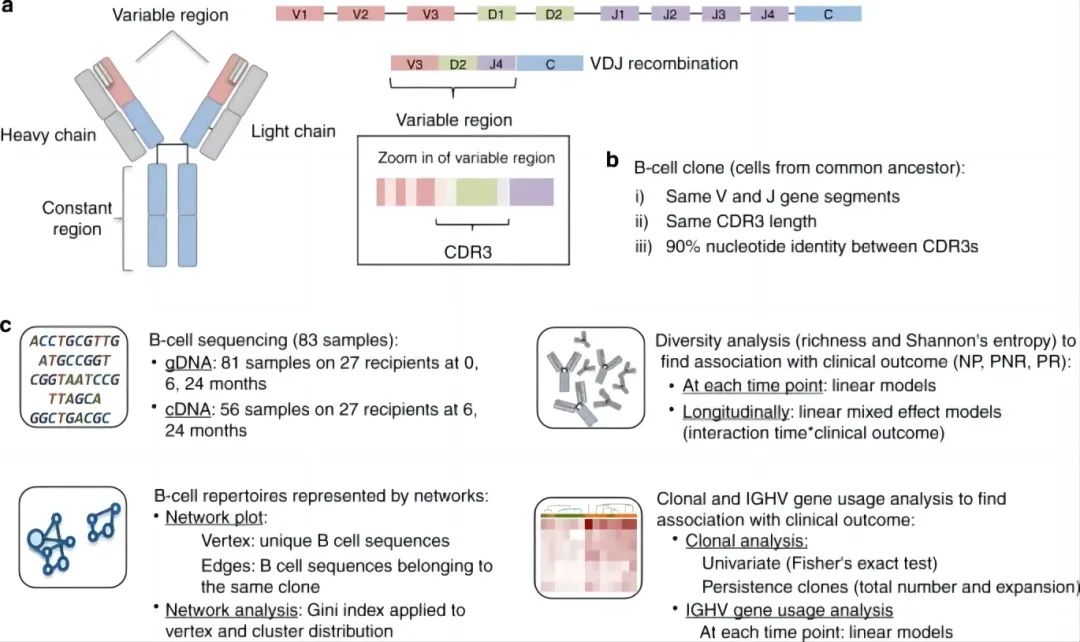
图1
如图1C所示,作者使用线性回归模型,将克隆数量或熵作为因变量,临床结果或SHM作为独立因素变量,考虑物种丰富度(独特克隆数量)和香农熵(方法中的方程(1))跨时间点和临床结果,检查了B细胞免疫库多样性。
2
移植前B细胞多样性与肾器官排斥反应有关。
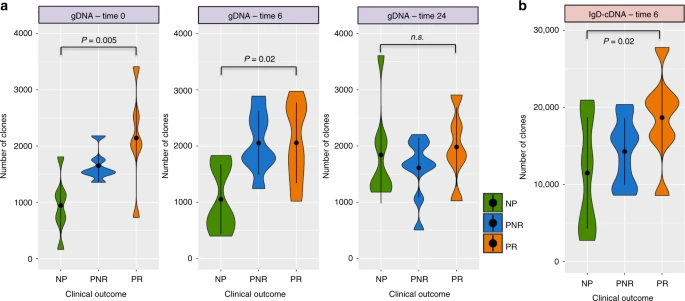
图2
肾移植前,PR组的器官多样性显著高于NP组(丰富度:p值= 0.005,熵值:p值= 0.01),移植后6个月,PR组的器官多样性也显著高于NP组(丰富度:p值= 0.02,熵值:0.01)。p值= 0.02),移植后2年没有明显的组间差异(图2a和补充图2)。
移植后的cDNA测序数据显示,移植后6个月的免疫库多样性也有同样的趋势,主要是IgD同种型(丰富度:p值= 0.02,熵值:p值= 0.03)(图2b和补充图2)。
不同的人口统计学和临床变量,如受体年龄、性别、种族、供体来源、免疫抑制类型、HLA错配和肾功能衰竭的原因等数据没有混杂效应。由于1岁儿童(数据中的最小年龄)和19岁儿童(数据中的最大年龄)的B细胞反应不同,随后进行了排除这两名患者的敏感性分析,结果仍然显著(NP vs. PR在时间0:丰富度:p值= 0.01,熵值:p值= 0.03)。在免疫库多样性的另一项测量中,通过评估SHM,定义了每个V基因片段的突变频率,发现移植前PR的SHM数量呈较高趋势,移植后6个月PR的IgD同型SHM数量呈较高趋势(p值= 0.06)。
3
B细胞多样性临床结果会随时间变化。
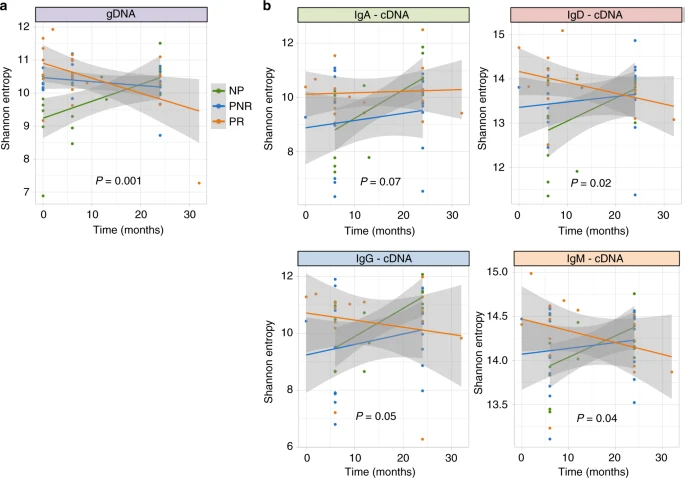
图3
免疫库多样性临床结果可能随着时间的推移而改变,考虑临床结果和时间之间存在相互作用,作者使用线性混合效应模型对纵向数据进行建模。
结果发现,NP和PR在移植后的不同时间表现不同,NP的多样性增加,PR的多样性减少,而PNR的多样性在不同时间保持不变。这在gDNA(丰富度:p值=0.007,熵值:p值=0.001,图3a)和cDNA的所有同型中都观察到了,其中IgM和IgD的熵值差异最显著(IgA: p值=0.07,IgD: p值=0.02,IgG: p值=0.05,IgM: p值=0.04,图3b)。
具有相应p值的丰富度图如图3所示。如图中所示,每个人在32个月的时候存在多出的样本,这些样本可能会扭曲结果,因此进行敏感性分析,将该样本从分析中排除,并观察到除了IgG和IgM亚型外的类似结果,已经没有意义(gDNA-熵:p值=0.004)。cDNA entropy: IgA: p值=0.1,IgD: p值=0.05,IgG: p值=0.08,IgM: p值=0.1)。
4
B细胞网络在克隆扩增上存在差异
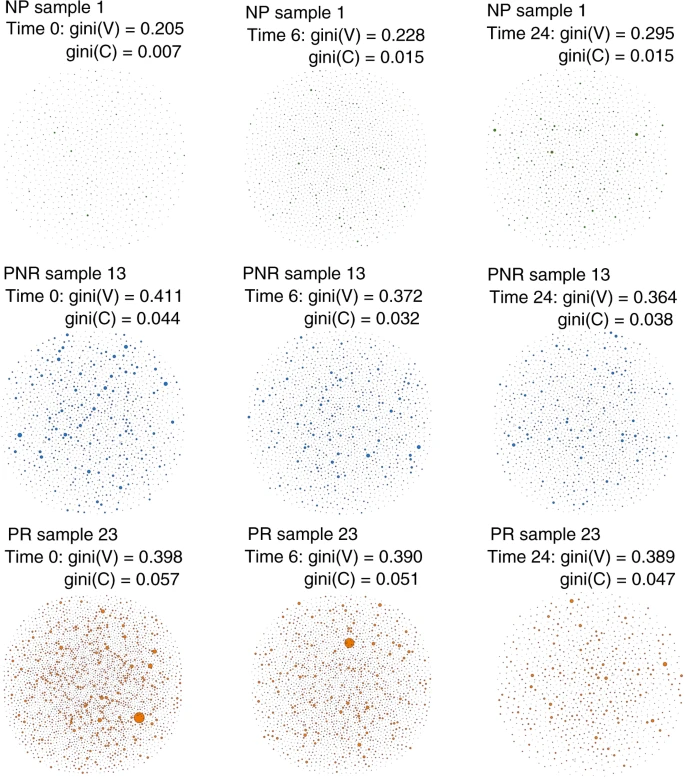
图4
B细胞库可以展示为序列多样性的网络。在数据中,作者为每个样本开发了一个视觉网络(图4和补充图5-7),其中每个顶点代表一个唯一的BCR,并且基于其核苷酸序列的相同BCR的数量定义了顶点大小。
当它们属于同一个克隆时,顶点之间存在一条边,因此B细胞集群可以显示为一组相互连接的顶点,形成一个克隆。为了量化网络,使用了基尼指数,这是一种应用于顶点和聚类分布的不均匀度量。当应用于顶点大小Gini(V)时,表示整体克隆性质。如果Gini(V)接近于1,顶点是不相等的,表明其中一些顶点是扩展的,否则接近于0。当应用于簇大小时,基尼(C)表示克隆优势。如果接近1,集群是不相等的,因此代表优势克隆,如果接近0,所有集群大小相等。
在图4中,展示了三个临床结果组在三个不同时间点(移植前、移植后6个月和24个月)代表性B细胞库之间视觉和数量显著差异。在PR库中,与NP相比,大量形成更多更大克隆簇的B细胞序列存在,而PNR位于两者之间。随着时间的推移,PR组与NP组相比,BCR和特殊克隆的数量有所减少。本研究中每个个体的详细B细胞网络如图5-7所示。在NP组发生PTLD的个体中,观察到非常多样化的B细胞网络模式(补充图5),移植前没有B细胞扩增,6个月后B细胞增加,移植后24个月出现明显的克隆扩增,同时多样性下降。
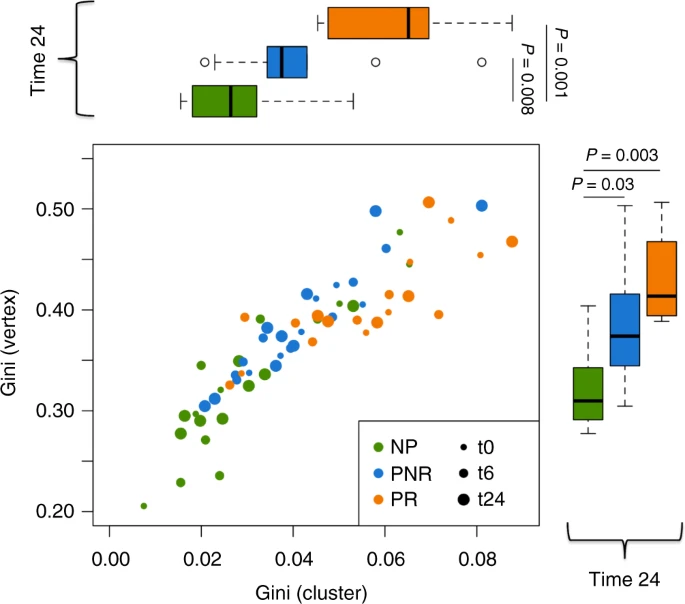
图5
在基尼指数测量的进一步评估中(图5),PR组在顶点和簇的测量值均明显高于NP组,这表明PR组患者在基线时具有更高的克隆扩增。
以及移植后优势克隆子集的进一步扩展(p值[线性回归]<0.05,图5)。如前所述,PNR组介于NP和PR之间,尽管在time24时,这一时间与NP组有显著差异(p值[线性回归]<0.05)。虽然图5的数据是由gDNA数据生成的,但cDNA的IgM同型显示出相同的差异(p值[线性回归]=0.05)(补充图8)。
5
某些克隆和IGHV基因与器官排斥反应有关。
作者不仅通过临床结果来描述B细胞库,还提供移植前和移植后免疫反应的全局图像,数据也使作者能够在克隆和IGHV基因水平上进行Ig序列特异性分析。
对于克隆分析,通过评估了每个时间点存在或不存在每个特定克隆(共118,223个克隆)与临床结果(PR, PNR, NR)的关系。应用Fisher精确检验,分别发现8个、4个和21个克隆在名义上与0、6和24个月的临床结果相关(补充表1)。但没有一个克隆通过多次测试修正,由于在具有数千个参数(克隆)的分析中样本量有限,所以缺乏有效性。可以观察到,只有PR组患者之间存在少数接近显著性(p值< 0.05)的克隆,并在移植后24个月富集。
作者还考虑了在每个临床结果中是否有一些克隆在采样时间内持续存在,而不是其他克隆(补充图9)。考虑了两种不同的测量方法:(1)持续克隆的数量和(2)克隆扩增。观察到,在PR中持续存在的无性系数量显著增加(p值[线性回归]= 0.01,PR vs. NP),并呈现出持续存在无性系数量增加的趋势(p值[线性回归]= 0.09)。
通过进一步研究了在每个临床结果,这些持久克隆可能存在不同个体之间共享。在检测到的263个持久性克隆中,有23个是跨个体共享的。5个在同一PNR中共享,6个在PR组中共享,NP组之间没有共享克隆。总的来说,随着时间的推移,两组进行性慢性移植损伤和纤维化患者(PR和PNR)共有12个共享克隆。
接下来进行IGHV基因分析,查看每个样本的IGHV基因使用情况,定义每个IGHV基因使用的次数,通过克隆数量归一化(以避免某些IGHV基因的采样偏差),过滤掉低表达基因(至少10%的样本中IGHV基因使用> 0.05),并应用线性回归模型在每个时间点找到与每个临床结果相关的基因。
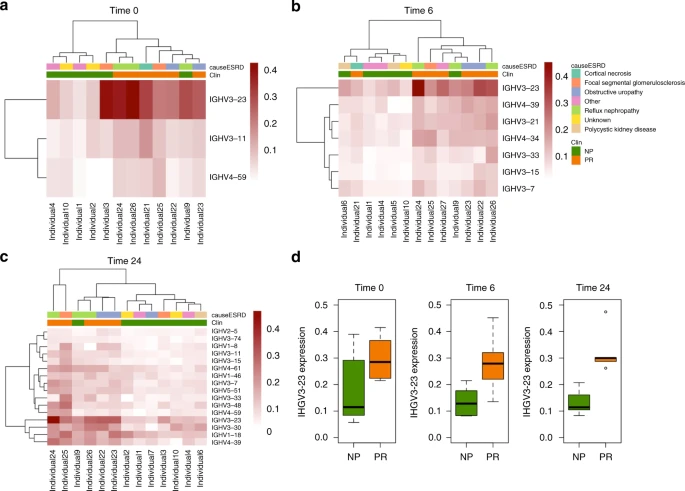
图6
从27个低表达IGHV基因中筛选,发现PR组和NP组之间存在显著基因(p值< 0.05),其中time 0有3个基因,time 6有7个基因,time 24有16个基因(图6a-c)。在这些基因中,第0时有1个基因(IGHV3-11),第6时有5个基因(IGHV3-7、IGHV3-15、IGHV3-21、IGHV3-23、IGHV4-39),第24时有16个基因(IGHV1-8、IGHV1-18、IGHV1-46、IGHV25、IGHV3-7、IGHV3-11、IGHV3-15、IGHV3-30、IGHV3-33、IGHV3-74、IGHV4-39、IGHV4-59、IGHV4-61、IGHV5-51)。
通过了错误发现率(FDR)多次检测校正。发现在NP与PR的比较中,IGHV3-23在所有三个时间点上都是最显著和最丰富的基因(时间0:p值=0.04,时间6:p值=0.003,时间24:p值=0.02)(图6d)。
此外,为了评估之前克隆分析中共享序列IGHV3-23序列过度表达。使用Fisher精确检验的富集分析,IGHV3-23序列在个体间共享的持久克隆(补充表2)(p值<2.2×10−16)和第24时间临床结果相关的克隆(补充表1)(p值<2.2×10−16)中均显著表达。通过观察到NR组中的个体9,在之前的分析中发现与进展者共享一些持久克隆,在所有时间点都归为PR组。不同的人口统计学和临床变量,如受体年龄、性别、种族、供体来源、免疫抑制类型、HLA错配和肾功能衰竭的原因等数据没有混杂效应。此外,该基因在移植后24个月基于cDNA的IgM (p值[线性回归]=0.008)和IgD (p值[线性回归]=0.05)同型中也显著存在,与之前的结果一致,PR组中这两个同型的富集程度最高。在IgD和IgM同种型中,只有3个基因在移植后24个月的cDNA分析中具有显著性(IgD中的IGHV3-15和IGHV461, IgM中的IGHV4-39)。
05
讨论
作者的数据显示,在个体中移植前多样性越高,存在排斥倾向越高,这对预测移植前排斥风险,免疫抑制选择和临床护理实践具有重要的意义。经过24个月的随访,在排斥组中观察到随着时间的推移,多样性总体减少,同时某些克隆的持续存在和扩增,以及几种IGHV基因的高使用,这也暗示了特定的共同抗原可能导致排斥。需要特别关注的是IGHV3-23基因的在排斥患者中使用增加,因为它以前与肾移植有关,并且也是可能导致排斥过程的重要组成部分。本研究对器官移植中的B细胞免疫库进行了分析,运用了更多的研究来证实这些发现,因为它们可能在预测、控制、监测和治疗肾排斥反应方面具有临床意义。
#2

标题:Effects of Reduced-Dose Anti-Human T-Lymphocyte Globulin on Overall and Donor-Specific T-Cell Repertoire Reconstitution in Sensitized Kidney Transplant Recipients
低剂量抗人T淋巴细胞球蛋白对抗体敏感的肾移植受者整体和供者特异性T细胞库重建的影响
发表期刊:Frontiers in Immunology
发表日期:2022年2月
影响因子:8.79
01
样本
对5例接受1.5 mg/kg ATLG诱导治疗7天的肾移植受者和5例接受2 × 20 mg basiliximab(巴利昔单抗)诱导治疗的患者,在移植前和移植后1、3和12个月内外周单核细胞取样。
02
背景
肾移植前已被致敏的患者在肾移植后发生排斥反应的风险更高,因此接受抗人T淋巴细胞球蛋白(ATLG)的淋巴消耗诱导治疗,而许多地方,非致敏的患者则接受basiliximab(巴利昔单抗)的诱导治疗。然而,免疫细胞再生的时间和整体以及对供体反应性T细胞受体(TCR)特异性的影响仍不清楚。
03
实验方法学
a)T细胞表型特征分析
b)混合淋巴细胞反应(MLR)
c)TCR测序
d)特异性识别
e)统计方法
04
结果
1
整体和供体反应性TCR免疫库
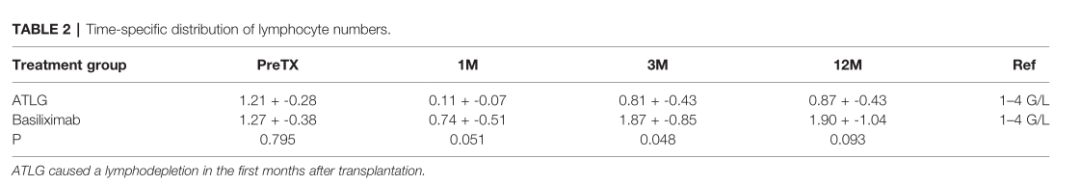
肾移植后诱导治疗后,ATLG组在第一个月内平均淋巴细胞耗损达到0.11+-0.07 G/L。队列中的淋巴细胞减少状态持续了至少14天,其中2例患者在310天淋巴细胞计数恢复到>1G/L, 3例患者在整个观察期内淋巴细胞计数持续减少。巴利昔单抗治疗组的淋巴细胞计数在移植后的第一个月也有所下降,但在随后的时间点中所有受试者的淋巴细胞计数均上升至>1G/L(表2)。移植后12个月通过肾小球滤过率(eGFR)估计的移植功能在两组之间没有差异(ATLG组:64+-18ml/min/1.73m²,巴利昔单抗治疗组:53+-12 ml/min/1.73m²;P=0.23)。
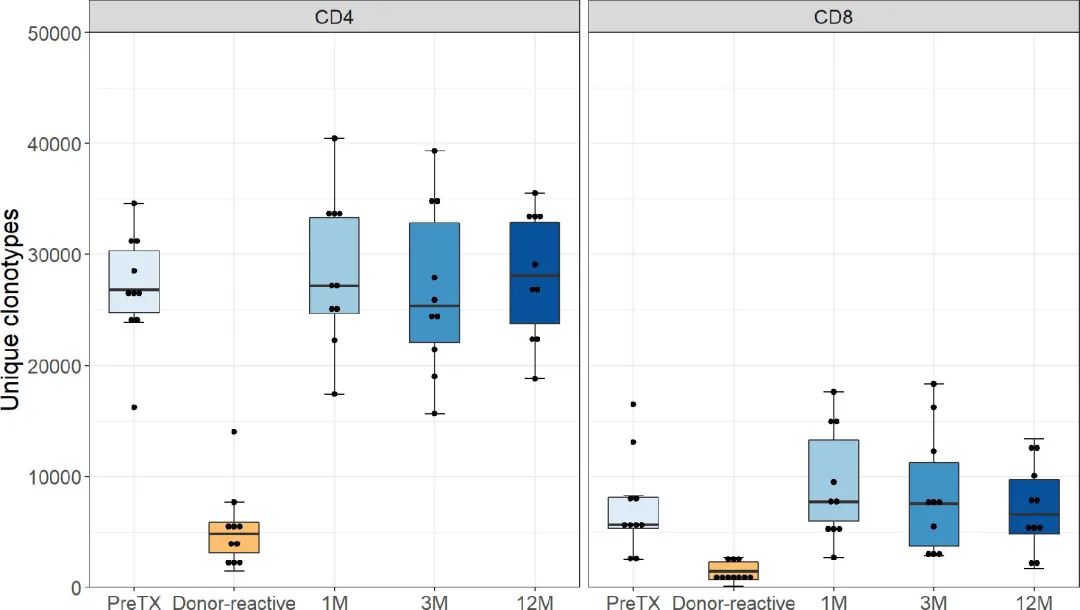
图1
通过对TCRβ链的NGS测序,移植后检测到的TCR克隆型的绝对数量与两组移植前在所有时间点相当,CD4细胞为26,328至107,735,CD8 T细胞为7,184至87,533。采样后剩余的克隆型数量如图1所示。
结果表明,正如预期的那样在两组人群中,MLR后定义的基因库显示的克隆型数量低于未刺激的基因库。
在接受ATLG治疗的预致敏患者组中,通过FACS分析的T细胞表型特征显示,患者的免疫细胞组成具有高度异质性。患者在移植前初始T细胞数量减少,中枢记忆CD4 T细胞数量增加。大多数患者近期胸腺移植物数量下降,表明减少剂量的ATLG足以实现胸腺淋巴细胞的清除。
对CD4和CD8T细胞的分析显示了与淋巴消耗诱导疗法特征一致,但CD4/CD8比值的倒置只是轻微的(补充图3-6)。
2
TCR克隆性特征
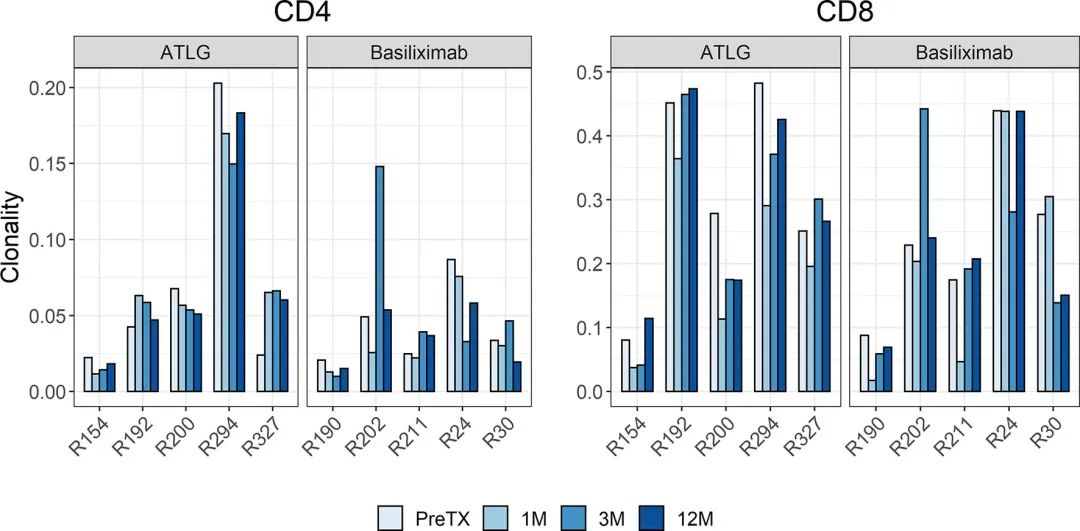
图2
TCR的多样性表现出广泛的个体差异。两组移植前克隆性无差异,ATLG组CD4和CD8 T细胞的克隆性均值分别为0.07和0.31,巴利昔单抗治疗组CD4和CD8T细胞的克隆性均值分别为0.04和0.24。移植后样本的克隆性保持了个体差异性,CD4阳性T细胞和CD8阳性T细胞随时间的变化在两组间无统计学差异(CD4:F(1.45, 11.6)=0.64 p= 0.496;CD8: F(3,24)=0.60 p=0.620)(图2)。
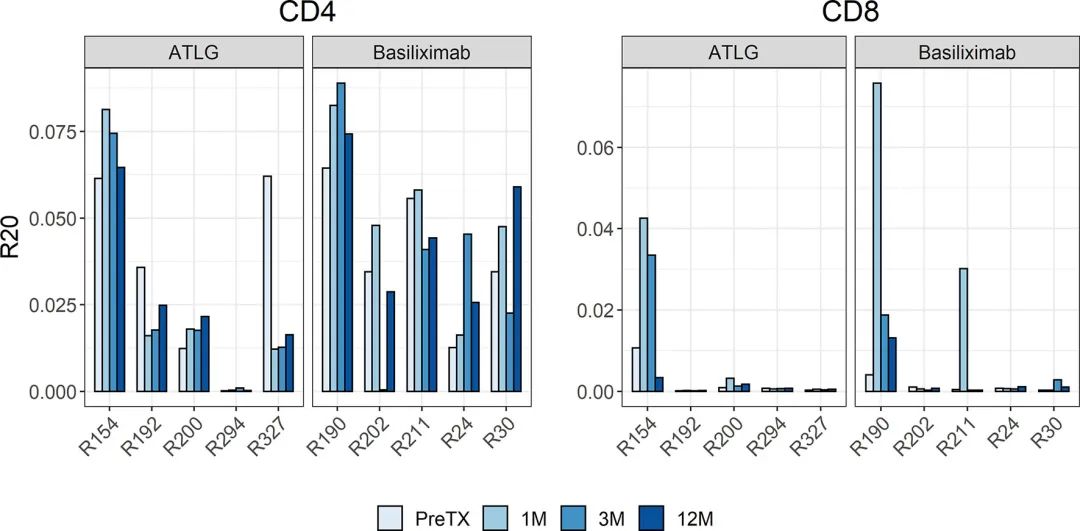
图3
R20测量,免疫优势的度量,显示两个队列没有分离,表明在减少剂量ATLG治疗后,总体TCR库中克隆优势没有增加(图3)。诱导治疗后CD4和CD8阳性T细胞的R20是稳定的,在移植后的所有时间点没有观察到统计学差异(CD4: F(3, 24)=0.85 p= 0.479;CD8: F(1.19, 9.52)=0.79, p=0.418)。在ATLG治疗组的一个受试者(R294)中有一个高度丰富的克隆,占整个T细胞库的10%以上,并且在移植前和移植后的每个时间点都有发现,这是该患者低R20值的原因。
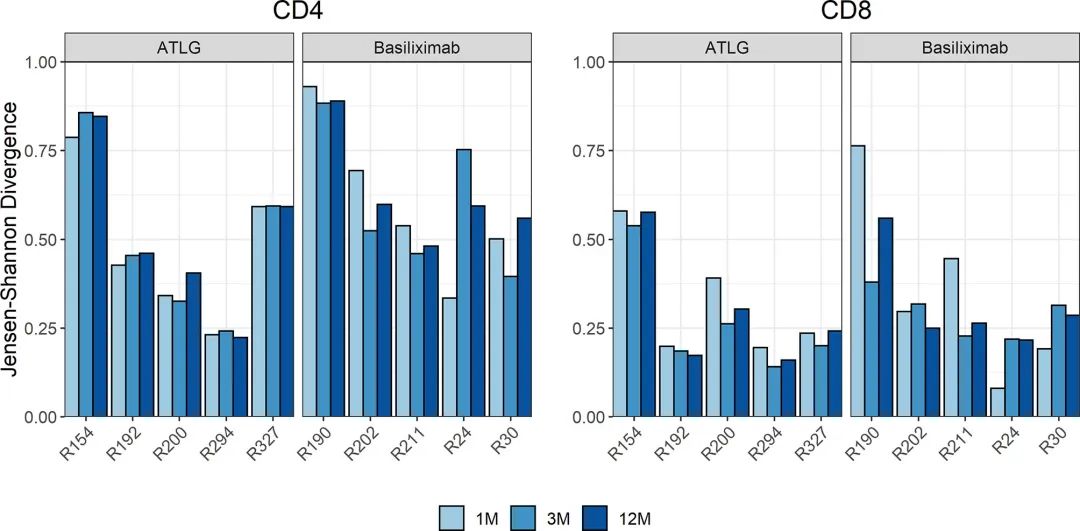
图4
通过对量ATLG组与巴利昔单抗治疗组患者在淋巴细胞重建过程中TCR库进行量化来观察总体周转是否存在差异,这将由高JSD表示。两组在所有时间点测量的JSD值相似移植后(图4)。在移植后,接受ATLG治疗的患者与接受巴利昔单抗治疗的患者相比,并没有经历更高的免疫系统复原率。
图5
同样,TCR(T细胞受体)库中的VJ组合在诱导治疗前后的变化在两组之间也相似。与总体TCR库相比,CD4和CD8的VJ组合的转换差异从基线开始较低,平均JSD分别为0.02和0.07。图5显示了ATLG诱导组一名典型患者移植前和移植后第一个月的VJ联合使用情况。然而,对移植后常见病毒感染的巨细胞病毒(CMV)或EB病毒(EBV)已知特异性TCR的鉴定表明,两个治疗组之间的病毒特异性T细胞数量相当,并且仍然存在,随时间稳定(CMV: CD4: F(3,24)=0.76 p=0.530;CD8: F(3,24)=0.27 p=0.849;EBV:CD4: F(3,24)=1.64 p= 0.206;CD8: F (1.13, 9.03) =1.32, p=0.287)。与移植前的T细胞库相比,供体反应性CD4T细胞库显示CMV特异性T细胞的丰度增加(t(9)=-2.9 p=0.017)。病毒特异性T细胞的累积频率见补充图7。
3
供体反应性T细胞免疫库
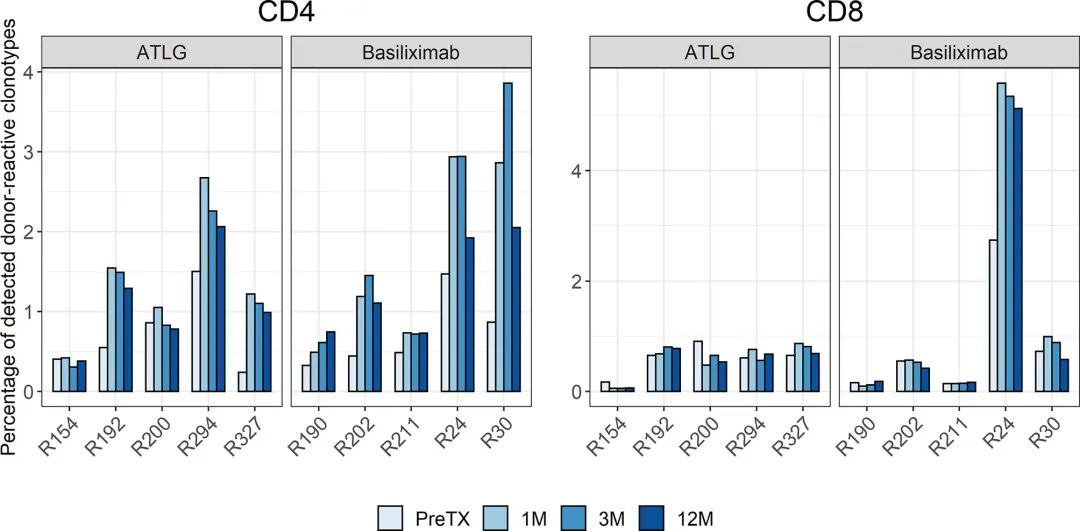
图6
移植前确定供体反应性TCR免疫库。对移植前和移植后大量T细胞库中所有克隆型中可检测到的预形成供体反应性克隆型的分析显示,移植后可检测到的CD4供体反应性克隆型的百分比显著增加,而与诱导治疗无关(t(9)=-3.89 p=0.004)。移植后ATLG组CD4供体反应性克隆型百分比平均增加0.67%,达到1.38%±0.83。同样,在巴利昔单抗治疗组中,移植后CD4供体反应性克隆型平均增加0.92%,达到1.64%±1.17。
图6显示了所有患者在所有时间点的供体反应性克隆型的百分比,并在补充表7中显示。正如预期的那样,在移植后观察时间内,巴利昔单抗治疗组所有受试者的CD4T细胞中供体反应性克隆型的数值增加。然而,在ATLG组中,两个人供体反应性细胞的增加不太明显,这可能是由这些受试者长期淋巴细胞减少引起的。
与CD4供体反应性克隆型相反,移植后CD8供体反应性克隆型百分比无统计学意义变化(t(9)=-1.01 p=0.341)。
总体而言,在移植后的整个观察期内,两个治疗组的供体反应性克隆型百分比相似(CD4: F(1.26, 10.08)=1.38 p=0.279;CD8: F(1.06, 8.48)=1.15, p=0.319)。
这种供体反应性库的增加不仅在克隆型水平上观察到,而且在移植后循环供体反应性T细胞的频率水平上也观察到。对于CD4供体反应性T细胞,移植后观察到显著增加(t(9) =-3.59 p=0.006),而CD8供体反应性T细胞的百分比在移植后保持相似(t(9)=1.57 p=0.150)。ATLG组和巴利昔单抗治疗组移植后CD4供体反应性T细胞平均升高分别为0.90%和0.89%。
05
讨论
该文章的优点在于对淋巴去除诱导治疗后淋巴细胞再生进行了详细的描述,包括对每位患者的整个循环TCR免疫库和供体特异性T细胞进行了TCR测序。这种深入的测序分析使作者能够获得更全面的数据,以评估ATLG治疗和巴利昔单抗治疗对受体TCR免疫库的影响。这项研究为深入了解ATLG治疗的效果和安全性提供了有力的支持。
根据目前的数据,得出结论,肾移植受者在减少剂量ATLG后重新填充的TCR免疫库不会缩小或倾斜,导致整体多样性和T细胞周转率与接受巴利昔单抗治疗的患者相当。同样地,接受低剂量ATLG治疗的患者与接受巴利昔单抗治疗的患者一样,对供体反应性T细胞数量增加。
低剂量ATLG保留了TCR免疫库的形状,潜在地降低了感染或癌症的易感性,而不会增加排斥反应。
#3

标题:Prospective Tracking of Donor-Reactive T-Cell Clones in the Circulation and Rejecting Human Kidney Allografts
前瞻性追踪供体反应性T细胞在血循环和发生排斥反应的人类肾移植中的克隆。
发表期刊:Frontiers in Immunology
发表日期:2021年10月
影响因子:8.79
01
样本
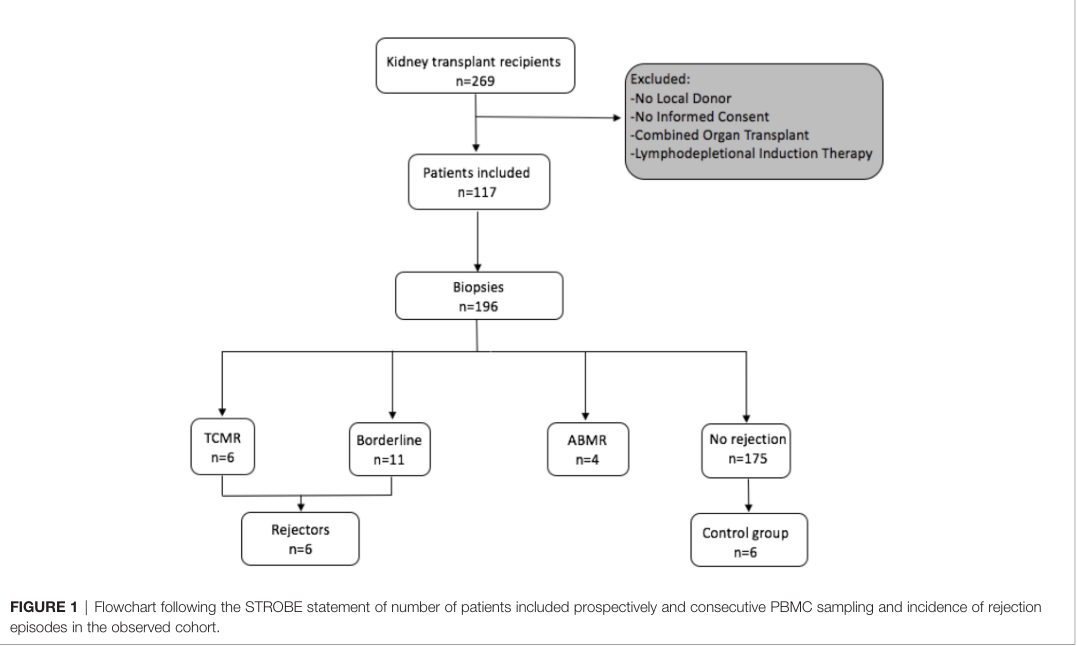
移植前共纳入117例符合条件的受体,在移植时分离受体和供体外周单个核细胞(PBMCs)并冷冻保存至分析。
02
背景
同种异体肽和HLA分子的抗原识别导致移植后供体反应性T细胞的激活,可能导致T细胞介导的排斥反应(TCMR)。T细胞受体(TCR)库的测序可用于追踪肾移植后患者血液和组织中的供体反应库。
03
实验方法学
a)研究设计
b)TCR测序
c)统计方法
04
结果
1
定义整体和供体反应性TCR免疫库
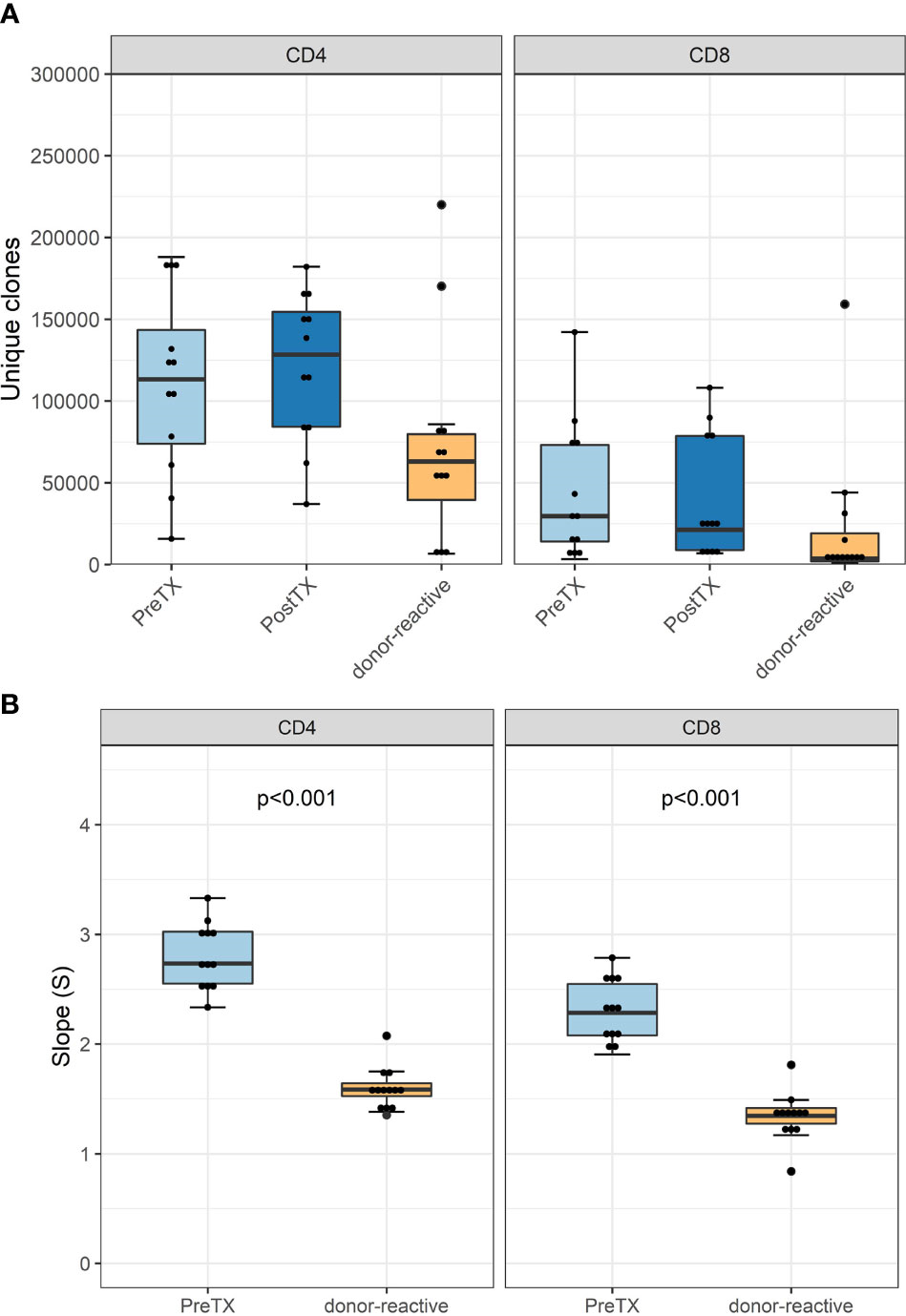
图2
移植前检测到的TCR克隆型数量与移植后相当(图2A)。正如预期的那样,与循环中未受刺激的整体T细胞相比,来自MLR的应答细胞显示出的克隆型数量显着减少。每个患者的克隆型数量和克隆数的详细信息见补充表2-4。
多样性分析利用幂律斜率的证实了供体-反应性T细胞库的已知特征;也就是说,它代表了一个独特的T细胞克隆群体,与未刺激的整体TCR库相比,它的多样性较低,并且具有较少的独特克隆(图2B)。
每个受试者的VJ使用情况在移植前后的样本中均有所不同,并且每个受试者的供体反应性TCR免疫库中也没有特定的V或J基因占绝对优势(没有展示数据)。
2
移植后循环中供体反应性克隆的扩增
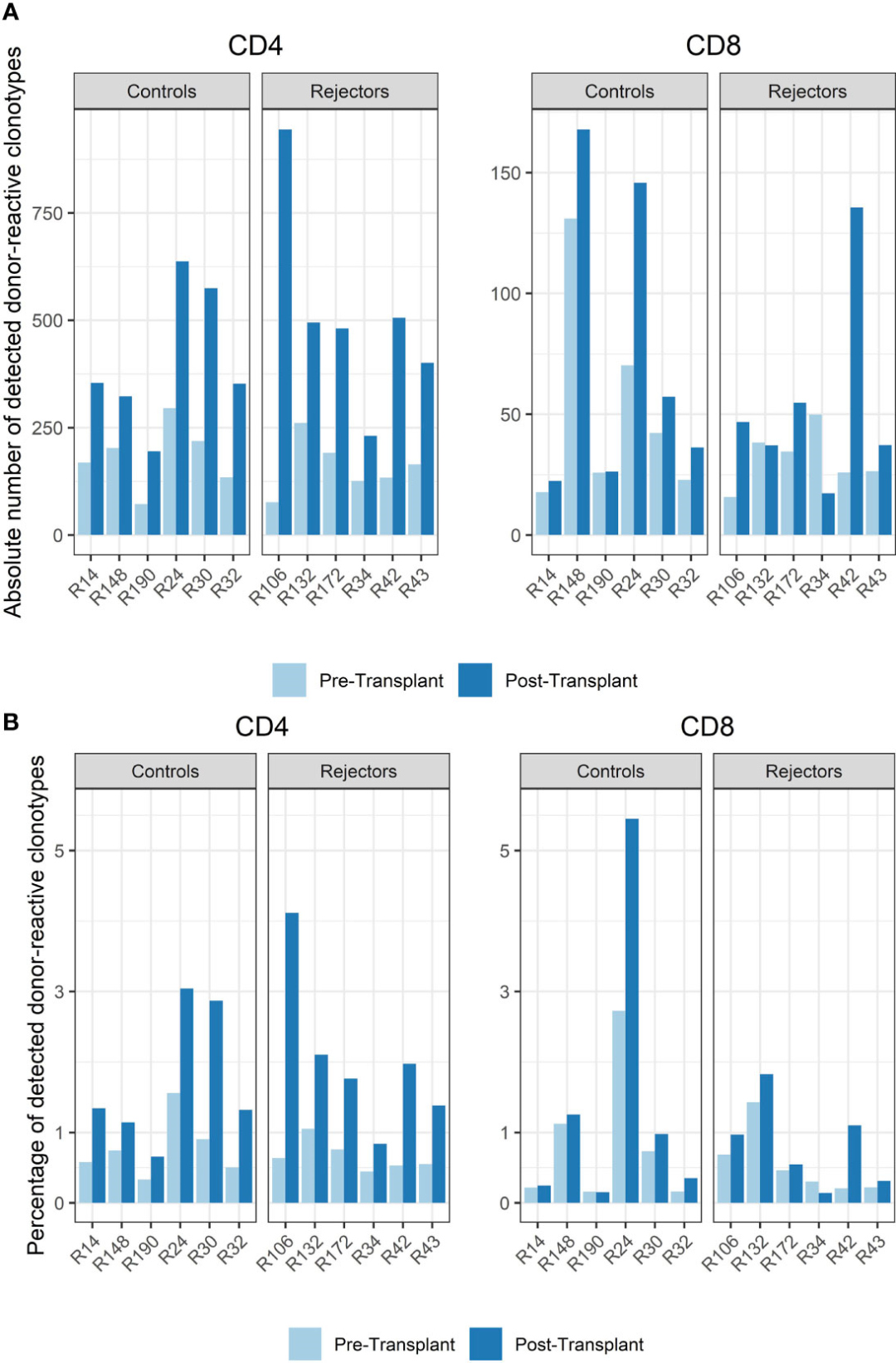
图3
在移植前患者血液中发现的所有独特的互补决定区3 (CDR3)序列中,CD4和CD8克隆型的供体反应性T细胞百分比分别为0.34-1.56%和0.16%-2.73%。观察供体反应性T细胞在循环中的丰度和频率,发现所有CD4细胞的0.43%至1.92%和所有CD8细胞的0.15至1.49%是供体导向的(图3)。
对照组和排斥组的活检时间点分别为移植后6-141天(中位61天)和7-251天(中位94天),与移植前相比,几乎所有受试者外周血中CD4和CD8 T细胞的供体反应性克隆的绝对数量和百分比都均增加(p<0.001,均值差: -1.197, CI:-1.802, -0.593,图3)。在活检时间点供体反应性克隆型的百分比中也可以看到这种差异,并且在排斥患者和对照组中CD4达到统计学意义,但CD8阳性T细胞没有(p< 0.001,均值差:-1.168, CI:-1.723,-0.612)。这些变化是由供体反应性克隆引起的,频率较低,在移植前未检测到,没有某些克隆型的优势或单一供体反应性克隆的优势增加。在所有受试者中都可以检测到这种增加,包括4名患者在移植后6天,另外2名患者在移植后251天也发现了这种增加。排斥者和对照组之间供体反应性T细胞的增加没有差异[未配对学生T检验;p=0.64(CD4+)和p=0.52(CD8+)],总体而言,供体反应性克隆在CD4部分的增加比CD8异体克隆更明显。
3
循环中的TCR克隆多样性
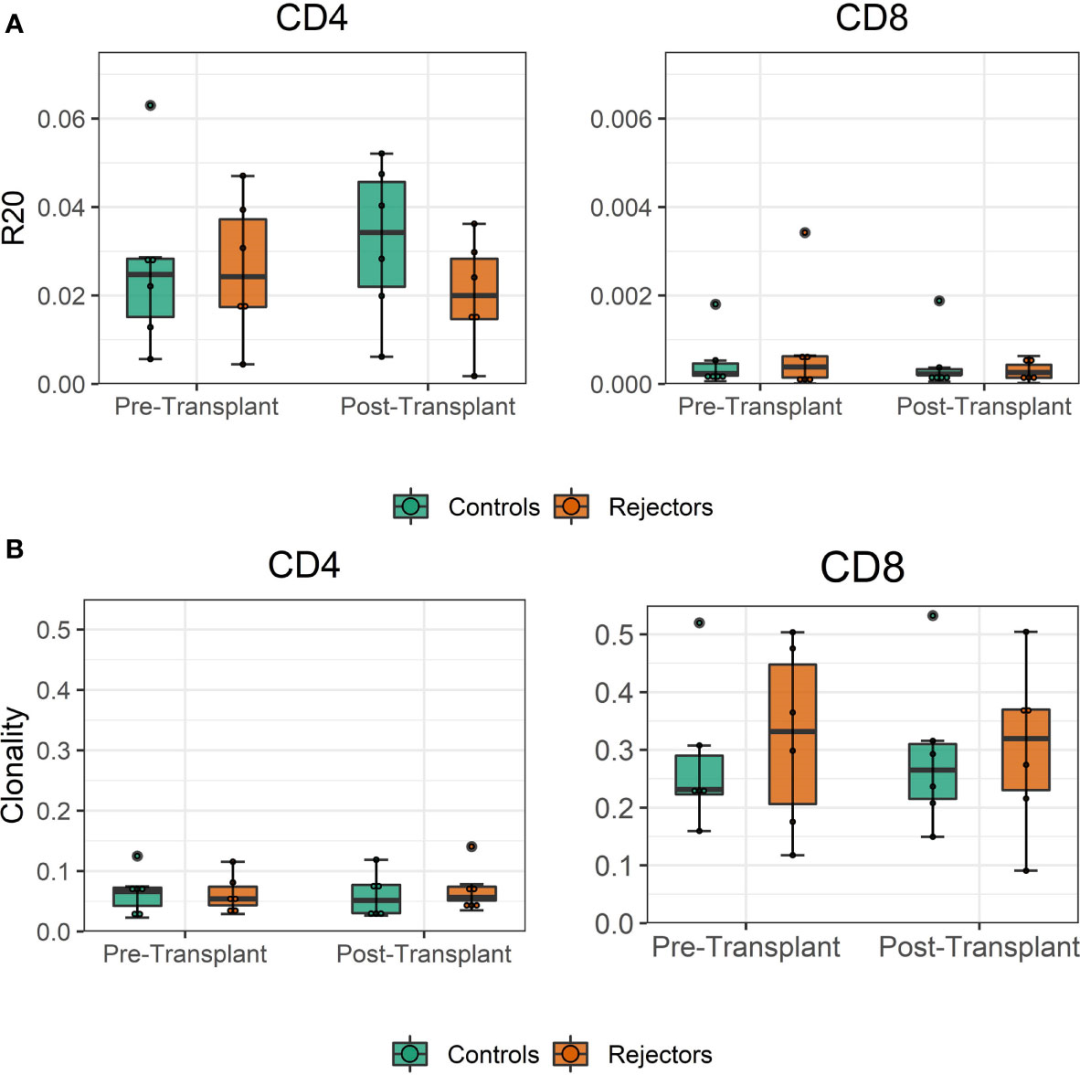
图4
通过克隆性测量的移植前基因多样性,CD4细胞为0.018-0.13,CD8T细胞为0.13 – 0.5。
移植后样本的克隆性与移植前的克隆性相当,如图4所示。没有发现R20作为免疫优势度指标在排斥组和对照组之间的差异(图4B)。
量化了移植前后TCR免疫库的总体变化,以确定特异性克隆的显著增加是否见于TCR免疫库总体变化,如果有的话,应该表现为较高的Jensen-Shannon散度(JSD)。然而,JSD值较低,表明在采样期间,整体免疫库变化不大,排斥患者与对照组无统计学差异(补充图3)。
作者没有发现排斥反应患者的外周血供体特异性库与对照组有差异,但在所有移植受者中,这些供体反应性细胞的增加并没有伴随着总体库的显著变化。
3
肾移植排斥反应时供体反应性T细胞出现明显浸润
在两种排斥移植的活检中,通过在具有组织学TCMR的样本中发现了6,186和23,108个T细胞,其中包括3,248和10,266种不同的T细胞克隆型,而在对照活检中未检测到TCR特异性RNA。根据移植前MLR的定义,在这些T细胞中,供体反应细胞的频率分别为4.8%和2.5%,分别代表3.7%和2.4%的独特克隆型。由于FACS分选对这些标本不可行,因此不可能单独分析CD4和CD8T细胞,因此对大量样本进行进一步分析。
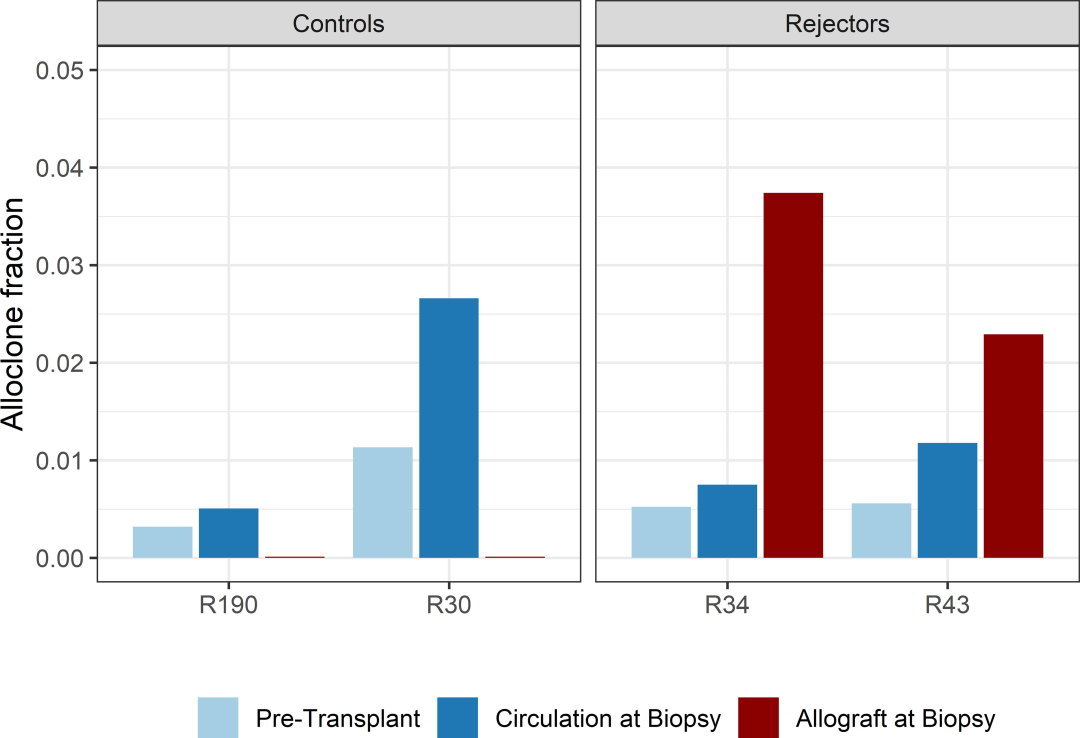
图5
通过与同期循环中供体反应性T细胞的比例相比,异体移植物中供体反应性克隆的比例有所增加(图5)。如前所述,患者R34和R43的活检中供体反应性克隆的比例分别为3.7%和2.4%,而同期外周血中供体反应性克隆的比例分别为0.6%和1.5%。有趣的是,在浸润的T细胞中没有观察到克隆优势,这表明在TCMR期间,几种抗原特异性T细胞有广泛的反应。
R34和R43浸润TCR免疫库的R20分别为0.038和0.023,克隆性分别为0.042和0.055。这些值与观察到的外周TCR免疫库值相当(图4)。
与术前外周血TCR库和活检时外周血TCR库的JSD值相比,活检时的供体区域浸润TCR免疫库与活检时外周血TCR库之间的JSD值更高,这意味着移植后人体TCR免疫库发生了显著变化(表2)。异体移植物中存在的前20种克隆型列表及其在外周血样本中的频率见补充表5。
还通过比较了同种异体移植物浸润T细胞和循环T细胞的VJ使用情况。虽然观察到患者R34中TRBV7-9xTRBJ2-7和TRBV7-2xTRBJ2-7在组织中的使用更强,而患者R43中TRBV7-2xTRBJ2-1和TRBV7-9xTRBJ2-5在组织中的使用消失,但在组织中的总体VJ使用情况和外周血中的VJ使用情况保持一致(补充图4)。患者R34和R43的VJ使用之间的JSD分别为0.065和0.063,因此非常相似。
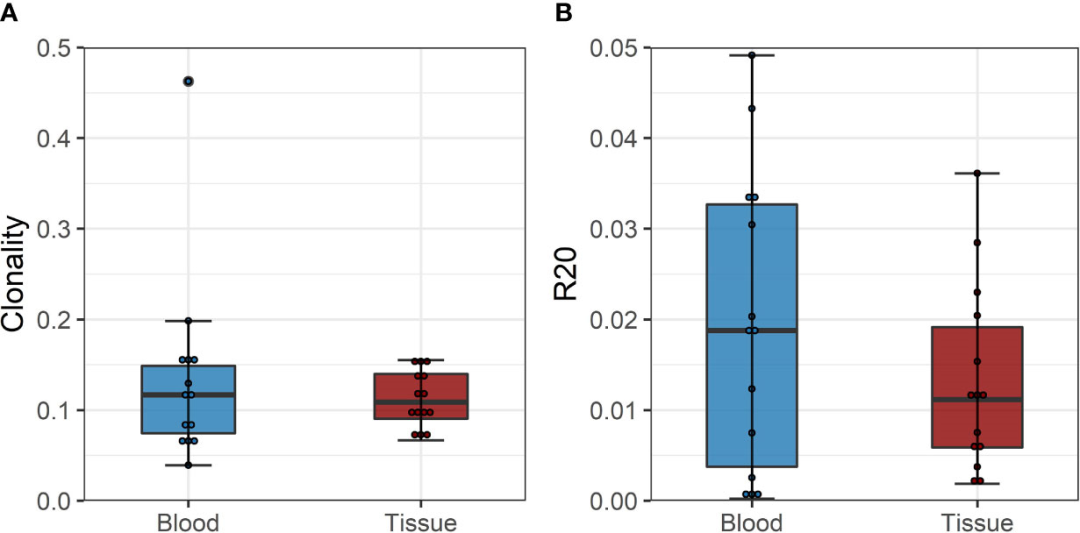
图6
为了证实这些发现,通过对七个经过细胞排斥反应的肾移植受者的活检和血液样本进行了类似的队列分析。
尽管缺乏明确的供体-反应库和不同的测序方法,多样性分析显示了相似的结果。在组织样本和活检时间点的循环之间,通过克隆性和R20测量的TCR库的多样性没有差异。与外周血TCR库相比,浸润细胞的平均克隆性为0.112比0.135 (p=0.411,均值差:-0.023, CI:-0.036, -0.082), R20为0.013vs.0.019 (p=0.117,均值差:0.006, CI:-0.002,-0.014)(图6)。外周血和组织间VJ使用的JSD范围为0.03 ~ 0.21(补充表6)。
4
总体和供体反应性TCR免疫库的网络分析
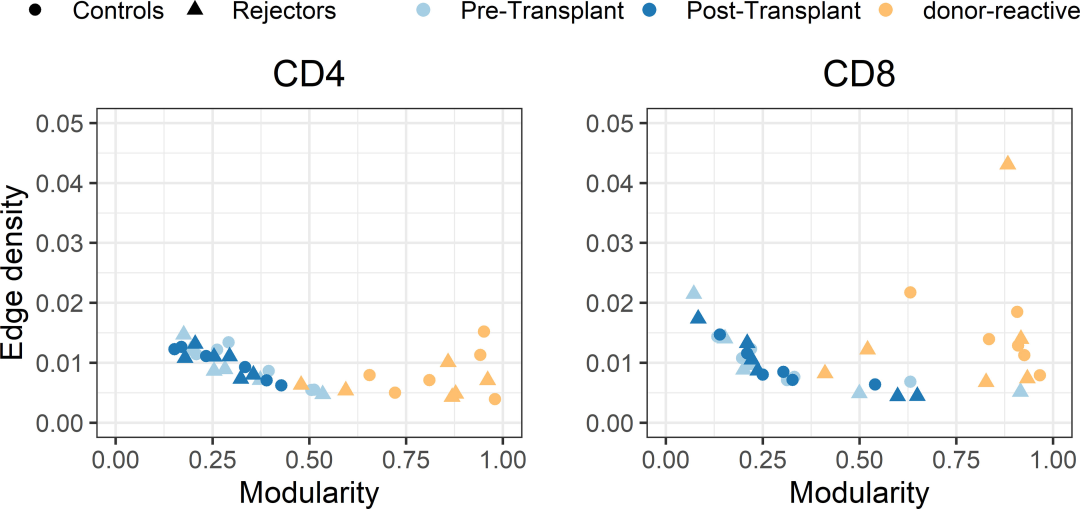
图7
供体-反应性免疫库的个体特异性网络显示出比移植前网络更高的模块化(配对学生T检验;P<0.001;CD4和CD8)和移植后的指标(配对学生T检验;P<0.001;CD4和CD8),表明形成的簇内具有更紧密的连通性(图7)。此外,在边缘密度方面,两个时间点或供体反应库之间没有明显差异(方差分析;CD4细胞 p=0.149, CD8细胞 p=0.095)。这是网络中整体连通性的度量,这表明,尽管根据不同时间点和供体-反应库的边缘密度无法测量实际连接的可观察到的增加,但供体-反应性免疫网络的连接主要分组在集群中(密集连接的节点组),集群外的连接稀疏。相比之下,循环整体TCR库的低模块化值表明异质性连接模式,而没有形成高度连接的拓扑簇。综上所述,这表明了供体特异性免疫网络的更强的细分,将克隆型分为具有相似CDR3序列的群体。图7右面板中的异常值是影响图理论特征的低克隆型计数的CD8库。
05
讨论
根据数据,得出的结论,在移植后外周血中肾移植受者的供体反应性T细胞在经过非淋巴消耗诱导治疗后增加。供体反应性T细胞具有明显多样性的TCR,暗示着大量针对移植物不同表位的T细胞被激活,而这种组合在外周血中并未反映出来。这在网络分析中得到验证,作者没有观察到显著的移植组织中特定抗原引导的T细胞簇,无论是在循环还是移植组织中的T细胞中。
然而,观察到CDR3区域在供体反应性克隆型的同种异体肾移植中具有重要意义,尽管它们的频率较低,但它们是最集中连接的克隆型之一。
#4

标题:Perturbations of the T-cell immune repertoire in kidney transplant rejection
肾移植排斥中T细胞免疫库的改变
发表期刊:Frontiers in Immunology
发表日期:2022年11月
影响因子:8.79
01
样本
对来自200名特殊肾移植受者的323份外周血样本进行了测序,其中有(n=100)和没有(n=100)活检证实的急性排斥反应。
02
背景
在本研究中,通过评估了大量成人肾移植患者的TCR免疫库,以便能够辨别T细胞克隆和移植时间之间的低频变化,组织学证实的急性排斥反应,以及T细胞或抗体介导的排斥反应的任何特异性变化。
03
实验方法学
图1
a)样品收集
b)基因组DNA的分离和T细胞受体可变β链测序
c)TCRβ测序结果的统计分析
04
结果
1
T细胞免疫库的多样性及其与移植临床表型的关联
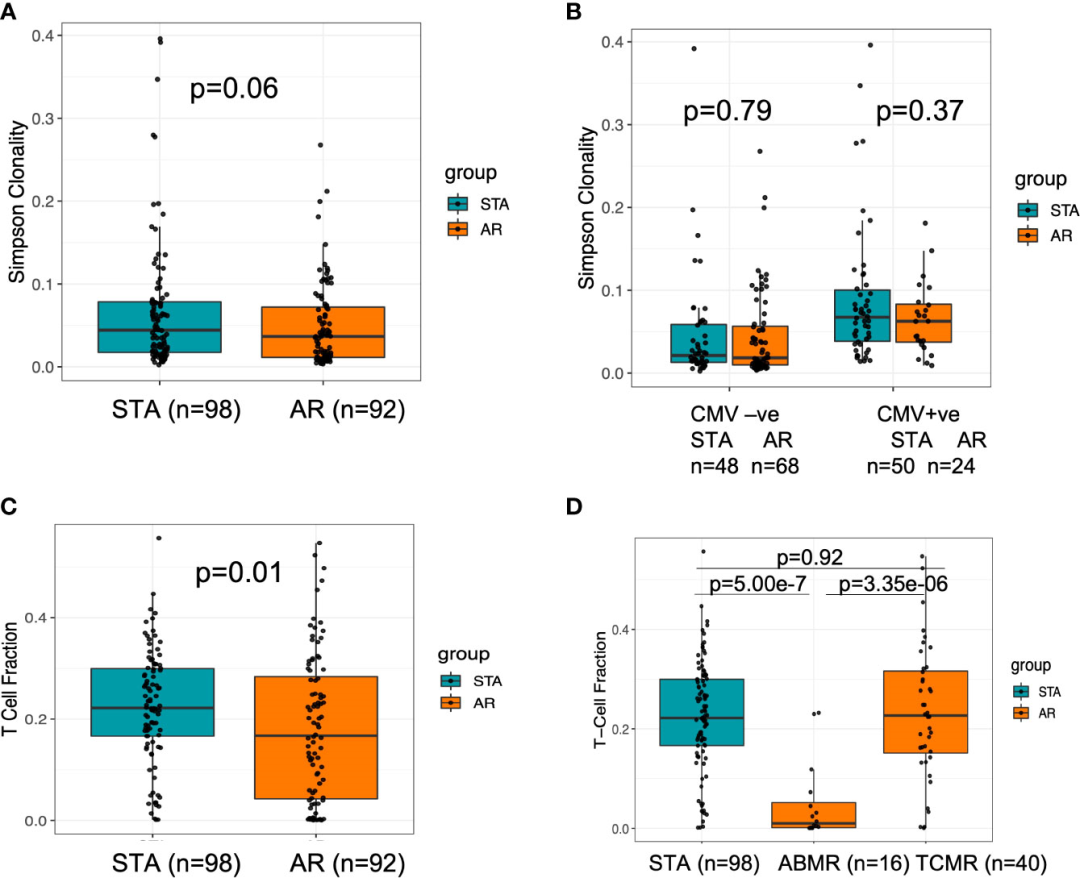
图2
在移植前阶段,从移植后出现急性排斥反应的受试者收集的外周血样本中观察到更大的T细胞库多样性(图2A)。使用先前发表的方法(21),推断受试者在基线时的CMV状态;然而,它不能区分潜伏性感染和活动性感染。与STA组相比,AR组中CMV naïve的患者数量明显更多(51% vs.26%;精确P=0.0005)。
同时,更高的T细胞克隆性在移植后推断CMV PCR阳性的患者(n=116)中可见。(图2b)。可以观察到,AR组的CMV阳性率有所增加(急性排斥反应时CMV阳性率为57%,而同一患者移植前的CMV阳性率为32% (p=0.03)。
2
移植前TCRBV01和TCRBJ01-02的变异及其移植后的临床相关性

补充图1
通过进一步评估了基线样本中V型和J型TCR基因的使用模式,以确定可能与AR风险增加相关的差异基因使用(补充图1A, B)。可以观察到AR受试者中TCRBV01和TCRBJ01-02的使用增加(p<0.05, Wilcoxon秩和检验)。
3
移植前的基线TCFr和移植排斥风险
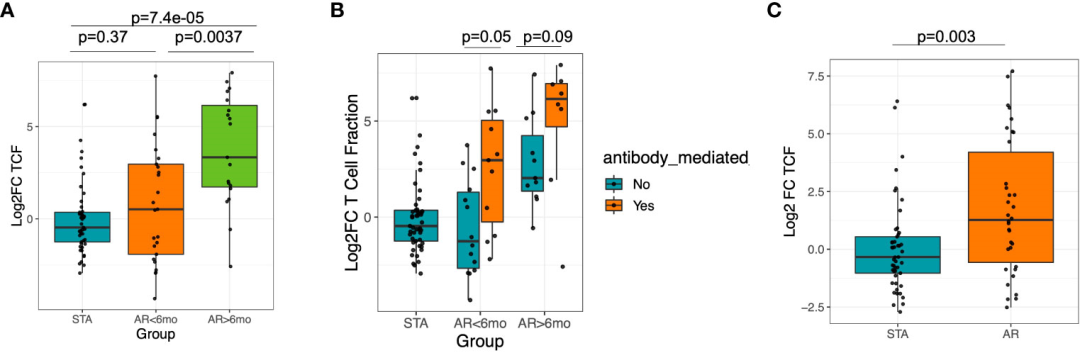
图3
通过活检分析了证实为Banff(14)分类的急性排斥反应患者的移植前T细胞分数,以及T细胞介导的排斥反应(TCMR)或抗体介导的排斥反应(ABMR)病例,可以观察到两种类型的排斥反应队列之间存在显著差异(Kruskal Wallis p=4.03e-06),使用后Dunn检验p=3.35e-6(图2D), ABMR TCFr值较低。
为了比较可能存在的复杂因素,比较了性别、年龄或种族之间变化基线T细胞分数。性别(M vs. F)、年龄(<=37 vs. 38+)差异无统计学意义,Wilcoxon秩和检验p>0.05。可以观察到,移植后6个月后,AR队列中TCFr急剧上升,特别是对于晚期急性排斥的患者(log2倍变化中位STA:-0.34,中位<6个月AR:0.59,中位>6个月AR:3.52;post-hoc Dunn 检验,调整后P=0.0037vs AR<6mo, P=7.4e-5 vs STA)(图3A)。
当进一步将排斥患者分为ABMR和非ABMR时,无论发生排斥的时间如何,ABMR组的TCFr显著增加(AR ABMR vs STA, Wilcoxon P=0.04, AR非ABMR vs STA Wilcoxon P=0.56)(图3B)。
总体而言,70.5%的AR患者移植后TCFr增加,而STA患者为46.9% (Fisher精确,p=0.03)(图3C)。事实上,这是因为许多AR队列患者的基线TCFr非常低,在活检确认排斥时平均急剧增加>10倍。与TCFr相反,对TCR库克隆性进行类似分析时,可以观察到AR和STA队列中的受试者之间没有差异(补充图2),这表明TCFr的扩增可能是由于T细胞库的整体增加,而不仅仅是最高频率克隆的扩增。
4
TCR免疫库高周转和急性排斥反应
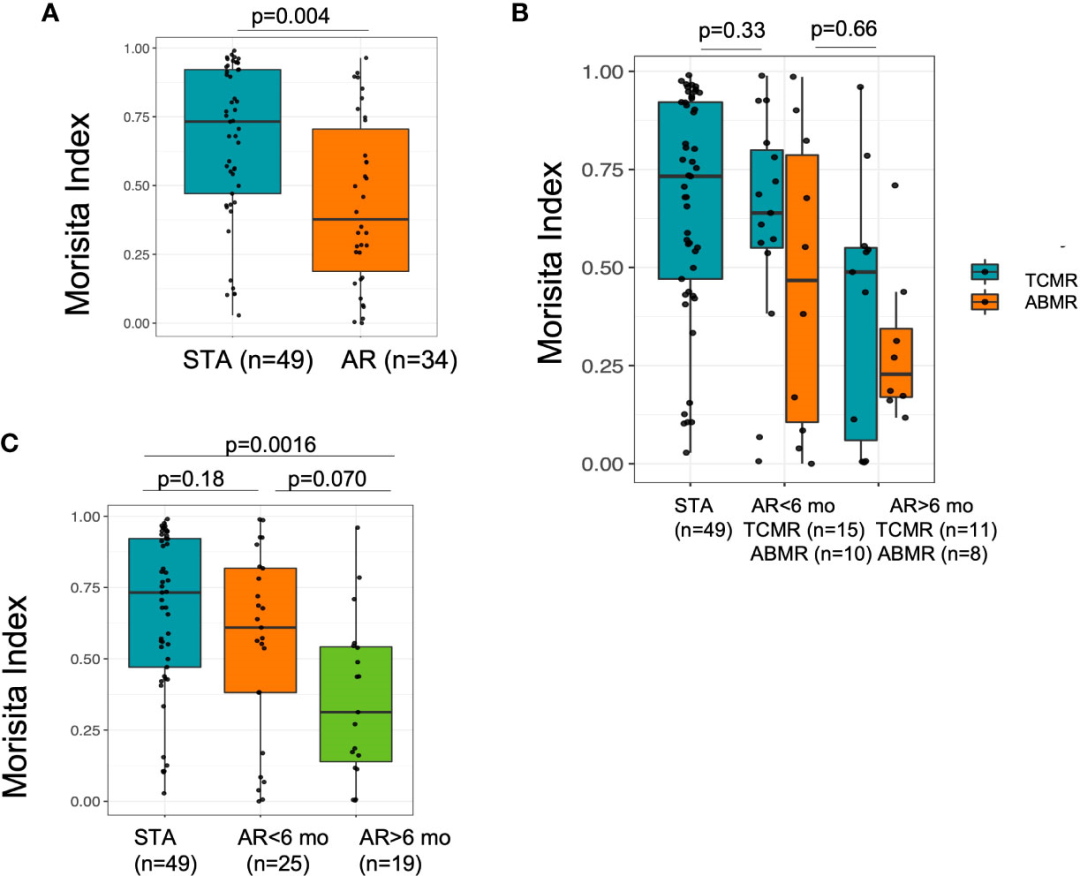
图4
T细胞库周转使用Morisita指数(22)进行测量,该指数基于两个样本之间共享的克隆来比较T细胞的数量和频率。通过比较STA患者和AR患者的基线样本和移植后收集的样本的配对值来评估TCR库转换的演变,STA患者和AR患者的样本均大于500个T细胞。由于库周转受时间的影响,可以根据他们的AR事件是发生在移植后6个月前还是6个月后进一步划分AR组。周转增加最多的是AR队列(R=-0.33, p=0.029)(补充图3),移植后6个月后出现晚期排斥反应的患者(STA的中位Morisita指数:0.73,移植后不到6个月的AR的中位Morisita指数:0.61,移植后6个月后AR的中位MI:0.31, Kruskal-Wallis p=0.004)(图4A)。
为了进一步研究临床特征与患者的高周转率是否有关,然后对ABMR患者进行细分,发现与排斥类型没有统计学意义(图4B)。这表明,高周转通常与排斥反应有关,而不仅仅是抗体介导的排斥反应患者,与急性排斥反应发生的时间无关(p = 0.0016,调整p)(图4C)。
比较移植后V和J基因的使用,可以观察到STA患者中TCRBV18的使用略有增加;然而,当修正多重测试时,这并不显著。没有其它TCRB V基因表现出差异显著(补充图4A, B)。这些发现表明,在孤立的移植后样本中测量TCR免疫库的变化可能不足以预测排斥反应,而整合移植前或基线血液样本与移植后血液样本之间的变化将更有价值,以评估动态库的临床影响。
5
微循环炎症评分与Morisita指数评分显著相关
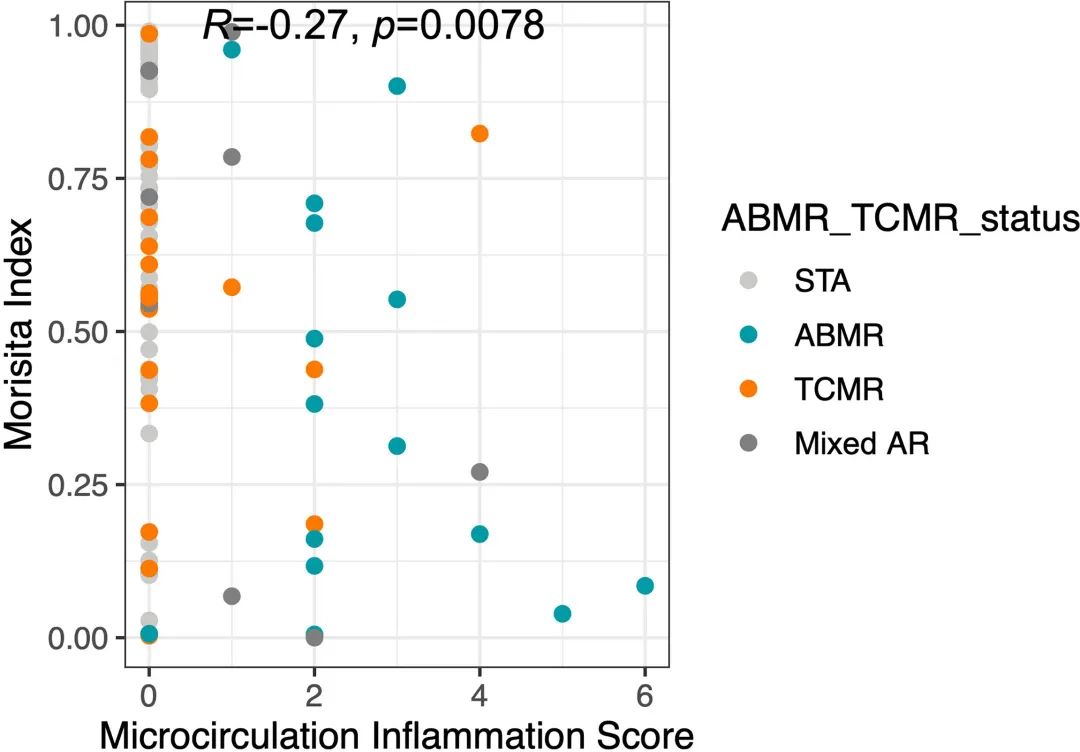
图5
微循环炎症(MI)是一个累积评分,包括肾小球炎(gs)和小管周围毛细血管炎(ptc),与肾移植预后较差相关(23)。在移植后样本中,心肌梗死评分与Morisita指数之间存在显著相关性(spearman’s Rho=-0.27, p=0.0078,图5)。在移植后样本中,Morisita指数小于0.3的患者中,43.5%的患者心肌梗死>0,而心肌梗死=0的患者为15.7% (Fisher精确检验,p=0.009)。这表明高周转率可能与更严重的排斥反应有关。
05
讨论
本研究证实,检测免疫库变化与移植后排斥反应相关,这表明T细胞受体测序(10)可能为受体提供移植前和移植后排斥风险预测。该检测具有潜在用于移植后的免疫抑制决策的能力,基于TCRf/库周转率的急剧增加,其中移植后免疫库高周转率的鉴定表明供体特异性、反应性T细胞的扩增。正在进行的进一步工作中,在新的患者组中独立验证这些结果,通过TCRSeq和流式细胞术进一步破译T细胞抗原识别供体刺激的受体细胞增殖,进一步了解克隆型和周转状态,这有助于识别显性表位,在移植物功能出现临床恶化之前,预测移植肾排斥风险。
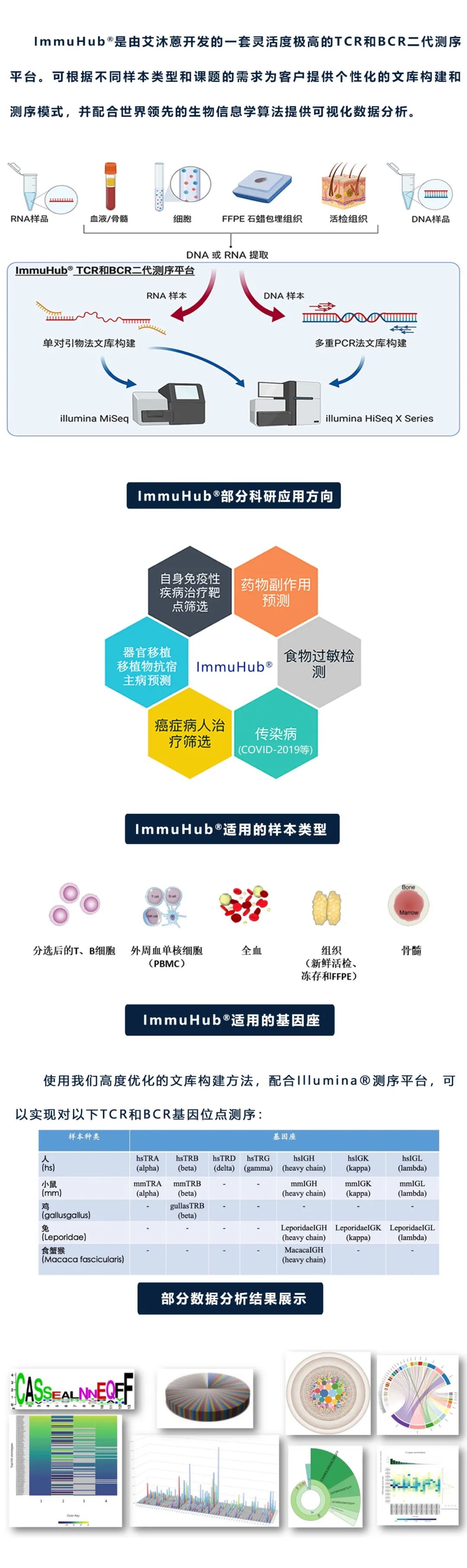
什么是ImmuHub®技术?
杭州艾沐蒽生物科技有限公司成立于2016年,是国内前沿的专注于免疫基因组学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出Seq-MRD血液肿瘤微小残留病(MRD)检测,并授权泛生子(纳斯达克代码:GTH)使用。同时,公司拥有Immun-Traq肿瘤治疗伴随诊断、Immun-Cheq |T细胞免疫测评以及ImmuHub免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier 疾病早筛、单细胞测序、TCR-T药物开发等平台管线。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。

