
BзїЖиГЮеТМTзїЖиГЮжШѓеЕНзЦЂз≥їзїЯдЄ≠дЄНеРМзЪДжХИеЇФзїЖиГЮ;зДґиАМпЉМеЃГдїђзїПеЄЄеНПеРМдљЬзФ®дї•ж†єйЩ§зЧЕзРЖињЗз®ЛгАВдЇМеНБе§ЪеєіжЭ•пЉМеѓєиВњзШ§еЕНзЦЂеПНеЇФзЪДз†Фз©ґдЄїи¶БйЫЖдЄ≠еЬ®TзїЖиГЮдЄКпЉМBзїЖиГЮеЬ®иВњзШ§еЊЃзОѓеҐГ(TME)дЄ≠зЪДдљЬзФ®дїНзДґе≠ШеЬ®дЇЙиЃЃ(1,2)гАВзДґиАМпЉМжЬАињСзЪДз†Фз©ґи°®жШОпЉМBзїЖиГЮеПѓиГљеЬ®иВњзШ§еЕНзЦЂдЄ≠иµЈзЭАиЗ≥еЕ≥йЗНи¶БзЪДдљЬзФ®пЉМеЫ†дЄЇињЩдЇЫзїЖиГЮеІЛзїИжШѓжЮДжИРTMEзЪДйЗНи¶БжИРеИЖгАВдЇЛеЃЮдЄКпЉМжНЃжК•йБУпЉМиВњзا浪洶жАІжЈЛеЈізїЖиГЮBзїЖиГЮ(TIL-Bs)еЬ®дЄНеРМз±їеЮЛзЩМзЧЗзЪДTILsдЄ≠еН†40%(3,4)гАВж≠§е§ЦпЉМдЄАдЇЫжК•йБУжШЊз§ЇдЇЖдЄЙзЇІжЈЛеЈізїУжЮД(TLS)еРЂжЬЙзЫЄеѓєиЊГйЂШжѓФдЊЛзЪДTIL-BsгАВ
зФ±дЇОBCRзЪДдЄЛдЄАдї£жµЛеЇП(NGS) (BCR-Seq)зЪДињЫж≠•пЉМзФ±дЇОBзїЖиГЮеПЧдљУ(BCR)е≠ШеЬ®пЉМдљњBзїЖиГЮиЖЬдЄКзЪДжКЧдљУдєЯеПѓдї•ињЫи°МеИЖжЮРпЉМињЩељїеЇХжФєеПШдЇЖжИСдїђеѓєBзїЖиГЮдїЛеѓЉзЪДеЕНзЦЂзЪДзРЖиІ£гАВињЩй°єжКАжЬѓйЕНеРИеЕИињЫзЪДиЃ°зЃЧеЈ•еЕЈпЉМеЈ≤зїПиГље§ЯжОҐз©ґеЈ®е§ІзЪДжКЧдљУе§Ъж†ЈжАІпЉМињЩеПНињЗжЭ•еПИдЄЇBзїЖиГЮеЬ®еПЧеИ∞еИЇжњАеПСзФЯеУ™дЇЫеПНеЇФжПРдЊЫдЇЖйЗНи¶Бдњ°жБѓ(22)гАВ
дЄЇдЇЖжОҐз©ґBзїЖиГЮеЬ®TMEдЄ≠зЪДеКЯиГљдљЬзФ®пЉМдљЬиАЕеѓєжЭ•иЗ™TNBCиѓ±еѓЉе∞ПйЉ†зЪДеЫЫзІНзїДзїЗз±їеЮЛ(иВњзШ§гАБDLNsгАБи°Ажґ≤еТМй™®йЂУ)зЪДBжЈЛеЈізїЖиГЮињЫи°МдЇЖBCR-SeqгАВдЄЇдЇЖз°ЃеЃЪдЄОиВњзШ§зїЖиГЮ/TAAsзїУеРИзЪДBзїЖиГЮзЪДзЙєеЊБеТМеЬ®TMEеТМйВїињСDLNsдЄ≠еПСзФЯжКЧеОЯй©±еК®еПНеЇФеРОжШѓеР¶еПЧеИ∞йШ≥жАІйАЙжЛ©ињЗз®ЛзЪДељ±еУНпЉМе∞ЖTIL-BеЕЛйЪЖзЪДжКЧдљУеЇУжµЛйЗПзїУжЮЬдЄОеЕґдїЦдЄЙзІНзїДзїЗз±їеЮЛдЄ≠зЪДBзїЖиГЮеЕЛйЪЖзЪДжµЛйЗПзїУжЮЬињЫи°МдЇЖжѓФиЊГгАВ
зїУжЮЬеПСзО∞TIL-BеМЇеЃ§жЬЙйЩРжХ∞йЗПзЪДйЂШеЇ¶жЙ©еҐЮзЪДеЕЛйЪЖеН†жНЃдЄїеѓЉпЉМињЩдЇЫеЕЛйЪЖи°®зО∞еЗЇдЇЖйЂШSHMзОЗгАВињЩдЇЫеЕЛйЪЖе§Іе§ЪжШѓIgM+еЕЛйЪЖпЉМињЩи°®жШОTIL-BsзЪДCSRеПЧжНЯгАВж≠§е§ЦпЉМеЬ®жЙАжЬЙзЪДеМЇеЃ§дЄ≠йГљеПСзО∞дЇЖдЄАдЄ™зЙєеЃЪзЪДTIL-BsдЇЪзЊ§пЉМињЩи°®жШОињЩдЄ™зЙєеЃЪзЪДBзїЖиГЮдЇЪзЊ§еЬ®TMEеПСзФЯињБзІїгАВ
жЧ†иЃЇжШѓеЬ®жЧґйЧідЄКињШжШѓеЬ®зїДзїЗдєЛйЧіпЉМиЈЯиЄ™BзїЖиГЮеЕЛйЪЖпЉМйГљеПѓдї•йАЪињЗиѓЖеИЂеЃГдїђзЪДжКЧдљУеПѓеПШеМЇпЉМзЙєеИЂжШѓеЃГдїђзЪДйЗНйУЊ(CDRH3)зЪДдЇТи°•жАІеЖ≥еЃЪеМЇ3 (CDR3)жЭ•еЃЮзО∞пЉМињЩ襀зФ®дљЬBзїЖиГЮеЕЛйЪЖзЪДвАЬжݰ嚥з†БвАЭгАВзФ±дЇОCDRH3жШѓV(D) JйЗНжОТзЪДдЇІзЙ©пЉМеЃГеЬ®жКЧдљУйЗНйУЊеПѓеПШеМЇ(VH)дЄ≠и°®зО∞еЗЇжЬАйЂШзЪДе§Ъж†ЈжАІпЉМ襀聧䪯еЬ®жКЧеОЯиѓЖеИЂдЄ≠иµЈеЕ≥йФЃдљЬзФ®гАВ
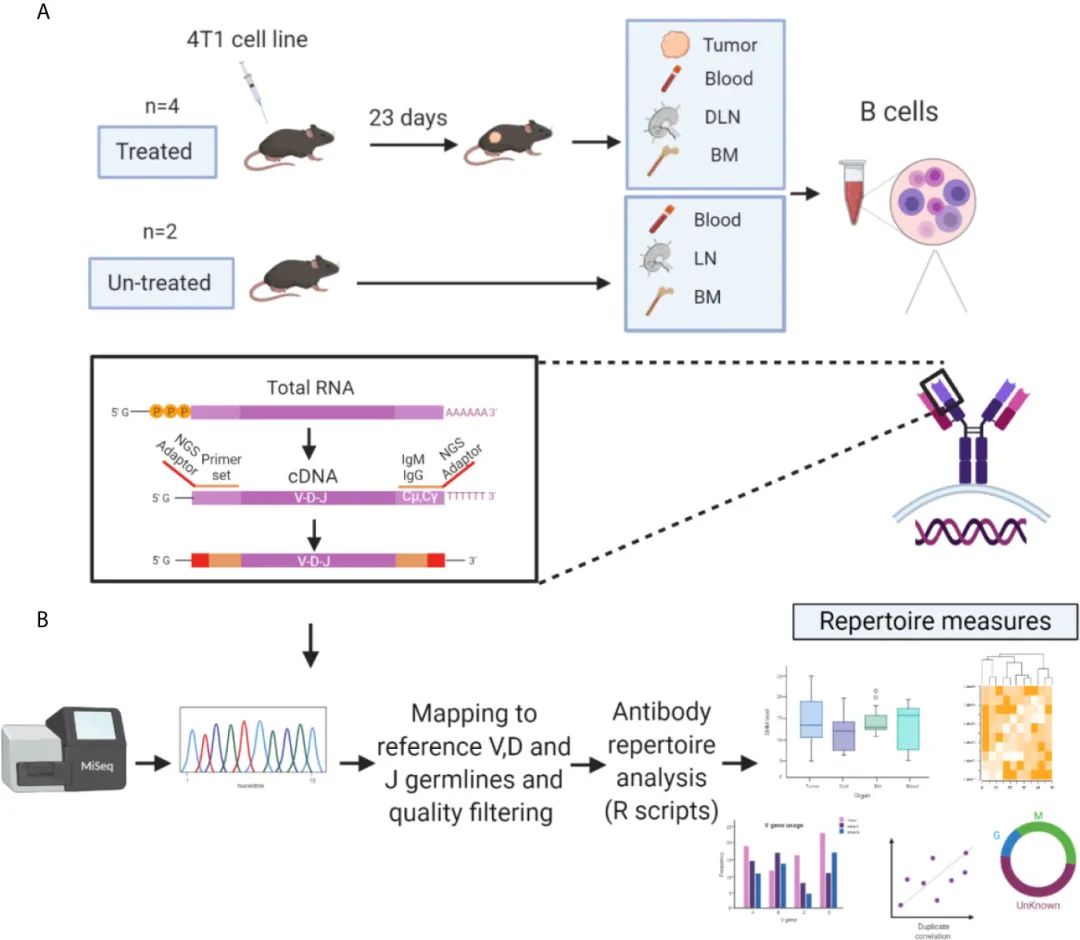
зФ±дЇОдЇЇдїђжЩЃйБНиЃ§дЄЇIgMеИ∞IgGзЪДCSRдї£и°®дЇЖеЕНзЦЂеПНеЇФзЪДињЫе±Х(34,35)пЉМеЫ†ж≠§е∞ЖеИЖжЮРйЗНзВєжФЊеЬ®IgGеТМIgMеРМеЮЛзЪДжКЧдљУVHдЄКгАВдЄЇдЇЖз†Фз©ґTIL-Bs зЪДеЇУжµЛйЗПеєґиЈЯиЄ™еЕґеЬ®зїДзїЗдЄ≠зЪДеЕЛйЪЖеИЖеЄГпЉМйАЪињЗеїЇзЂЛдЇЖдЄАдЄ™еЃЮй™МеТМиЃ°зЃЧеє≥еП∞пЉМзФ®дЇОеИЖжЮР4еП™жО•еПЧ4T1зїЖиГЮж≤їзЦЧзЪДе∞ПйЉ†(дЄО2еП™жЬ™жО•еПЧ4T1зїЖиГЮж≤їзЦЧзЪДе∞ПйЉ†дљЬдЄЇеѓєзЕІ)иОЈеЊЧзЪДVHеЇПеИЧ(еЫЊ1A)гАВ
еЬ®иВњзШ§зїЖиГЮжО•зІНеРО23 dпЉМдїО4зІНзїДзїЗз±їеЮЛ(иВњзШ§гАБи°Ажґ≤гАБDLNsеТМй™®йЂУ)дЄ≠жФґйЫЖBзїЖиГЮпЉМи£ВиІ£зЇѓеМЦжАїmRNAгАВе∞ЖеЫЮжФґзЪДmRNAйАЖиљђељХзФЯжИРcDNAпЉМеєґеИ©зФ®VHзЙєеЉВжАІеЉХзЙ©еТМIGHMеТМIGHGеЯЇеЫ†йЗНйУЊ(CH1)жБТеЃЪеМЇ1жЙ©еҐЮVHеЇПеИЧ(и°•еЕЕи°®S1)гАВ
йАЪињЗжЈїеК†йАВйЕНеЩ®еТМж†ЈеУБзЙєеЉВжАІжݰ嚥з†БпЉМеЬ®MiSeq Illuminaеє≥еП∞(2√Ч300 bp)дЄКеИґе§ЗзФЯжИРзЪДVHжЙ©еҐЮе≠РињЫи°Ме§ЪйЗНжµЛеЇПгАВ
еѓєдЇОжЬ™ж≤їзЦЧзЪДе∞ПйЉ†пЉМдїОдЄЙзІНзїДзїЗз±їеЮЛдЄ≠еИЖз¶їеЗЇBзїЖиГЮпЉМеєґињЫи°МдЄОж≤їзЦЧе∞ПйЉ†зЫЄеРМзЪДе§ДзРЖгАВеАЉеЊЧж≥®жДПзЪДжШѓпЉМзЫЃеЙНеЃЮй™МиЃЊиЃ°иГМеРОзЪДдЄАиИђж¶ВењµжШѓеЕБиЃЄеЕНзЦЂз≥їзїЯжЬЙиґ≥е§ЯзЪДжЧґйЧідЇІзФЯеРДзІНеРДж†ЈзЪДBзїЖиГЮпЉМеМЕжЛђиЃ∞ењЖзїЖиГЮеТМжµЖзїЖиГЮгАВиЩљзДґе§Іе§ЪжХ∞е∞ПйЉ†зЪДзЦЂиЛЧжО•зІНжЦєж°ИжМБзї≠иґЕињЗ4еС®пЉМдљЖеПЧеИ∞еЭПж≠їињЗз®ЛеТМиЗ™еПСиѓ±еѓЉжЈЛеЈізїУеТМиВЇиљђзІїзЪДйЩРеИґгАВ
еѓєжЙАжЬЙ4еП™е∞ПйЉ†зїДзїЗдЄ≠зЪДBзїЖиГЮињЫи°МBCR-SeqпЉМеЕ±иОЈеЊЧ5.3√Ч107еЇПеИЧгАВдљњзФ®MiXCR(37)еѓєVHеЇПеИЧињЫи°МйЕНеѓєзЂѓеѓєйљРпЉМеєґдЄОеПВиАГзІНз≥їжѓФеѓєпЉМе¶ВеЬ®еЕНзЦЂйБЧдЉ†е≠¶жЬНеК°еЩ®[IMGT(36)]дЄ≠еПСзО∞зЪДпЉМиОЈеЊЧеМЕжЛђж°ЖжЮґ(FRs)гАБCDRsеТМеЕ®йХњVDJеМЇеЯЯеЬ®еЖЕзЪДеМЇеЯЯзЪДж≥®йЗКгАВеЬ®еїЇзЂЛжКЧдљУеЇПеИЧжХ∞жНЃйЫЖзФ®дЇОзФЯжИРеЇУжµЛйЗПдєЛеЙНпЉМж†єжНЃйАЙеЃЪзЪДж†ЗеЗЖеѓєз≠ЫйАЙеѓєйљРзЪДVHеЇПеИЧ(иІБжЦєж≥Х)(еЫЊ1B)гАВ
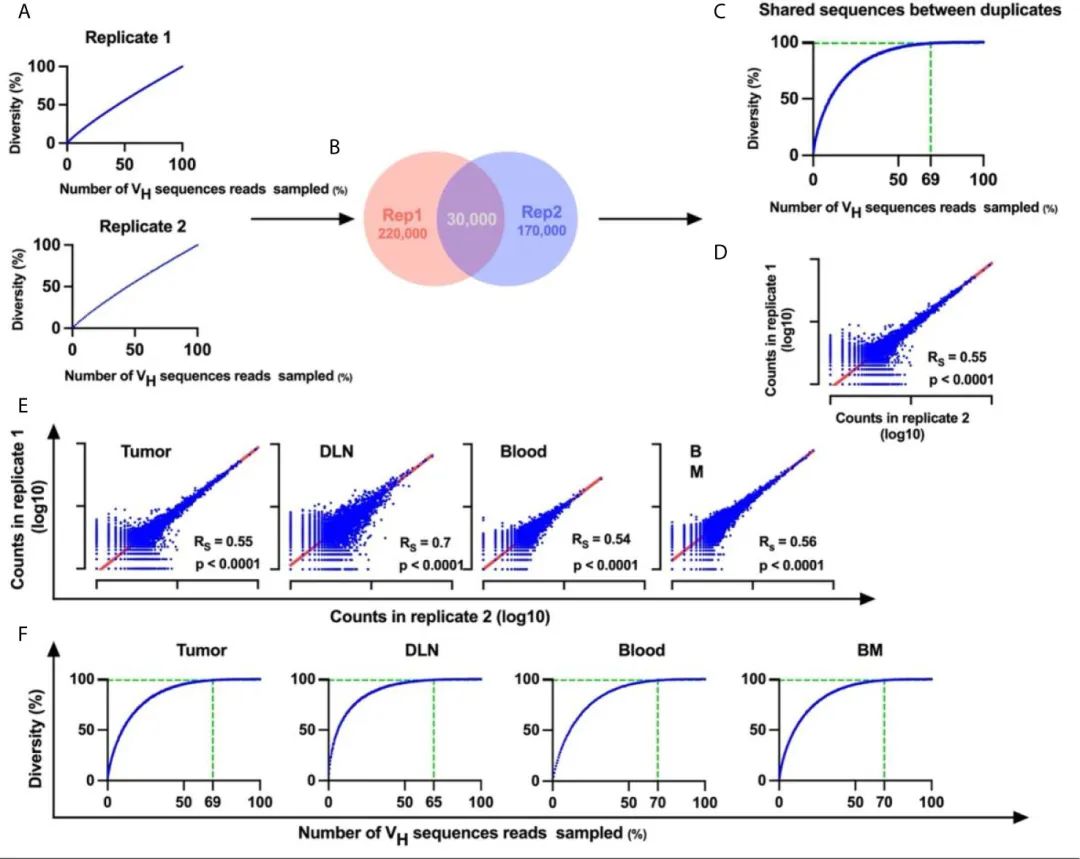
дЄЇдЇЖеЗПе∞СPCRжЙ©еҐЮеТМжµЛеЇПињЗз®ЛдЄ≠еЉХеЕ•зЪДйФЩиѓѓпЉМдљЬиАЕеѓєжѓПдЄ™ж†ЈжЬђзЪДжКАжЬѓеЙѓжЬђињЫи°МдЇЖBCR-SeqгАВ
дЄЇдЇЖдЉ∞иЃ°жµЛеЇПжЈ±еЇ¶жШѓеР¶иґ≥е§ЯпЉМеѓєжѓПдЄ™ж†ЈжЬђзЪДBCR-SeqжХ∞жНЃињЫи°МдЇЖз®АйЗКжЫ≤зЇњ(зФЯжАБе≠¶дЄ≠еЄЄзФ®зЪДйЗПеМЦзЙ©зІНе§Ъж†ЈжАІзЪДжЦєж≥Х)гАВељУеѓєеНХдЄ™йЗНе§НињЫи°Мз®АзЦПеИЖжЮРжЧґпЉМеПСзО∞з®АйЗКжЫ≤зЇњеєґдЄНиґЛеРСдЇОжЄРињСзЇњ(еЫЊ2)
ињЩжДПеС≥зЭАеЇПеИЧжЈ±еЇ¶зЪДжМБзї≠еҐЮеК†еҐЮеК†дЇЖзЛђзЙєзЪДVHеЇПеИЧе§Ъж†ЈжАІгАВињЩеПѓиГљжШѓзФ±дЇОеЬ®BCR-SeqињЗз®ЛдЄ≠дЄНжЦ≠еЉХеЕ•зЪДиѓѓеЈЃпЉМжЙАдї•жЧ†ж≥ХиЊЊеИ∞з®АйЗКжЫ≤зЇњзЪДй•±еТМгАВ
зЫЄжѓФдєЛдЄЛпЉМдљњзФ®жКАжЬѓйЗНе§НжЦєж≥ХпЉМVHеЇПеИЧзЪДз®АйЗКжЫ≤зЇњ(еЬ®дЄ§дЄ™йЗНе§НдєЛйЧіеЕ±дЇЂ)з°ЃеЃЮй•±еТМпЉМдїОиАМи°®жШОжµЛеЇПжЈ±еЇ¶з°ЃеЃЮиґ≥е§ЯпЉМеєґдЄФдїОжХ∞жНЃйЫЖдЄ≠еЕЕеИЖжґИйЩ§дЇЖйФЩиѓѓ(еЫЊ2B, C)гАВ
йЪПеРОеѓєBCR-SeqйЗНе§НеЇПеИЧињЫи°МSpearmanзІ©еЇПзЫЄеЕ≥еИЖжЮРпЉМеПСзО∞е≠ШеЬ®еФѓдЄАжКЧдљУVHеЇПеИЧйҐСзОЗеТМйЗНе§НеЇПеИЧдєЛйЧіеЕЈжЬЙзЫЄеЕ≥жАІгАВ
еѓєжЭ•иЗ™жЙАжЬЙзїДзїЗзЪДйЗНе§НеЇПеИЧдєЛйЧіеЕ±дЇЂзЪДй™МиѓБеЇПеИЧињЫи°Мз®АйЗКжЫ≤зЇњеИЖжЮРпЉМи°®жШОжЫ≤зЇњиЊЊеИ∞жЄРињСзЇњпЉМ60-80%зЪДreadsеН†ж†ЈжЬђдЄ≠еПѓиГље§Ъж†ЈжАІзЪД99%(еЫЊ2F)гАВ
еЫ†ж≠§пЉМи°®жШОпЉМжКАжЬѓйЗНе§НжЦєж≥ХеЬ®йЩНдљОBCR-SeqжЬЯйЧіеЉХеЕ•зЪДйФЩиѓѓзОЗжЦєйЭҐжШѓжЬЙжХИзЪДпЉМеєґдЄФеЬ®йЂШеЖНзО∞жАІзЪДжГЕеЖµдЄЛиЊЊеИ∞дЇЖиґ≥е§ЯзЪДжµЛеЇПи¶ЖзЫЦзОЗгАВ
дЄЇдЇЖз°ЃеЃЪBзїЖиГЮеЬ®жЙАжЬЙзїДзїЗдЄ≠зЪДеЕЛйЪЖжАІпЉМеЯЇдЇОзЫЄеРМзЪДVеТМJеЯЇеЫ†зЙЗжЃµдї•еПКCDRH3еМЇеЯЯ100%зЪДеРМжЇРжАІ(ж†ЄиЛЈйЕЄеРМжЇРжАІ)е∞ЖBзїЖиГЮиБЪйЫЖеЬ®дЄАиµЈгАВ
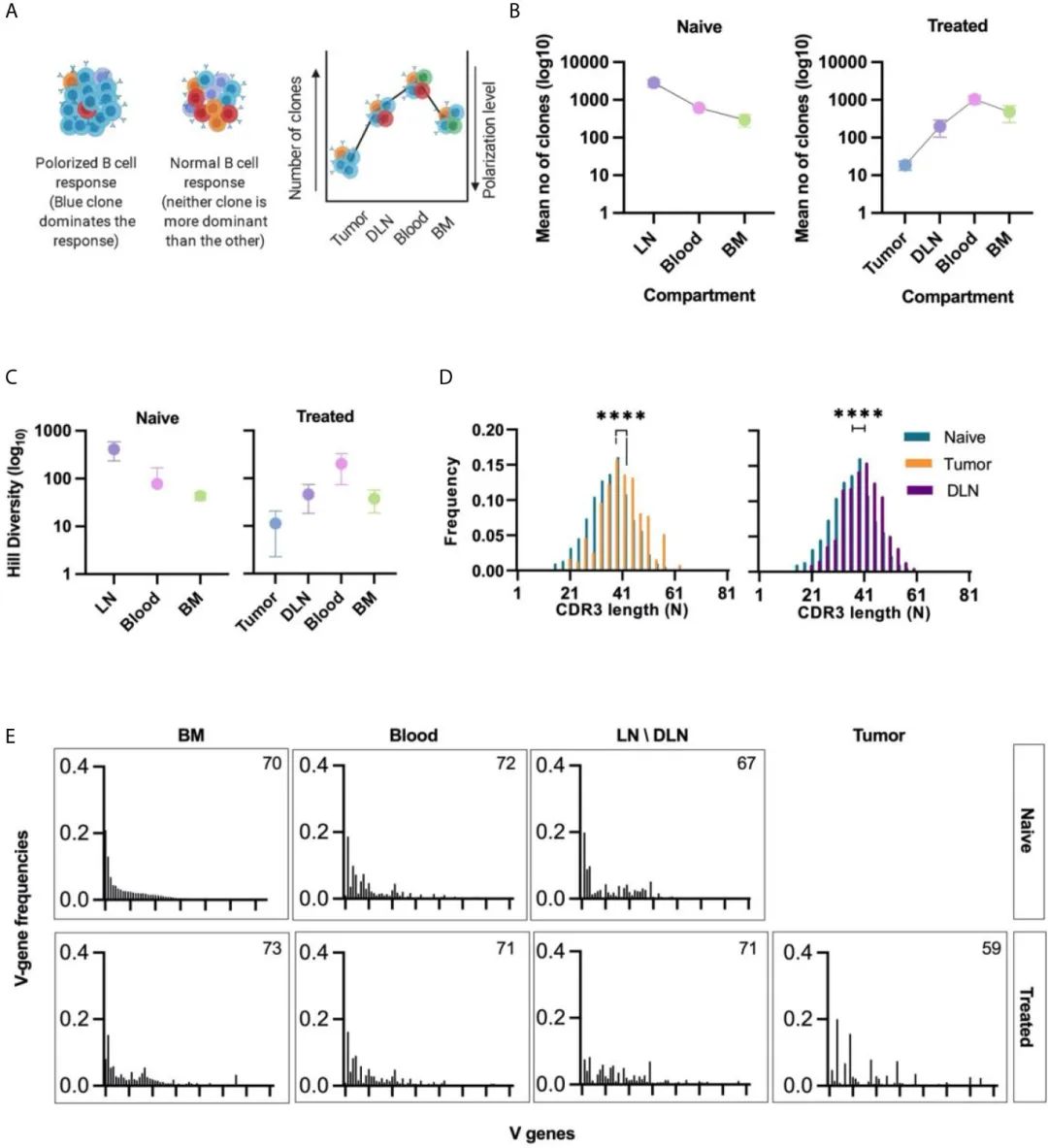
дїОеЕЛйЪЖжЮБеМЦеТМеЕЛйЪЖе§Ъж†ЈжАІдЄ§дЄ™еПВжХ∞жППињ∞дЇЖBзїЖиГЮзЪДеЕЛйЪЖзїУжЮДгАВеѓєдЇОзђђдЄАдЄ™еПВжХ∞пЉМйЂШеЕЛйЪЖжЮБеМЦ襀еЃЪдєЙдЄЇе∞СжХ∞BзїЖиГЮеЕЛйЪЖеЬ®зЙєеЃЪж†ЈеУБдЄ≠иі°зМЃдЇЖзїЭе§Іе§ЪжХ∞VHеЇПеИЧиѓїеПЦзЪДзКґжАБ(еЫЊ3A)гАВ
еЫ†ж≠§пЉМдЄЇдЇЖйЗПеМЦжѓПдЄ™зїДзїЗдЄ≠зЪДеЕЛйЪЖжЮБеМЦж∞іеє≥пЉМдљЬиАЕиЃ°зЃЧдЇЖеЬ®зЙєеЃЪзїДзїЗдЄ≠дЇІзФЯ80% VHеЇПеИЧиѓїеПЦзЪДBзїЖиГЮеЕЛйЪЖзЪДжХ∞йЗПгАВзїУжЮЬеПСзО∞пЉМеЬ®TMEдЄ≠пЉМеє≥еЭЗжЬЙ20зІНиВњзШ§еЖЕеЕНзЦЂзРГиЫЛзЩљеЕЛйЪЖеЮЛдЄїеѓЉBзїЖиГЮеПНеЇФпЉМиАМеЬ®еЕґдїЦзїДзїЗдЄ≠пЉМиі°зМЃ80% readsзЪДеЕЛйЪЖжХ∞йЗПжѓФTMEйЂШ2-3дЄ™жХ∞йЗПзЇІ(еЫЊ3B)гАВ
иЃ°зЃЧзЪДзђђдЇМдЄ™еПВжХ∞жШѓеЕЛйЪЖе§Ъж†ЈжАІпЉМеЃГеПНжШ†дЇЖжѓПдЄ™зїДзїЗдЄ≠е≠ШеЬ®зЪДеФѓдЄАBзїЖиГЮеЕЛйЪЖзЪДжХ∞йЗПгАВиѓ•еПВжХ∞еПѓзФ®дљЬжМЗз§ЇжАІеЇ¶йЗПпЉМдї•з°ЃеЃЪеУНеЇФзЪДжАІиі®жШѓеѓ°еЕЛйЪЖињШжШѓе§ЪеЕЛйЪЖгАВHillе§Ъж†ЈжАІ(41)и°®жШОиВњзШ§дЄ≠зЪДеЕЛйЪЖе§Ъж†ЈжАІжШОжШЊдљОдЇОеЕґдїЦзїДзїЗдЄ≠зЪДеЕЛйЪЖе§Ъж†ЈжАІпЉМињЩдЄАеПСзО∞дЄОеЕЛйЪЖжЮБеМЦзЪДжХ∞жНЃдЄАиЗі(еЫЊ3C)гАВ
TIL-BеПНеЇФзЪДдљОе§Ъж†ЈжАІеТМйЂШжЮБеМЦж∞іеє≥и°®жШОпЉМеЬ®дљЬиАЕзЪДTNBCж®°еЮЛдЄ≠пЉМиВњзШ§зїДзїЗеЖЕеПСзФЯдЇЖBзїЖиГЮеЕЛйЪЖеҐЮжЃЦгАВж≠£е¶ВйҐДжЬЯзЪДйВ£ж†ЈпЉМйЭ†ињСеОЯеПСиВњзШ§зЪДDLNsдЄ≠зЪДBзїЖиГЮеПНеЇФдєЯи°®зО∞еЗЇйЂШеЕЛйЪЖжЮБеМЦж∞іеє≥(дЄОвАЬna√ѓveвАЭжЈЛеЈізїУзЫЄжѓФ)(еЫЊ3B)еТМдљОHillе§Ъж†ЈжАІ(еЫЊ3C)гАВ
зДґеРОпЉМдљЬиАЕеИЖжЮРдЇЖCDRH3зЪДйХњеЇ¶еИЖеЄГпЉМдљЬдЄЇиВњзШ§жИЦйВїињС DLNsдЄ≠еПѓиГљеПСзФЯзЪДйШ≥жАІеЕЛйЪЖйАЙжЛ©ињЗз®ЛзЪДжМЗз§ЇжАІжµЛйЗПгАВTIL-BеЕЛйЪЖзЪДCDRH3еє≥еЭЗйХњеЇ¶жШОжШЊйХњдЇОna√ѓveе∞ПйЉ†й™®йЂУдЄ≠BзїЖиГЮеЕЛйЪЖзЪДCDRH3йХњеЇ¶гАВеЬ®DLNи°НзФЯзЪДBзїЖиГЮдЄ≠иІВеѓЯеИ∞CDRH3йХњеЇ¶зЪДзЫЄеРМеБПеЈЃ(еЫЊ3D)гАВ
жКЧдљУеЇУеПѓдї•ж†єжНЃеЕґдљњзФ®еЯЇеЫ†зЙЗжЃµзЪДйҐСзОЗжЭ•жППињ∞[V(D)J]пЉМзЙєеИЂжШѓVеЯЇеЫ†зЙЗжЃµпЉМеЫ†дЄЇеЃГжШѓжЬАйХњеТМжЬАе§Ъж†ЈеМЦзЪДзЙЗжЃµ(42)гАВVеЯЇеЫ†еЬ®na√ѓve BзїЖиГЮдЇЪзЊ§дЄ≠зЪДдљњзФ®жШѓзФ±еНКйЪПжЬЇињЗз®ЛеЖ≥еЃЪзЪДпЉМеѓЉиЗіV-D-JзЙЗжЃµеЬ®еЯЇеЫ†йЗНжОТињЗз®ЛдЄ≠дљЬдЄЇBзїЖиГЮеПСиВ≤зЪДдЄАйГ®еИЖиАМеЕ≥иБФ(43)гАВеЫ†ж≠§пЉМеБЗиЃЊVеЯЇеЫ†дљњзФ®дїОna√ѓveе∞ПйЉ†й™®йЂУдЄ≠еИЖз¶їзЪДIgM+ BзїЖиГЮеПѓзФ®дЇОз°ЃеЃЪвАЬеЯЇз°АвАЭVеЯЇеЫ†зЪДдљњзФ®пЉМе¶ВеЙНжЙАињ∞(44)гАВж†єжНЃдЄЛйЩНйҐСзОЗдЄОвАЬеЯЇз°АвАЭVеЯЇеЫ†дљњзФ®йҐСзОЗеѓєжЙАжЬЙзїДзїЗдЄ≠зЪДVеЯЇеЫ†дљњзФ®ињЫи°МеИЖз±їгАВеПСзО∞TIL-BеТМDLNеЕЛйЪЖдЄ≠зЪДVеЯЇеЫ†дљњзФ®зЙєеЊБдЄОвАЬеЯЇз°АвАЭзЙєеЊБжЬЙеЊИе§ІдЄНеРМ(еЫЊ3EеТМи°•еЕЕеЫЊS3)гАВињЩзІНVеЯЇеЫ†дљњзФ®зЪДжФєеПШеσ俕襀聧䪯жШѓйБЗеИ∞жКЧеОЯеРОеПСзФЯзЪДеЕЛйЪЖйАЙжЛ©ињЗз®ЛзЪДдЄАдЄ™жМЗж†ЗгАВ
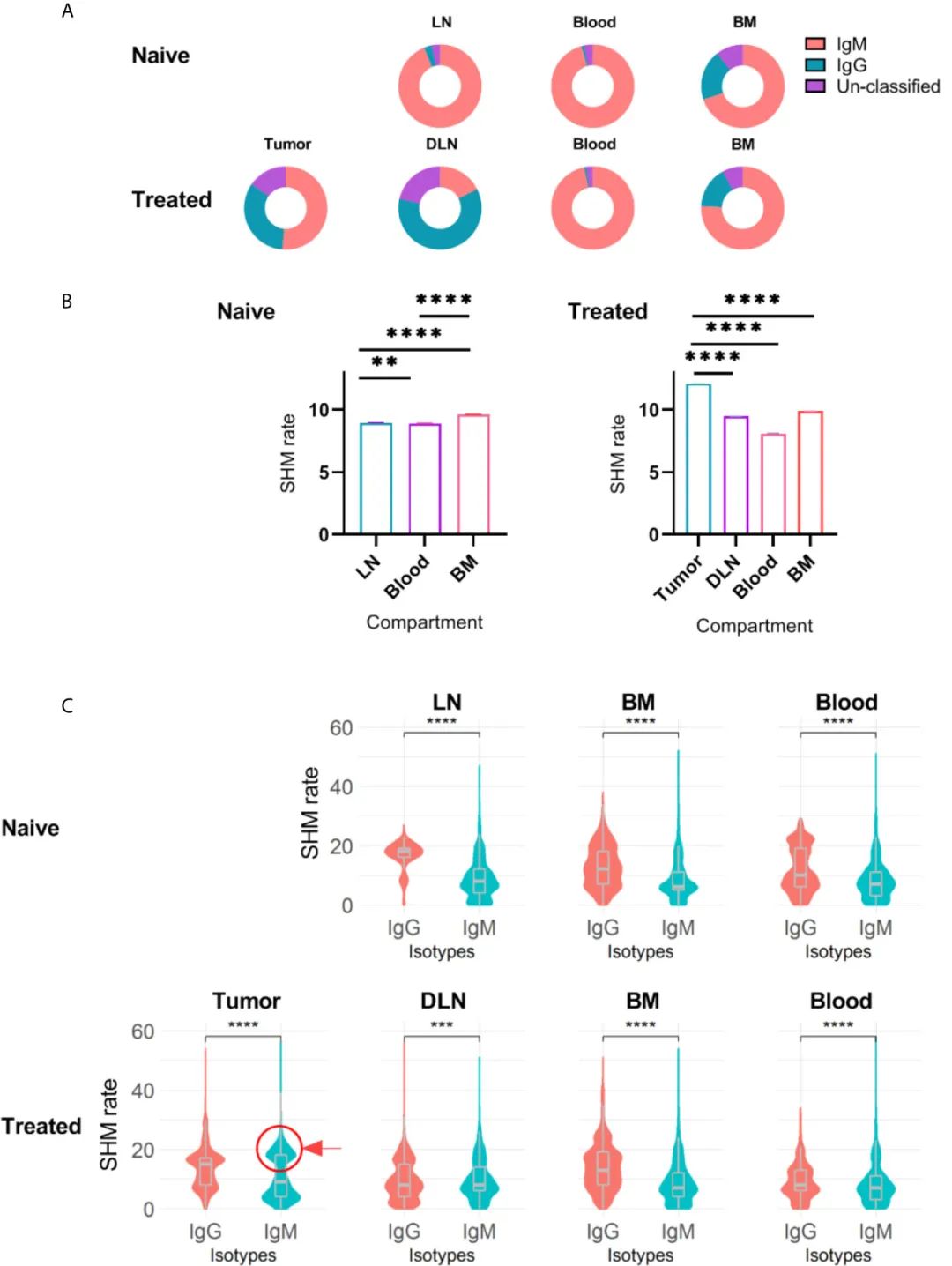
жХ∞жНЃжШЊз§ЇпЉМеЬ®na√ѓveеТМе§ДзРЖињЗзЪДе∞ПйЉ†дЄ≠пЉМIgMжШѓй™®йЂУBзїЖиГЮзЪДдЄїи¶БеРМеЮЛпЉМиАМдЄАе∞ПйГ®еИЖBзїЖиГЮжШѓIgG+ (75% IgMеТМ20% IgGпЉМеЫЊ4A)гАВ
еЬ®еИЖжЮРжЭ•иЗ™и°Ажґ≤зЪДе∞ПйЉ†BзїЖиГЮжЧґиІВеѓЯеИ∞з±їдЉЉзЪДеИЖеЄГ;еЬ®жЙАжЬЙе∞ПйЉ†дЄ≠пЉМжЧ†иЃЇж≤їзЦЧжИЦжЬ™ж≤їзЦЧпЉМдЉШеКњеРМеЮЛеЭЗдЄЇIgM(96%)пЉМеПНжШ†дЇЖna√ѓve BзїЖиГЮжИЦйЭЮCSRиЃ∞ењЖBзїЖиГЮзЉЦз†БзЪДжКЧдљУ(еЫЊ4A)гАВ
ж≠£е¶ВйҐДжЬЯзЪДйВ£ж†ЈпЉМж≤їзЦЧе∞ПйЉ†DLNsдЄ≠BзїЖиГЮзЉЦз†БзЪДIgG/IgMжѓФеАЉйЂШдЇОna√ѓveе∞ПйЉ†жЈЛеЈізїУдЄ≠зЪДIgG/IgMжѓФеАЉгАВжЬАеРОпЉМTIL-Bs дЄїи¶Бдї•IgMдЄЇдЄїпЉМIgGеЕґжђ°(еЫЊ4A)гАВ
дЄЇдЇЖињЫдЄАж≠•жΥ糥жМЗз§ЇBзїЖиГЮжњАжіїзКґжАБзЪДеЇУжµЛйЗПеАЉпЉМдљЬиАЕеИЖжЮРдЇЖдЄНеРМеРМзІНеЮЛзЪДжѓПдЄ™зїДзїЗдЄ≠зЪДSHMзОЗгАВеПСзО∞TIL-BеЃ§зЪДSHMзОЗ(12дЄ™з™БеПШзЪДеє≥еЭЗеАЉ)жШЊиСЧйЂШдЇОDLNsгАБй™®йЂУеТМи°Ажґ≤гАВдї§дЇЇжДПе§ЦзЪДжШѓпЉМеЬ®SHMзОЗеЊИйЂШеРМжЧґTIL-BsеНіжШѓдї•IgMдЄЇдЄїзЪДгАВ
дЄЇдЇЖињЫдЄАж≠•з†Фз©ґињЩдЄАиІВеѓЯзїУжЮЬпЉМдљЬиАЕжѓФиЊГдЇЖжЙАжЬЙзїДзїЗдЄ≠еРМзІНеЉВеЮЛзЪДSHMзОЗгАВж≠£е¶ВйҐДжЬЯзЪДйВ£ж†ЈпЉМIgG+ BзїЖиГЮзЪДSHMзОЗжШОжШЊйЂШдЇОIgM+ BзїЖиГЮпЉМеЫ†дЄЇIgG+ BзїЖиГЮ襀聧䪯жШѓжіїеМЦзЪДBзїЖиГЮпЉМеЫ†ж≠§еЈ≤зїПзїПеОЖдЇЖдЇ≤еТМжИРзЖЯеТМCSRињЗз®ЛгАВж≠§е§ЦпЉМйАЪињЗж£АжµЛIgG+ BзїЖиГЮдЇЪзЊ§дЄ≠зЪДSHMзОЗеИЖеЄГпЉМдљЬиАЕеПСзО∞дЇЖдЄНеРМж∞іеє≥зЪДSHMпЉМдї£и°®дЇЖе§ДдЇОдЄНеРМдЇ≤еТМеКЫжИРзЖЯйШґжЃµзЪДBзїЖиГЮ(еЫЊ4C)
еѓєIgM+ BзїЖиГЮдЄ≠SHMзОЗеИЖеЄГзЪДињЫдЄАж≠•ж£АжЯ•жШЊз§ЇпЉМйЩ§иВњзШ§е§ЦпЉМжЙАжЬЙзїДзїЗдЄ≠SHMзОЗеИЖеЄГдЄЇеНХе≥∞еИЖеЄГ(еНХдЄ™дЉШеКње≥∞)пЉМиВњзШ§дЄ≠SHMзОЗеИЖеЄГдЄЇеПМе≥∞еИЖеЄГ(дЄАдЄ™е≥∞дљОSHMзОЗпЉМеП¶дЄАдЄ™е≥∞йЂШSHMзОЗпЉМеЫЊ4C)гАВ
IgM+ TIL-BдЇЪзЊ§дЄ≠зЪДзђђдЇМдЄ™е≥∞(еЫЊ4CдЄ≠зФ®еЬЖеЬИз™БеЗЇжШЊз§Ї)дї£и°®зїПеОЖдЇЖдЇ≤еТМжИРзЖЯдљЖж≤°жЬЙCSRзЪДBзїЖиГЮгАВеѓєдЇОињЩдЄ™зЙєжЃКзЪДиІВеѓЯзїУжЮЬпЉМдЄАдЄ™еПѓиГљзЪДиІ£йЗКжШѓпЉМеЬ®TIL-BsжЬЙиґ≥е§ЯзЪДжЧґйЧіеЃМжИРCSRињЗз®ЛдєЛеЙНе∞±иОЈеПЦдЇЖеЃГдїђгАВеП¶дЄАзІНеПѓиГљзЪДиІ£йЗКжШѓпЉМзФ±дЇОTMEзЪДиЗізШ§жіїжАІпЉМCSRдњ°еПЈеПЧжНЯгАВ
дљЬиАЕеЬ®иВњзШ§дЄ≠еє≥еЭЗйЙіеЃЪеЗЇ1250дЄ™BзїЖиГЮеЕЛйЪЖпЉМиАМеЕґдїЦзїДзїЗдЄ≠BзїЖиГЮеЕЛйЪЖзЪДжХ∞йЗПжЫійЂШ(DLNs=4700пЉМи°Ажґ≤=5550пЉМй™®йЂУ=12110пЉЙгАВдЄЇдЇЖињљиЄ™TIL-BеЕЛйЪЖеЬ®DLNsгАБи°Ажґ≤еТМй™®йЂУдЄ≠зЪДеИЖеЄГпЉМдљЬиАЕз°ЃеЃЪдЇЖиВњзШ§еТМеЕґдїЦдЄЙзІНзїДзїЗз±їеЮЛдЄ≠зЪДдїїдљХдЄАзІНзЪДеЕ±дЇЂеЕЛйЪЖгАВеЫ†ж≠§пЉМдљЬиАЕе∞ЖеЗЇзО∞еЬ®иВњзШ§еТМиЗ≥е∞СдЄАдЄ™йЩДеК†зїДзїЗдЄ≠зЪДеЕЛйЪЖеЃЪдєЙдЄЇжЩЃйАЪеЕЛйЪЖпЉМеєґж£АжЯ•еЃГдїђеЬ®жѓПдЄ™зїДзїЗдЄ≠зЪДйҐСзОЗ(еЫЊ5A;жЬЙеЕ≥еЄЄиІБеЕЛйЪЖжХ∞зЫЃзЪДиѓ¶жГЕиљљдЇОи°•еЕЕи°®S4)
дЄЇдЇЖз°ЃеЃЪеЬ®ињЩдЇЫжЩЃйАЪеЕЛйЪЖдЄ≠жШѓеР¶е≠ШеЬ®ињЗе§ЪзЪДVеЯЇеЫ†пЉМеЬ®na√ѓveзїДзїЗдЄ≠иІВеѓЯеИ∞зЪДеНКйЪПжЬЇVеЯЇеЫ†дљњзФ®дЄОеЬ®жЩЃйАЪеЕЛйЪЖеЮЛдЄ≠иІВеѓЯеИ∞зЪДVеЯЇеЫ†дљњзФ®зЪДжѓФиЊГ(еЫЊ5B)жШЊз§ЇпЉМ13дЄ™VеЯЇеЫ†еЬ®ж≤їзЦЧе∞ПйЉ†дЄ≠жШЊзЭАињЗеЇ¶и°®иЊЊпЉМеЕґдЄ≠8дЄ™VеЯЇеЫ†еЬ®иЗ≥е∞СдЄ§еП™е∞ПйЉ†дЄ≠жШѓеЕ±еРМзЪДгАВеЬ®3еП™е∞ПйЉ†дЄ≠пЉМIGHV3-1гАБIGHV1-7еТМIGHV2-2 VеЯЇеۆ襀ињЗеЇ¶и°®иЊЊгАВињЩдЇЫињЗеЇ¶дї£и°®зЪДVеЯЇеЫ†еПѓиГљи°®жШОпЉМзФ±дЇОдЄОиВњзШ§жИЦTMEдЄ≠зЪДTAAsжО•иІ¶пЉМеЬ®жЩЃйАЪеЕЛйЪЖдЄ≠еПѓиГљеПСзФЯдЇЖиґЛеРМињЗз®ЛгАВеЬ®ж≠§еЯЇз°АдЄКињЫи°МдЇЖеИЖжЮРпЉМеЬ®иЗ≥е∞С3еП™е∞ПйЉ†зЪДеЕ±еРМеЕЛйЪЖдЄ≠пЉМеПСзО∞4дЄ™VеЯЇеЫ†жШЊзЭА襀дљОдЉ∞(IGHV7-1гАБIGHV5-6гАБIGHV1-9еТМIGHV5-2)гАВ
ж≠§е§ЦпЉМдљЬиАЕињШз†Фз©ґдЇЖеЬ®еЕ±еРМеЕЛйЪЖдЄ≠SHMж®°еЉПжШѓеР¶жЫіеБПеРСдЇОж≤њзЭАVHеМЇеЯЯпЉИFRеТМCDRпЉЙеЉХеЕ•гАВж≠£е¶ВйҐДжЬЯзЪДйВ£ж†ЈпЉМдЄОзЫЄйВїзЪДFRзЫЄжѓФпЉМCDRH1-2и°®зО∞еЗЇжЫійЂШзЪДSHMйАЯзОЗпЉИеЫЊ5CпЉЙгАВ
жО•дЄЛжЭ•пЉМдЄЇдЇЖжОҐз©ґеЬ®жЩЃйАЪеЕЛйЪЖдЄ≠дЄОna√ѓveе∞ПйЉ†дЄ≠йЙіеЃЪзЪДжЙАжЬЙеЕЛйЪЖдЄ≠жШѓеР¶еБПжЦЬпЉМдљЬиАЕж£АжЯ•дЇЖCDRH3йХњеЇ¶зЪДеИЖеЄГ(еЫЊ5D)гАВиЩљзДґжЩЃйАЪеЕЛйЪЖеТМna√ѓveеЕЛйЪЖзЪДCDRH3йХњеЇ¶дЄ≠дљНжХ∞еЭЗдЄЇ13 AA (n = 930, n = 11995)пЉМдљЖжЩЃйАЪеЕЛйЪЖеЮЛзЪДCDRH3йХњеЇ¶еИЖеЄГз°ЃеЃЮи°®зО∞еЗЇдЄОna√ѓve BзїЖиГЮдЄНеРМзЪДеИЖеЄГж®°еЉПгАВ
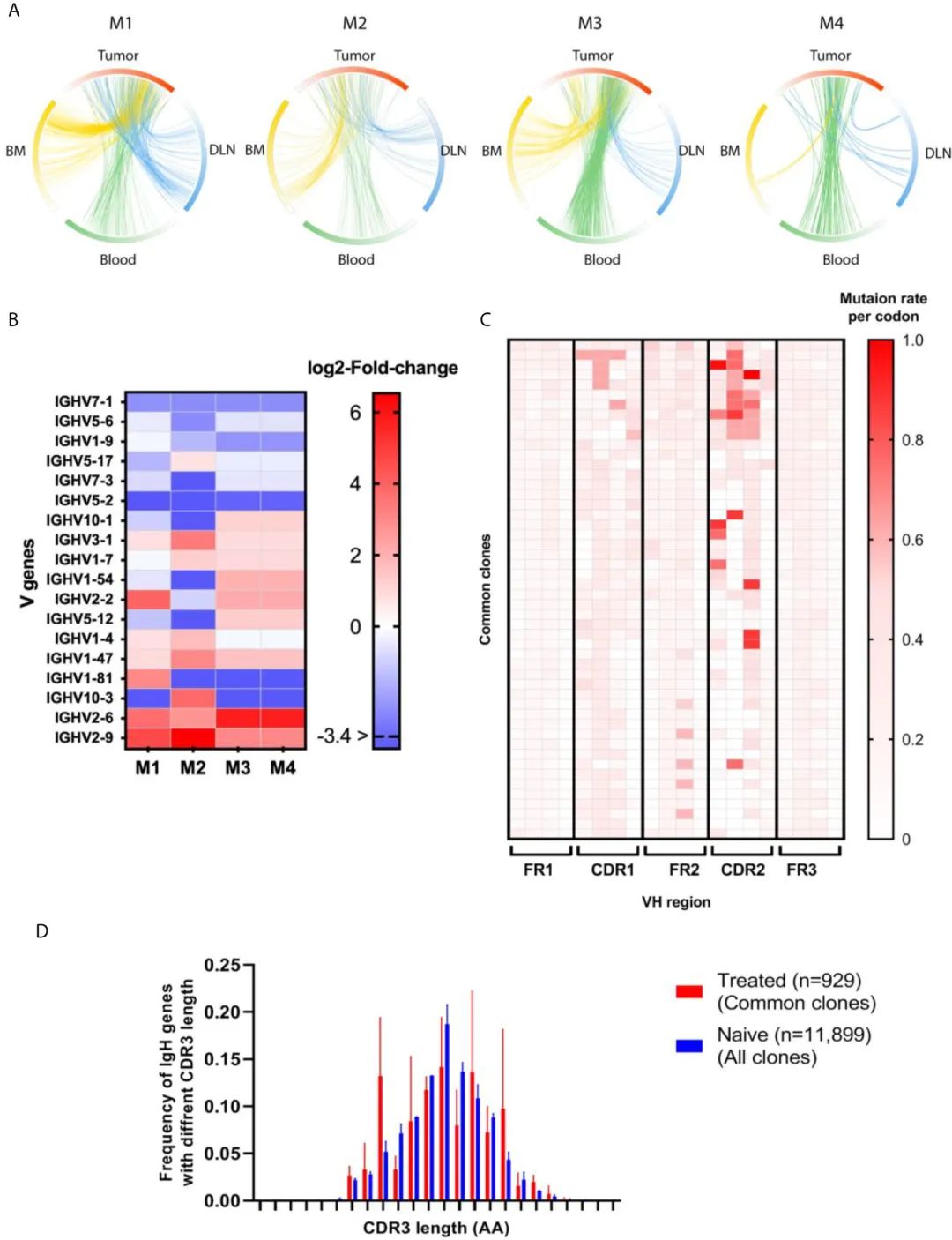
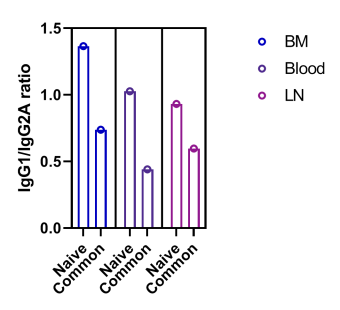
жЬАеРОпЉМе∞ПйЉ†дЇІзФЯеЫЫзІНIgGдЇЪз±їпЉМеН≥IgG1гАБIgG2AгАБIgG2BеТМIgG3гАВеЕЈдљУжЭ•иѓіпЉМжЬЙз†Фз©ґи°®жШОпЉМIgG1/IgG2AйҐСзОЗжѓФдљОеПНжШ†дЇЖTh1еЇФз≠ФйЂШдЇОTh2еЇФз≠ФгАВIgG1зЪДдЇІзФЯеЬ®Th2зїЖиГЮеЫ†е≠РIL-4зЪДдљЬзФ®дЄЛеНЗйЂШпЉМIgG2AзЪДдЇІзФЯеЬ®Th1зїЖиГЮеЫ†е≠РIFN-gзЪДдљЬзФ®дЄЛеНЗйЂШ(45,46)гАВдЄЇдЇЖж£АжЯ•еЬ®жЩЃйАЪеЕЛйЪЖдЄ≠еПСзО∞зЪДIgG1дЄОIgG2AйҐСзОЗжѓФзОЗзЪДдїїдљХеПШеМЦпЉМжИСдїђиЃ°зЃЧдЇЖna√ѓveе∞ПйЉ†й™®йЂУгАБи°Ажґ≤еТМжЈЛеЈізїУдЄ≠BзїЖиГЮдЄ≠зЪДIgG1/IgG2AжѓФзОЗпЉМеєґе∞ЖеЕґдЄОиВњзШ§е∞ПйЉ†(еН≥иВњзШ§еТМй™®йЂУгАБи°Ажґ≤жИЦDLNеЕ±жЬЙзЪДеЕЛйЪЖ)дЄ≠дЄКињ∞жѓПзІНзїДзїЗз±їеЮЛзЪДиВњзШ§еЄЄиІБеЕЛйЪЖдЄ≠зЪДжѓФзОЗињЫи°МдЇЖжѓФиЊГгАВдљЬиАЕеПСзО∞пЉМжЩЃйАЪеЕЛйЪЖдЄ≠зЪДIgG1/Ig2AжѓФдЊЛеє≥еЭЗжѓФna√ѓveе∞ПйЉ†дЄ≠зЪДжѓФдЊЛдљОдЄ§еАН(и°•еЕЕеЫЊS4)гАВ
дљЬиАЕеИ©зФ®еЃЮй™МеТМиЃ°зЃЧеє≥еП∞жЭ•йШРжШОTNBCе∞ПйЉ†еЫЫзІНзїДзїЗдЄ≠зЪДдњЭзХЩеЇУжµЛйЗПгАВй¶ЦеЕИпЉМжЙІи°МдЇЖеЗ†дЄ™иі®йЗПдњЭиѓБж≠•й™§пЉМдї•з°ЃдњЭжКЧдљУеЇПеИЧжШѓйЂШиі®йЗПзЪДпЉМеєґдЄФиОЈеЊЧзЪДеЇПеИЧжШѓеПѓйЗНе§НзЪДгАВињЩжШѓйАЪињЗеѓєжЙАжЬЙNGSеЇУдљњзФ®еЃЮй™МеЙѓжЬђжЭ•еЃЮзО∞зЪДгАВињЩзІНжЦєж≥ХпЉМеК†дЄКдљњзФ®йҐЭе§ЦзЪДињЗжї§еЩ®пЉМдЇІзФЯдЇЖйЂШиі®йЗПзЪДжКЧдљУVHеЇПеИЧжХ∞жНЃйЫЖгАВзДґеРОињЫдЄАж≠•еИЖжЮРжЙАеЊЧзЪДйЂШиі®йЗПжХ∞жНЃйЫЖпЉМдї•з°ЃеЃЪеЕЈжЬЙдЄНеРМзЙєеЊБзЪДжЫ≤зЫЃжО™жЦљпЉМи°®жШОTIL-Bsз°ЃеЃЮдЄОTMEдЄ≠зЪДиВњзШ§зїЖиГЮ/TAAsеПСзФЯдљЬзФ®гАВ
еЫ†ж≠§пЉМињЩй°єз†Фз©ґиѓБжШОTNBCе∞ПйЉ†иВњзШ§еТМDLNsдЄ≠зЪДBзїЖиГЮзЊ§еѓМеРЂBзїЖиГЮзЙєеЊБзЪДеЕЛйЪЖпЉМињЩи°®жШОSHMзОЗеҐЮеК†гАБVеЯЇеЫ†дљњзФ®еТМCDRH3йХњеЇ¶еАЊжЦЬгАВж≠§е§ЦпЉМйАЪињЗжѓФиЊГTIL-BsдЄОDLNsгАБй™®йЂУеТМи°Ажґ≤дЄ≠зЪДBзїЖиГЮзЪДеЕЛйЪЖжАІпЉМеПѓдї•еПСзО∞TIL-Bsи°®зО∞еЗЇдљОеЕЛйЪЖе§Ъж†ЈжАІеТМйЂШеЕЛйЪЖжЮБеМЦпЉМеН≥жЩЃйБНе≠ШеЬ®жХ∞йЗПжЬЙйЩРзЪДдЄНеРМзЪДBзїЖиГЮеЕЛйЪЖпЉМињЩдЇЫеЕЛйЪЖеН†жНЃдЇЖTMEдЄ≠BзїЖиГЮеЇФз≠ФзЪДе§ІйГ®еИЖгАВ
еПНеЇФжАІеЕ®еЇУжµЛйЗПзЪДйЙіеЃЪ(иВњзШ§еПНеЇФжАІBзїЖиГЮжИЦTRBCs)зЪДTIL-Bs еЬ®жЬ™жЭ•зЪДз†Фз©ґдЄ≠еЕЈжЬЙеЊИе§ІзЪДеЇФзФ®жљЬеКЫгАВдЊЛе¶ВпЉМжКЧдљУеЇУеИЖжЮРеТМеЕ®е±АеЯЇеЫ†и°®иЊЊи∞±зЪДзїУеРИе∞ЖеЕБиЃЄињЫдЄАж≠•жΥ糥TRBCs еТМTMEдєЛйЧіеПѓиГљзЪДзЫЄдЇТељ±еУНпЉМдїОиАМдњГињЫеѓєBзїЖиГЮеЬ®TMEдЄ≠зЪДдљЬзФ®зЪДз†Фз©ґпЉМеѓєеЕИињЫеЕНзЦЂзЦЧж≥ХзЪДеЉАеПСеЕЈжЬЙзЫіжО•жДПдєЙгАВ
еПВиАГжЦЗзМЃ
Aizik L, Dror Y, Taussig D,Barzel A, Carmi Y and Wine Y(2021) Antibody Repertoire Analysis of Tumor-Infiltrating B Cells Reveals Distinct Signatures and Distributions Across Tissues. Front. Immunol. 12:705381.doi: 10.3389/fimmu.2021.705381
дїАдєИжШѓImmuHub¬ЃжКАжЬѓпЉЯ

жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљеЖЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂеЯЇеЫ†зїДе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇSeq-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛпЉМеєґжОИжЭГж≥ЫзФЯе≠РпЉИзЇ≥жЦѓиЊЊеЕЛдї£з†БпЉЪGTHпЉЙдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-TraqиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq |TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHubеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier зЦЊзЧЕжЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TиНѓзЙ©еЉАеПСз≠Йеє≥еП∞зЃ°зЇњгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВ

