
原名:Single-cell analysis of human B cell maturation predicts how antibody class switching shapes selection dynamics
译名:人类B细胞成熟的单细胞分析预测抗体类切换如何影响选择动力学
发表期刊:Science immunology
发表日期:2021年2月12
影响因子:24.8
背景
为了提高我们对人B细胞在体内成熟过程中细胞、转录和抗体库动态的理解,作者对一种被广泛研究的SLO模型——人扁桃体进行了无偏的单细胞转录组学和库分析。这些整合的大容量和单细胞抗体库与单细胞转录组学配对,能够定义转录B细胞状态,包括详细探索MBC异质性,重建时间基因表达动态,并解决与抗体类别切换相关的GC和MBCs的功能。人类B细胞成熟的路线图提供了前所未有的B细胞介导免疫形成的分辨率,是研究正常和病理B细胞反应的宝贵资源。
实验设计
通过对已分类的B细胞群体进行大量抗体库测序(Bulk BCR-seq),结合使用单细胞转录组学和VDJ-seq对基因表达和库进行无偏性表征,来表征人类扁桃体B细胞状态的抗体库。
1.使用了接受常规扁桃体切除术的儿童患者(>3岁)的扁桃体样本,
2.将大量抗体库和单细胞抗体库一起分析,以检查抗体库的亚群特异性特征,并在scVDJ-seq试验中增加鉴定克隆相关B细胞的能力。
3.免疫细胞群是通过scRNA-seq数据集的无偏聚类以及已知和以前未报道的基因表达标记和B细胞亚群抗体库特征的注释来鉴定的。
4.用流式细胞术进一步检测新鉴定的种群。拟时序分析是为了检验不同B细胞成熟阶段之间的关系。
5.为了验证抗体类别与B细胞命运和功能相关的假设,将抗体类别特异性B细胞的单细胞转录组与匹配的SHM频率进行了比较,并进行了差异基因表达和途径富集分析。
结果
01定义人扁桃体B细胞的抗体CSR图谱
大多数人类高通量抗体库测序研究都检测了外周血B细胞亚群,这与活性SLOs的动态库亚基本不同。为了提供人类扁桃体抗体库景观的亚类特异性和定量分析,作者使用独特的分子标识符(UMI)对四个广义扁桃体B细胞亚群的抗体库进行了naïve, GC, memory和PBs测序(图1A)。
作者分析了复发性扁桃体炎患者和阻塞性睡眠呼吸暂停患者的扁桃体B细胞,发现大量荧光活化细胞分选(FACS)分选的B细胞库与供体匹配的未分选单细胞抗体库之间存在良好的一致性(图2)。正如预期的那样,naïve B细胞库主要未切换和未突变。GC和MBCs由开关和未开关的IgH序列组成,SHM升高,PBs几乎全部开关和高度突变(图1B和C)。
GC内较高的IgH-SHM频率通常反映出较高的亲和性BCRs,并被认为使GC B细胞倾向于PB而不是MBC命运。与此一致的是,扁桃体中PB衍生的基因库通常比MBCs含有更高的SHM频率(图1C)。然而,通过解析抗体亚类,作者发现SHM水平在不同的成熟B细胞亚群之间大致相似,除了IgD,并且沿着免疫球蛋白位点的频率增加(图1D)。
比较亚类特异性MBCs和PBs的克隆多样性发现,与相同同型的PBs相比,未切换的和IgA+MBCs的克隆扩增较少(由更高的多样性证明),而IgG+ MBCs和PBs的克隆扩增程度相似(图1E)。这可能不能用SHM频率的差异来解释(图1D),但可能反映了与CSR结果相关的它们的选择或细胞命运规格的差异。当作者检查这些广泛定义的B细胞群中的抗体亚类频率时,作者发现,除了保留IgM表达的倾向增加外,MBCs表达IgA1或IgA2的可能性分别是PBs的3.3倍或7.3倍,而PBs更可能表达IgG1(图1F)。这些富集与特定的B细胞命运有关,甚至对于跨越不同亚群的扩展克隆也是如此(图1G)。
为了探索这些亚群特异性类切换模式是如何产生的,作者重建了28,845个扩增克隆的系统发育,并计算了在密切相关的B细胞之间发生特定CSR事件的可能性,而不是偶然发生的可能性(图1H),类似于在外周血B细胞中进行的分析。MBC克隆谱系显示出更大的可能性,在沿着IgH位点的线性空间中,密切相关的同型对发生切换。与PB克隆相比,PB克隆表现出更广泛的同型切换模式(图1H)。无论是抗体亚类频率还是重组的类切换层次都与GC细胞非常相似,这与提出的GC细胞随机退出的模型一致,而不是浆细胞命运的主动选择。
总之,这些分析提供了证据,证明基于抗体的选择机制对于两种主要的B细胞命运不同,这似乎与成熟早期CSR的结果有关。
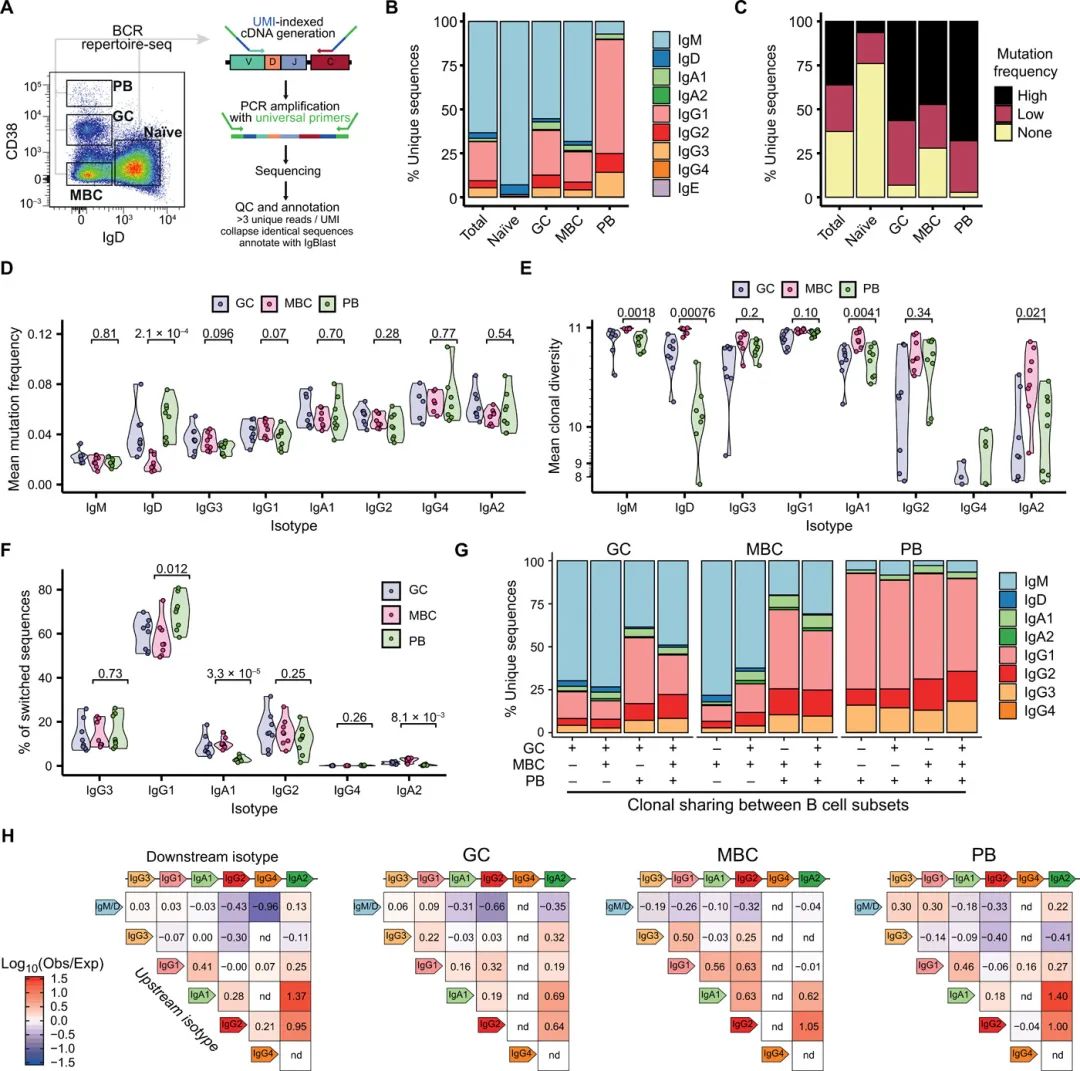
图1 人类扁桃体B细胞的亚类和亚群特异性特征。
02扁桃体免疫细胞的单细胞图谱定义了成熟过程中不同的B细胞状态
基于FACS的策略来研究人体组织中的动态细胞过程可能会错过罕见或未知的细胞群。因此,与大量抗体库(图1)平行,作者对来自相同样品的未分类扁桃体免疫细胞进行了单细胞RNA测序(scRNA-seq)和单细胞免疫球蛋白VDJ测序(scVDJ-seq)配对(图2A和B)。经过严格的质量控制,作者保留了32,607个细胞的转录组(n = 7;中位数为3142,平均每个供者4658个细胞),从中作者确定了30个不同的细胞群(图2C和D)。虽然作者的主要重点是了解B细胞的成熟,但作者注释了11个T细胞和7个非淋巴细胞群体(图2C)作为研究这些细胞的宝贵资源。
扁桃体是一种既能诱导全身免疫又能诱导粘膜免疫的典型SLO。作者发现主要的扁桃体免疫细胞状态在其他SLOs 中广泛保守,如淋巴结和脾脏,与其他分析类似,尽管观察到儿童扁桃体中GC相关细胞状态的富集可能反映了供体年龄的差异(图2B至D)。作者还观察到抗体特征的差异(图2E和F),这可能反映了局部细胞因子环境的组织特异性差异。不同SLOs 细胞状态的广泛保守性支持将扁桃体作为研究全身免疫的模型系统,并强调了分析免疫活性组织以理解GC依赖性B细胞成熟的重要性。
接下来,作者在单细胞转录组图谱中检查了B细胞状态。为了提高单细胞抗体库分析的能力和准确性,整合了每个供体的单细胞和批量抗体库(图2E)。基于基因表达的无偏聚类(图F),作者鉴定了12个不同的B细胞群,并量化了它们的抗体同型频率(图G)、SHM水平(图H)、克隆多样性(图2I和J),以及与其他B细胞亚群的关系(图K和图L)。所有人群在患者中均可重复观察,而不考虑扁桃体炎病史(图M)。作者确定了人类扁桃体中B细胞成熟的所有主要阶段,包括naïve、活化、GC(包括LZ和非增殖DZ细胞)、MBCs、组织内Fc受体4 (FCRL4+) MBCs、PBs和主要由DZ GC细胞组成的循环群体(图2H)。作者还注释了一个类别切换、超突变和克隆扩增的GC B细胞亚群,表达PB特异性转录因子(PRDM1和XBP1)(图2F至J)。作者发现pre-PB GC细胞选择性地表达了几个有趣的基因标记,包括信号分子,揭示了形成人类B细胞介导免疫的动态细胞状态,如FRZB和BTNL9(图2F)。
作者在GC中发现了转录不同且克隆扩增的IgM+ B细胞群,其与抑制性BCR信号相关的基因表达升高,如FCRL3, FCRL2, SAMSN1和SIGLEC10(图D和F至J),被称之为FCRL3highGC B细胞。
因为这群未转换细胞是由非常高FCRL2和FCRL3表达式(图2F),作者检查了这些标记流式细胞术的扁桃体B细胞和表面表达与FCRL3发现一个有很强关联,但不是FCRL2和IgM表达GC和MBC人口(图S8, F)。虽然这些细胞的精确本体尚不清楚,基于scVDJ分析发现,FCRL3highGC B细胞是高度扩增的GC衍生克隆的一部分,该克隆含有MBCs和PBs(图2K和L)。表明它们是通过产气相色谱反应产生的,不太可能来自单独的或固定的谱系。
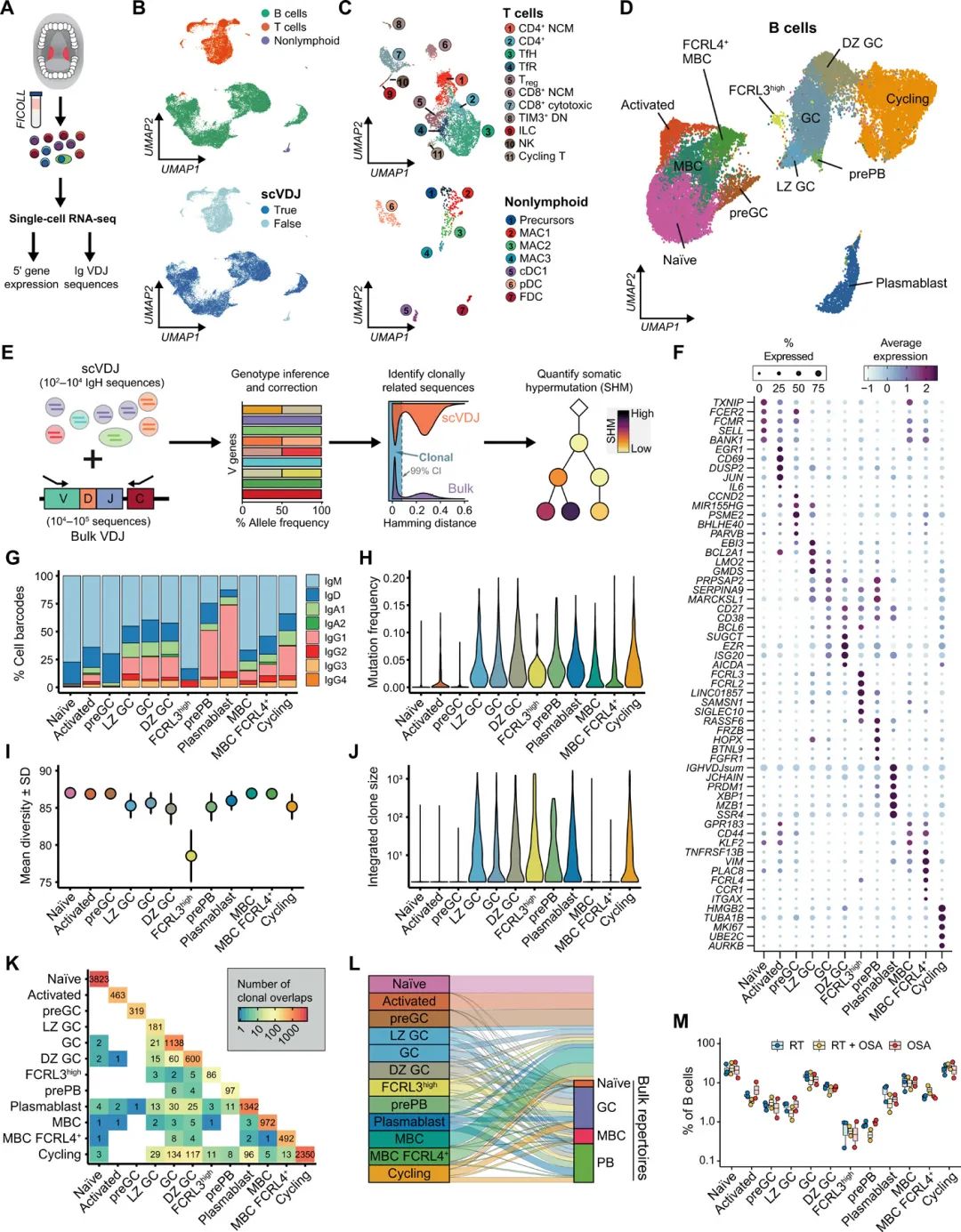
图2 人类扁桃体免疫细胞单细胞图谱以了解B细胞成熟。
03人B细胞活化和GC形成的拟时重建
在活化过程中,B细胞获得抗原,要么以可溶性形式存在,要么显示在滤泡抗原呈递细胞(APCs)表面,允许它们迁移到T细胞区,在那里它们可以参与GC反应。作者推断,B细胞成熟单细胞图谱将包含完整的激活状态,并允许重建B细胞激活和GC反应形成过程中的时间基因表达和抗体库动态。scRNA-seq分析确定了一个B细胞簇,由无抗原naïve B细胞和抗原经历的MBCs(图S10)组成,它们具有激活标记基因的表达升高(图3A)和预测的与APCs的细胞-细胞相互作用的高频率(图3B)。
这种活化的B细胞状态似乎能够分别通过细胞间粘附分子-1-ITGAL(整合素亚单位α L) (LFA-1)和/或白细胞介素-6 (IL6)与APCs和T细胞进行通信(图3C)。许多这些预测的细胞-细胞相互作用也在GC前和LZ GC B细胞状态中被检测到(图3C),然后在其他GC B细胞群中丢失,这表明GC前B细胞可能作为初始B细胞激活和GC形成之间的过渡状态存在。
为了更好地了解不同B细胞群的转录动力学,特别是pre-GC B细胞状态,作者进行了RNA 速率分析来模拟单个B细胞的转录动力学,并推断它们的方向性以及与其他B细胞群的关系。这证实了GC前细胞对LZ GC状态表现出很强的方向性(图3D)。基于速度的naïve、活化、pre-GC和LZ GC B细胞的拟时排序将预GC细胞置于活化和LZ GC B细胞之间,并揭示了从早期活化事件到真正的GC B细胞的基因表达的完整连续体(图3E和F)。这包括关键信号分子和转录因子如CD40、EBI3、MIF、BATF、BHLHE40和MYC的动态表达(图3E和F)。至关重要的是,作者发现激活的B细胞簇(包括激活的naïve和MBC亚群)(图S10)位于轨迹的早期,并且富集了与急性(1小时)B细胞刺激相关的实验衍生基因特征,而pre-GC B细胞更接近于中级水平的B细胞刺激(3至6小时)(图3G)。这证实了这些B细胞在遇到抗原后和GCs形成之前表现出二级激活状态。因此,对B细胞活化的重建为研究这些动态B细胞在体内的状态提供了一个有价值的框架。
作者对人体内B细胞激活的重建显示,在pre-GC B细胞中,与CSR相关的基因意外富集(图3H至J),与常规CSR位点的LZ GC B细胞相比,其富集程度相似或更高。虽然AICDA的表达水平很低(图2H),但作者对pre-GC和LZ GC过渡的分析显示,其他基因与CSR有机制联系,包括那些能够结合IgH位点内的开关区序列、与CSR机制相互作用或调节AICDA/AICDA稳定性的基因(图3K)。虽然作者观察到很少有切换的pre-GC B细胞(图2)。基于对高置信度scVDJ序列的分析,作者发现pre-GC细胞中IgH种系转录本(GLTs)的表达在IgH位点达到峰值(图M)。
尽管这在单细胞中似乎水平过低,无法重建高质量的scVDJ 重叠群。这些在人类扁桃体中的观察结果与小鼠模型中GLT转录峰值和CSR发生在GC形成之前一致。这表明,在GC反应形成之前,pre-GC的B细胞状态可能已经准备好进行CSR,尽管观察结果并不排除GC内也会发生CSR。
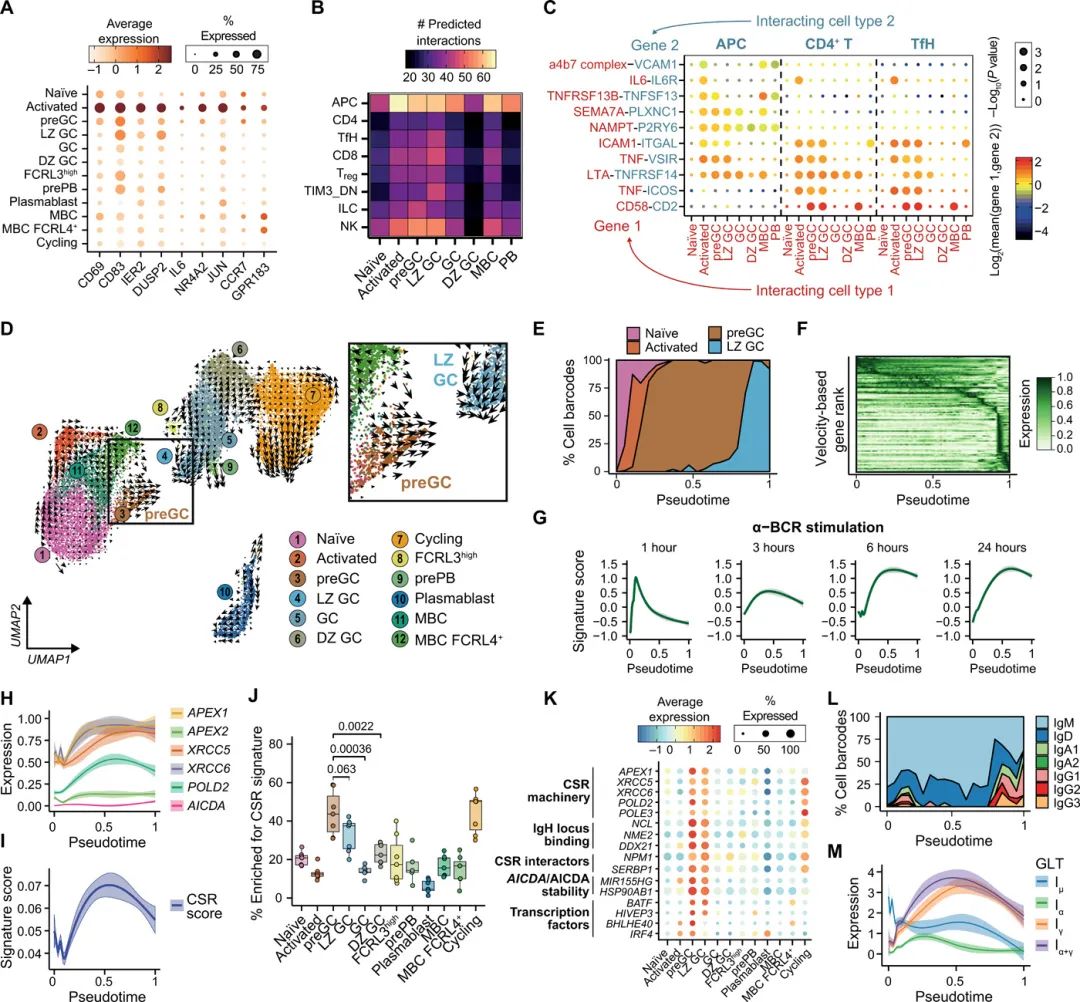
图3.人B细胞活化和GC进入的制图动力学。
04扁桃体免疫细胞的单细胞图谱定义了成熟过程中不同的B细胞状态
作者使用配对的单细胞转录组和抗体库来剖析GC反应中与基于抗体的选择相关的基因表达。
尽管GC B细胞在物理上不同的LZs和DZs之间循环,但作者发现许多GC B细胞在这两种状态之间连续存在(图4A和B),这与先前的研究相似,除了FCRL3high和pre-PB细胞在转录上不同(图2F和4C)。这些GC B细胞亚群也表现出不同的类切换模式,pre-PB细胞更频繁地表达类切换同种型,FCRL3highGC细胞保留IgM/IgD的表达(图2G、4D)。含有FCRL3highGC细胞的扩增B细胞克隆几乎完全是IgM+(图4E),这表明抗体类别可能与特定的基因表达程序和细胞命运有关,反之亦然。
接下来,作者利用配对的单细胞VDJ和转录组学数据集,根据抗体SHM频率作为亲和力的代理,对所有非循环GC B细胞(不包括pre-PB和FCRL3high群体)进行分层(图4F)。高SHM的GC B细胞显著富集了高亲和力抗原结合B细胞的基因特征,B细胞成熟标志物CD27的表达更高,克隆大小更大(图4F),反映了基于BCR亲和力的扩增和成熟。检测到很少的B细胞表达无功能的IgH序列(图4F),凋亡细胞无法产生足够高质量的转录组数据,或者由于线粒体含量升高而被移除。高或低SHM的GC B细胞在基因表达上存在许多差异(图4G),这与高亲和力和低亲和力结合事件对GC B细胞的差异调节是一致的。然而,这些SHM基因特征与转换或未转换的GC B细胞的基因特征非常相似(图4G),正如在IgM+ GC B细胞的平均SHM频率较低时所预测的那样(图1D)。
为了克服成熟状态对检测同型特异性基因表达的混杂影响,作者将GC B细胞与表达不同抗体类别的匹配SHM水平进行了比较。这表明,切换后的GC B细胞富含细胞存活、BCR信号传导、抗原呈递、免疫应答和代谢以及其他重要信号通路所需的基因(图4H和I)。切换的GC B细胞也有证据表明,对T细胞衍生的细胞因子(如IL4、转化生长因子-β、干扰素-γ(IFN-γ)和CD40LG)或通过不同的TOLL样受体(图4H)发出的反应信号增加,这与它们接受更多的T细胞帮助是一致的。
在IgG+和IgA+ GC B细胞中,参与GC约束或B细胞生态位归巢的几个基因被上调,例如CXCL12介导的向GC迁移所需的基因(LCP1和MYO1E)和GC约束受体P2RY8,这表明被转换的B细胞可能更有可能在GC中停留更长时间。这可以解释他们更高的SHM率。大多数基因表达差异在IgG+和IgA+ B细胞之间具有可比性(图4I)最后,作者观察到类特异性GC B细胞之间转录因子的表达存在许多差异(图4I)。IgG+ B细胞表达更高水平的BCL6、XBP1和ID3,这可能增加了它们驻留在GC或向浆细胞分化的能力,而IgM+细胞表达更高水平的BACH2,抑制浆细胞分化。还发现了其他因子(LMO2、TOX、BCL11A和CUX1)的差异表达,提出了它们在GC内开关和未开关B细胞的转录连接中的作用的问题。
对GC反应的单细胞分辨率使作者能够解偶联抗体亲和力和类别,并解剖B细胞库中这两个关键臂在塑造B细胞命运和功能方面的差异贡献。这些分析表明,切换和未切换的B细胞在GC中生存和驻留的能力不同,并确定除了BCR亲和力外,GC中基于抗体的选择可以由B细胞是否经历过CSR来决定。

图4 在单细胞分辨率下解决GC B细胞中抗体类依赖基因表达。
05人类扁桃体中多样的MBC状态
成熟状态和抗体类别与GC B细胞的特定基因表达有关,可能是通过作为BCR一部分的免疫球蛋白的膜特异性同种异构体。与PBs相反,MBC保留BCR表达,其同型可能影响不同MBC亚群的表型特性,其完全多样性尚不清楚。因此,作者试图更好地定义人类扁桃体中MBC库的异质性,并确定MBCs的抗体类表达是否可能与不同的功能或亚群有关。
儿童扁桃体中相当大比例的MBCs未被转换(图1B和2G)。为了研究跨类别切换MBC亚群的潜在差异基因表达,为所有(n = 2)或IgM缺失(n = 4) MBC生成了成对的单细胞转录组学和VDJ谱(表S1)。数据集整合和质量控制提供了21,595个高质量的MBC单细胞转录组,作者用反映不同MBC亚群和状态的11个簇进行了注释(图5A至C)。除了先前鉴定的组织内FCRL4+ MBC(图2),作者还注释了两个罕见的CR2/CD21low MBC亚群,它们似乎类似于不同组织和疾病状态下描述的非典型MBC群体(图5A至C)。其中一个簇(CD21low 2)与非典型FCRL5high的MBCs共有几个特征,如抑制受体(CD22)和参与抗原呈递的基因(CIITA)的高表达(图5C)。否则,人类扁桃体中的大多数MBC多样性反映的是细胞状态或活性的差异,而不是不同的细胞类型,如热休克蛋白相关和IFN相关的基因活性(图5A至C)。还发现了多种激活状态(Activated1/2),包括与naïve pre-GC细胞相似的基因表达和CSR基因富集的MBCs(图5C),作者将其标记为pre-GC MBCs。作者还发现,与FCRL3highGC群体相似的FCRL3highMBC状态(图5C)和类似的MBC群体也可以在淋巴结和脾脏中检测到,尽管频率不同(图S15F)。这表明这些注释的MBC群体可能广泛共享跨越多种B细胞命运和器官系统的功能状态。
接下来,作者研究了切换类别和未切换类别的MBCs是否表现出不同的基因表达网络,这可能反映了特殊的功能能力。作者发现很少有证据表明抗体类别对MBC在给定状态下存在的可能性有贡献,除了FCRL3high的MBC,与FCRL3high的GC细胞相似,scVDJ和流式细胞术分析显示其主要是IgM+(图5A和B)。
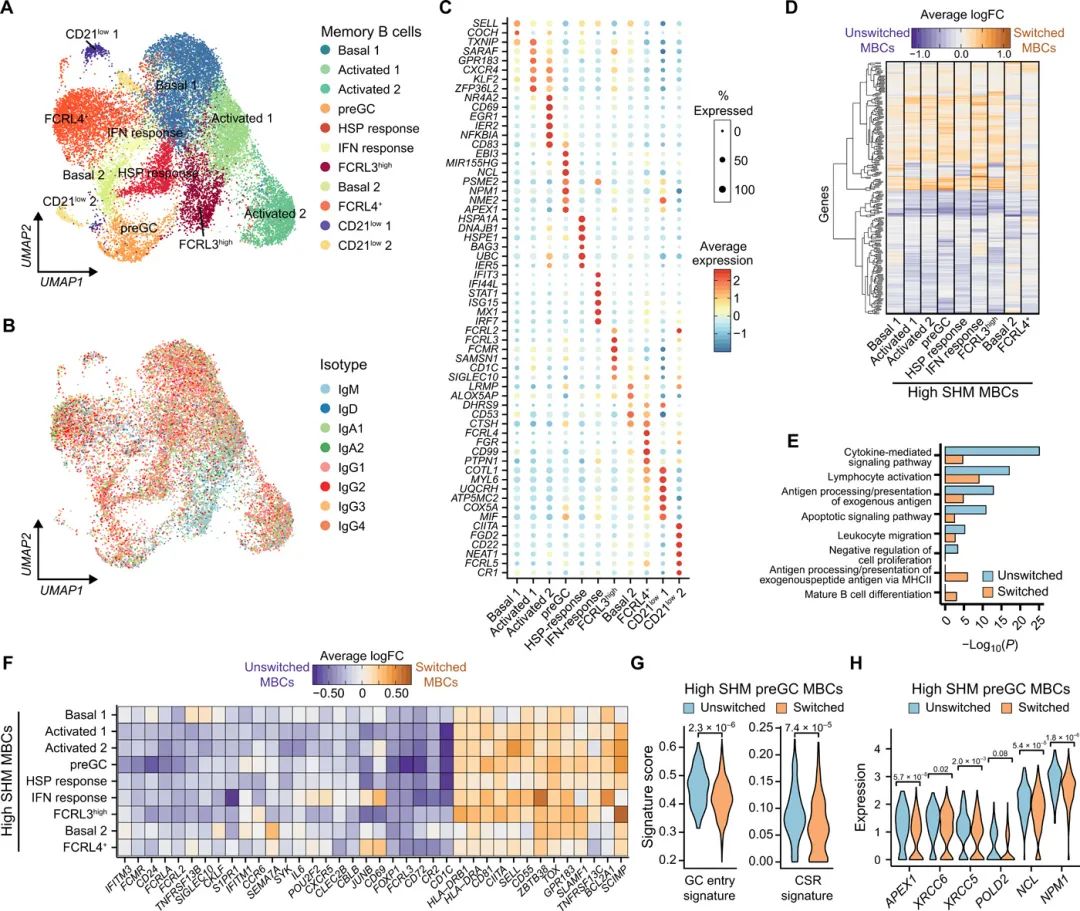
图5.不同的MBC状态和抗体类依赖基因表达。
06未切换的MBCs的转录连接是形成继发性GCs的基础
由于表达开关同型的MBCs往往具有更高的SHM频率(图1D),因此对具有相同SHM水平的开关MBCs进行比较,证实了广泛存在的基因表达差异与MBC子集或状态无关(图5D和F)。这表明MBCs的特定转录连接依赖于其抗体类别。未开关的MBCs广泛富集参与细胞因子介导的信号传导、激活、抗原呈递和迁移的基因(图5E和F),这可能反映了IgM+ MBCs作为回忆记忆反应的一部分重新启动GC反应的能力增加,这是B细胞介导的长期免疫的重要组成部分。与直觉相反,IgM+ MBCs也富含抗增殖和凋亡基因通路(图5E),以及许多被认为调节或抑制B细胞活化的基因,如FCRLA、FCRL2、FCRL3、CBLB、CD72和SIGLEC10。这表明,转录水平上的良好调节平衡可能控制未开关MBCs的激活阈值。
未切换的MBCs比类别切换的MBCs表达更高水平的POU2F2(也称为OCT2)和FOXP1(图5F),它们分别协调B细胞对抗原受体信号的正常反应能力,并直接抑制浆细胞分化的关键调节因子。这与切换后的IgG+ MBCs更有可能分化为浆细胞相一致,而未切换的IgM+ MBCs更有可能重新进入或形成二次GC反应以获得更高的亲和力。与同一簇中切换的MBCs相比,pre-GC簇中未切换的MBCs与GC进入和CSR相关的基因签名显著富集(图5G、H)。这支持这样一种模型,即未切换的MBCs比已切换的MBCs更有可能形成二级GC响应,并且这些未切换的MBCs在此过程中准备进行类切换。
结论
提供了一个全面的人类B细胞成熟路线图,单细胞转录组学与大容量和单细胞抗体库相匹配,以定义基因表达,抗体库,以及单细胞分辨率下B细胞状态的克隆共享,包括反映不同功能和信号状态的记忆B细胞异质性。
重建了B细胞激活过程中的基因表达动态,揭示了生发前中心状态启动进行类开关重组,并解剖了生发中心和记忆B细胞中抗体类依赖的基因表达如何与独特的转录线路联系在一起,这些转录线路可能影响它们的命运和功能。
揭示了形成人类B细胞介导免疫的动态细胞状态,并强调了抗体同型如何在基于抗体的选择中发挥作用。
参考文献
Hamish W. King et al.Single-cell analysis of human B cell maturation predicts how antibody class switching shapes selection dynamics.Sci.
Immunol.6,eabe6291(2021).DOI:10.1126/sciimmunol.abe6291
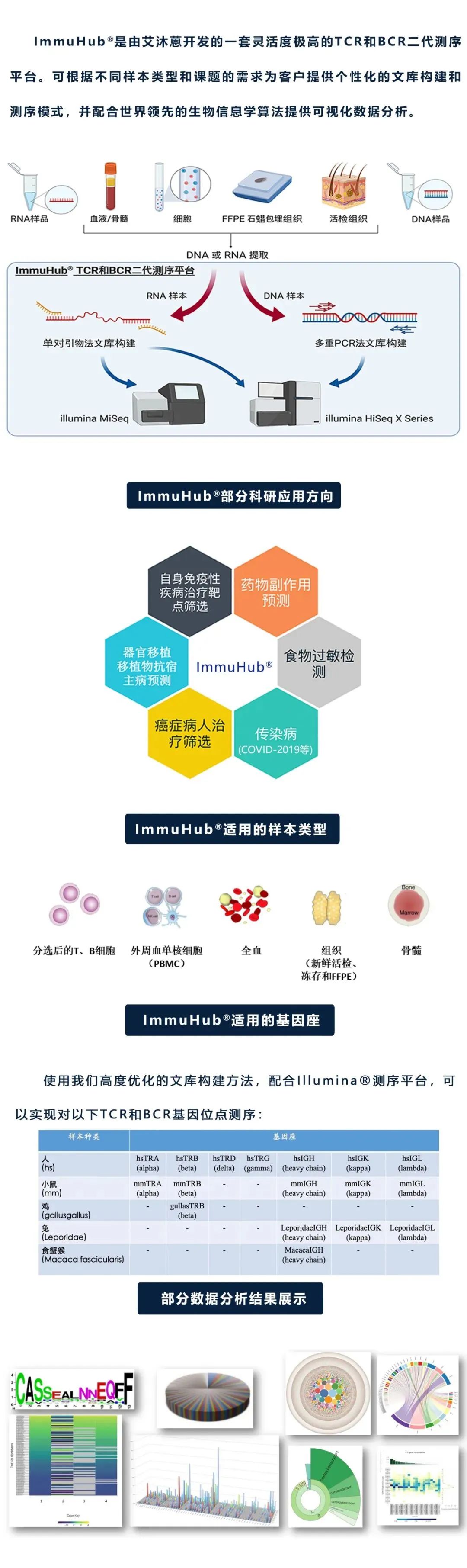

杭州艾沐蒽生物科技有限公司成立于2016年,是国内前沿的专注于免疫基因组学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子(纳斯达克代码:GTH)使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®疾病早筛、单细胞测序、TCR-T药物开发等平台管线。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。
艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。

