2024年1月8日,上海交通大学医学院附属瑞金医院的陈赛娟院士团队在《Nature Communications》上发表题为“Neutrophil activation and clonal CAR-T re-expansion underpinning cytokine release syndrome during ciltacabtagene autoleucel therapy in multiple myeloma”的研究论文,本研究使用了艾沐蒽生物ImmuHub®TCR分析系统,研究解析了CAR-T治疗相关CRS发展的生理过程,加深了对细胞免疫治疗系统性毒性的理解。

当前Car-T细胞免疫疗法在白血病和淋巴瘤等领域取得了重大突破,毒副作用作为Car-T治疗中最大的不良反应一直备受关注,毒副作用主要表现为细胞因子释放综合征CRS形式(cytokine release syndrome)。研究发现抗CD19 CAR-T治疗B细胞急性淋巴细胞白血病中,46%的患者会发生CRS,在B细胞淋巴瘤和多发性骨髓瘤治疗中分别为13%和41%。理论上细胞因子释放综合征CRS如果较为轻微时可以帮助治疗肿瘤,但是CRS严重时会导致重要器官损伤甚至危及生命,可见CRS的作用机制研究十分重要。陈赛娟院士针对复发/难治性多发性骨髓瘤患者开展CRS机制研究,以了解CRS的免疫学动力学。 研究团队收集了26例接受 Cilta-cel(一种靶向BCMA抗原的双表位CAR-T产品)治疗的复发/难治性多发性骨髓瘤患者的外周血样本,其中16例来自I期Legend-2试验,10例来自II期CARTIFAN-1试验。研究通过纵向细胞因子谱和基因转录组来表征CAR-T反应的急性炎症事件的动力学,揭示信号激活-细胞因子释放-临床表现轴的动力学变化,显示CAR – T相关急性炎症的逐步演变。 患者临床反应 在给药后30天内,所有患者均出现CRS,发病时间中位数为6天(范围1~10天)。65.4%的患者,最早出现的症状是发热;34.6%的患者在CRS发病时出现低血压、低氧血症或器官功能障碍早于发热。 细胞因子谱的动态变化 为了深入了解CRS的发展情况,将患者的临床表现为5个阶段,包括基线期(输注前)、潜伏期(3~5天)、发热期(6~9天)、急性加重期(10~15天)和缓解期(20~21天)。由于急性加重期细胞因子分泌旺盛,研究团队采集了两次个体样本(第10~12天和第13~15天),分别记为AA1和AA2,以获得足够的信息。 热图显示了26例患者在CAR-T治疗后不同时点61种细胞因子的动态变化(图1a),从图中可以看出一些细胞因子,如IL-6、颗粒酶B、IL-10、G-CSF和CXCL10,在峰值时飙升了50~100倍,这表明在第6天至第15天期间患者存在高度活跃的炎症反应(图1b)。通过无监督聚类,研究团队确定了5个细胞因子簇(CCs),其中CC3、CC4和CC5与平均CRS分级呈正相关,而CC2呈负相关(图1c)。其中sIL-2Rα、sTNF RII(均属于CC4)和Granzyme B(属于CC5)的相关性最强。研究团队将26例患者分为两组,基于这个分组,我们可以清晰区分治疗过程中CRS分级的时间变化。组1患者CC3、CC4、CC5细胞因子及整体峰值水平均高于组2。组1患者出现严重CRS,症状在第12天左右达到高峰;而组2患者CRS相对较轻,症状在第9天左右达到低高峰(图2e)。无论个体差异如何,细胞因子分泌的时间动态与CRS分级高度一致。 上述结果表明,细胞因子产生的时间与临床症状一致,揭示了CAR-T肿瘤接触后高度规律性的全身炎症反应。
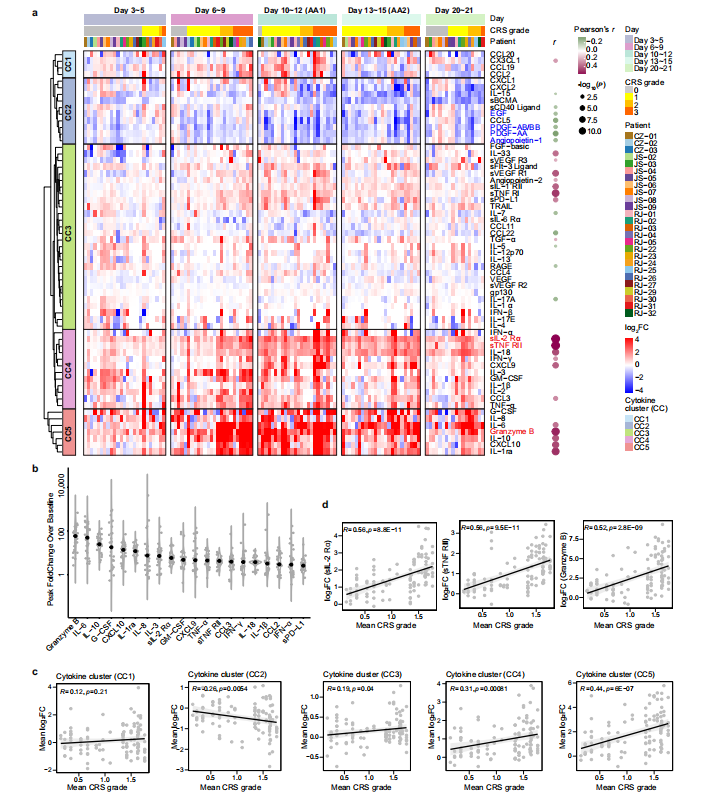
图1 细胞因子的动态变化
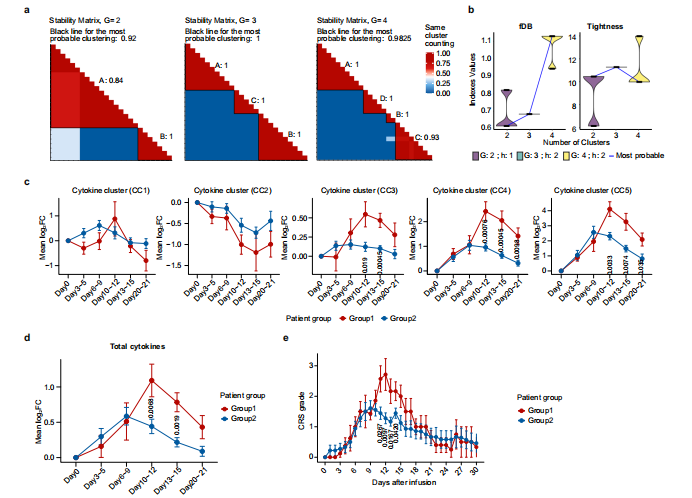
图2 细胞因子表达与CRS水平的CONNECTOR动态关联 免疫细胞介导的细胞因子释放的信号调节 为了探索细胞因子调控的上游信号,我们对不同时期的PBMC进行了转录组测序。研究团队发现在早期阶段(第3~9天),代表信号激活的cluster 2 和cluster 7、中性粒细胞、T淋巴细胞、血小板、单核细胞/巨噬细胞活化、细胞因子信号上调以及过度氧化应激等多种生物过程中显著富集(图3a~b)。此外,B细胞相关基因在cluster 6中显著富集,并伴随着淋巴细胞耗用和Cilta – cel治疗后基因转录逐渐下调(图3a~ B)。相关性分析显示,以T细胞活化和细胞周期为特征的cluster 1和cluster 5与CRS严重程度呈正相关,cluster 7与CRS严重程度呈负相关。这些数据表明,中性粒细胞和血小板、氧化应激在CRS的早期被激活,T细胞的活化和增殖在CRS加重阶段增强。 为了更好地了解免疫细胞激活级联的时间,研究团队通过进行基因集富集分析,将每个时间点与基线进行比较,发现中性粒细胞早在第3~5天(潜伏期)反应最强,而巨噬细胞和T细胞的免疫反应从潜伏期开始,并在第6~9天的发热期变得强烈(图3c),这表明中性粒细胞在启动炎症反应中起着重要的作用,而巨噬细胞和T细胞更多地参与随后的细胞因子级联反应。当免疫细胞应答时,关键的炎症信号通路TNF、IL-6/ JAK- stat3、JAK/STAT、IL-2/STAT5和补体/凝血级联相应显著上调(图3c),这些通路因其在细胞因子风暴中的核心作用而闻名这些数据预测了潜在的靶点和使用信号阻滞剂的适当时间。
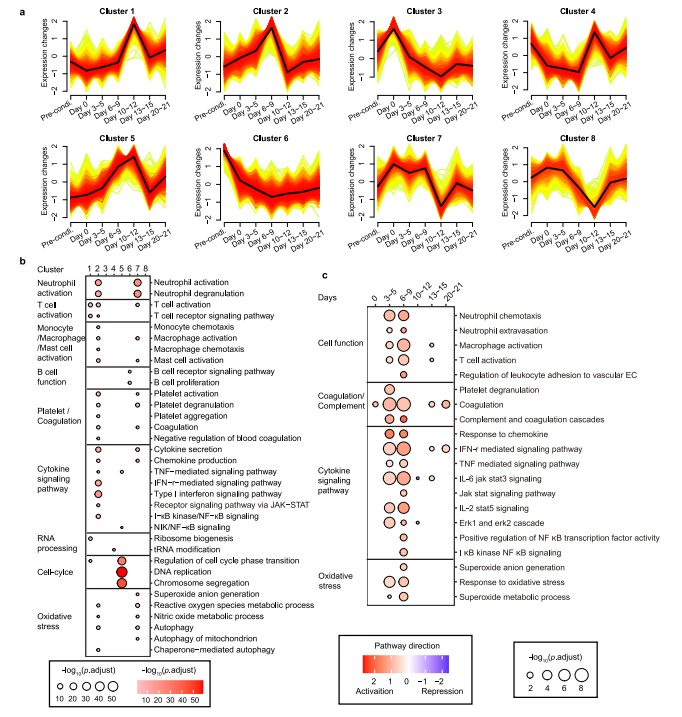
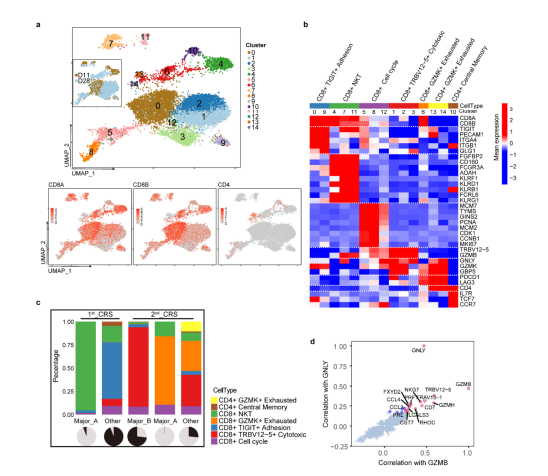
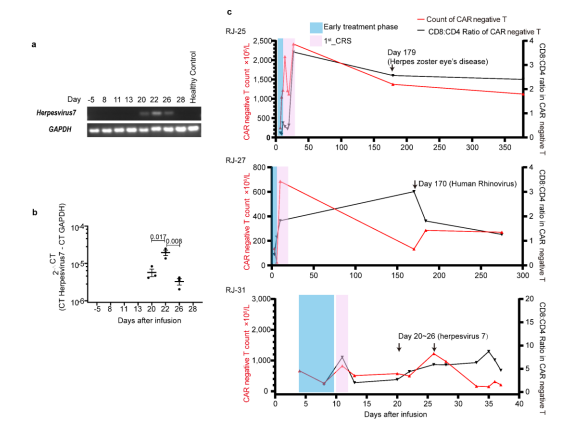
图3 通过RNA测序研究CRS相关信号 3例患者的CAR-T再扩增 研究中发现有3例患者((RJ-25、27和31))中发现了CAR-T再扩增,其中包括1例致命病例。RJ-25和RJ-27的再扩增发病时间为CAR-T输注后半年,而RJ-31仅为CAR-T输注后22天。在半年时间里,RJ-25被诊断为带状疱疹眼病,RJ-27被检测为人鼻病毒阳性。这两个病例的病毒感染都有症状,很可能是由于持续的低免疫球蛋白血症,因为浆细胞仍然缺乏。由于T淋巴细胞是适应性免疫的关键守护者,因此推测CAR-T可能参与了对病原体入侵的免疫应答,并再次不断增殖。 RJ-31的2nd_CRS上发现了Cilta-cel的优势克隆 RJ-31, 61岁男性。患者在第9天首次出现严重CRS ,在给予托珠单抗后缓解。肝损害(3级)和凝血功能障碍(2级)在第12天缓解。患者在第20天再次发生CRS并伴有进行性黄疸,症状持续18天,直至死于肝功能衰竭和肝性脑病。 RJ-31中PBMC的RNA测序揭示了TCR库的显著倾斜,其中TRAV131~J20/TRBV12-5~J2-1占主导地位,在第28天占整个TCR库的89%(图4a)。TCR多样性和克隆性表明,自第22天以来,RJ-31表现出TCR多样性的深度降低和T细胞克隆性的显著增加(图4b)。研究团队对慢病毒载体整合位点进一步分析后发现,在ETS1基因下游(距离近14 kbp)有一个高丰度的单等位基因整合克隆,而不影响其转录,定量PCR证实了这一点(图4c),排除了Cilta – cel优势建立与慢病毒插入的关联。
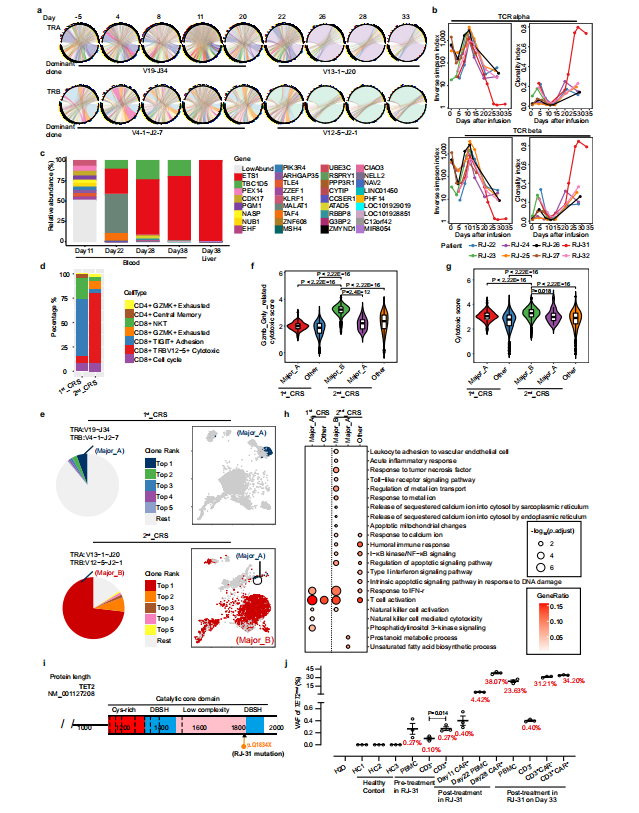
图4 RJ-31显性CAR-T克隆的鉴定 为了从功能上评估优势克隆的特性,研究团队在第2nd_CRS(第28天)收集纯化的CAR阳性细胞,并在第1st_CRS(第11天)收集匹配的对照,进行单细胞RNA测序。总体而言,2nd_CRS中的CAR-T富集了细胞毒性CD8+效应物(图4d,补充图1a~b)。作为可比较的对照,我们选择了1st_CRS中的一个CAR-T小显性克隆TRAV19~J34/TRBV4-1~J2-7(简称Major_A)与2nd_CRS中鉴定了73%的TRAV13-1~J20/TRBV12-5~J2-1(简称Major_B)进行比较(图5e)。本研究表明,无论裂解细胞组成如何,Major_B都具有更强的细胞毒能力(补充图1c)和更高的毒性评分(图 4f~g, 补充图1d)。此外,Major_B中显著的deg参与toll样受体信号通路、线粒体凋亡改变和钙铁相关过程(图4h),这与PBMCs转录组测序结果一致。同时,当第28~38天的优势度达到73% ~78%时,整个CAR-T群体可以代表该克隆(图5b、6c、e)。
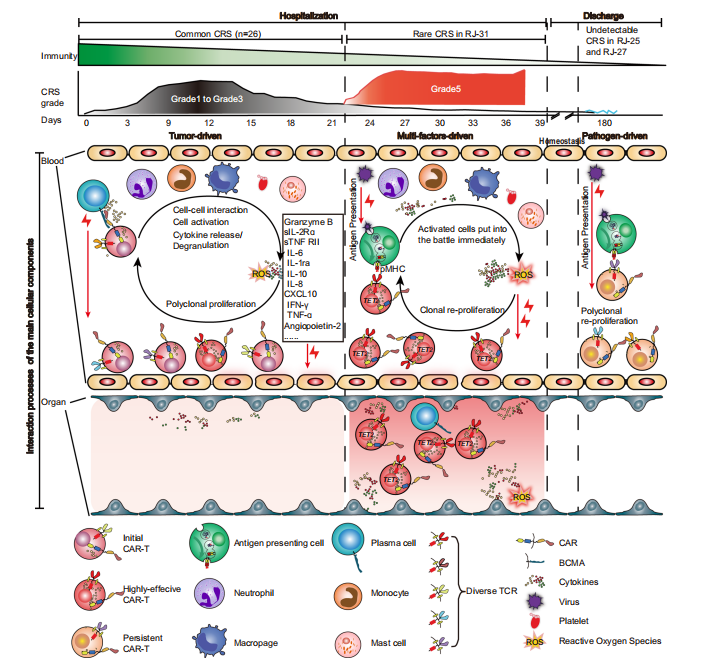
图5 Cilta-cel治疗后CRS的进展 图5总结了cilta细胞治疗后CRS的发展,研究指出在CAR-T输注后的一个月内,常见的CRS是由CAR-T与肿瘤抗原接触驱动的,然后是免疫细胞成分的参与。在病原体侵袭和/或基因突变的情况下,活化后的CAR-T细胞能够以TCR/MHC的方式增强,甚至能够进行克隆扩增导致血液和组织中的免疫反应相应地增强,造成不可逆的器官损伤(中)。
补充图1 基于10x基因组学平台的单细胞转录组RJ-31细胞CAR阳性T细胞群分析 HHV7激活和TET2突变可能共同导致RJ-31中Cilta-cel的克隆扩增 鉴于CAR-T克隆型在肿瘤刺激下很少偏向单一显性,研究团队推测显性克隆是由表达BCMA细胞以外的其他因素造成的。为了挖掘未知肽,研究通过分析发现TCR克隆与艾沐蒽内建TCR-抗原数据库中的HHV5高度匹配。研究团队通过RJ-31PBMC的转录组测序发现HHV7从第一次CRS消退期开始被激活。回到前面提到的数据库,目前HHV7确实没有被列入TCR比对的潜在靶标。虽然HHV5和HHV7在肽水平上只有38.6%的同源性,但HHV7被假设为CAR-T优势形成的刺激物。HHV7的短暂阳性证实了这一假设这与2nd_CRS的病程完全一致(补充图2a~b)。因此,HHV7感染可能是相应CAR-T克隆再扩增的关键刺激因素。
补充图2 HHV7型在RJ-31和循环CAR中的检测阴性T细胞动力学 PBMCs转录组测序显示TET2基因在从20天开始发生杂合突变。这一新发现的异常通过靶向DNA测序得到了验证。结果表明,位于Chr4:106197167基因组位点的TET2变异(C > T)导致TET2蛋白催化结构域的早期翻译终止(称为TET2mut,图4i,补充图3a~b)。为了准确确定在2nd_CRS之前是否存在低丰度的TET2mut,研究团队进行了ddPCR,发现在预处理时 PBMCs 中确实存在一个小的TET2mut克隆,并且主要集中在CD3阳性宿主T细胞中(图4j,补充图3c)。在第11天的CAR-T中也检测到这种变异,变异等位基因分数(VAF)低,为0.40%,而在第28天,通过ddPCR检测到VAF较高,为38.07%(图4j)。此外,在RJ-31病例死于致命毒性的第38天肝脏活检中,发现TET2mut与第28天的外周CAR-T具有相似的VAF水平(补充图3d)。在白细胞分离时存在的体细胞TET2mut更多地由T淋巴细胞携带,从而增强了工程T细胞的克隆扩增,而在微生物感染的情况下,TET2突变不能驱动非T造血细胞克隆扩增。
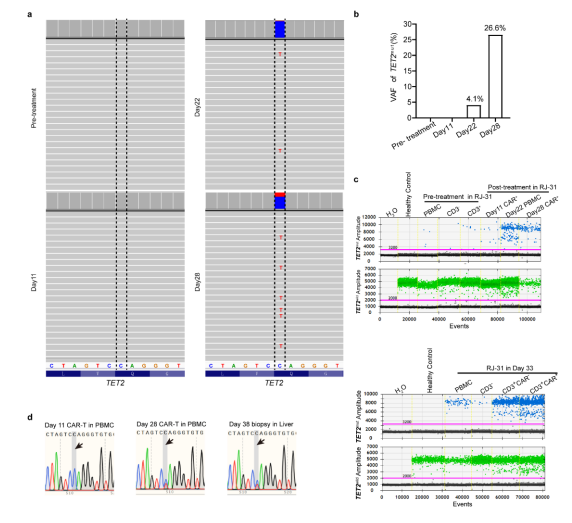
补充图3 RJ-31中TET2mut的检测 总之,病毒激活、罕见的TET2体细胞突变以及RJ-31肝脏中的血浆抗原刺激可能共同导致Cilta-cel的克隆扩增,从而引发第二次严重的CRS,并导致过度炎症和对肝功能的致命损害。 本研究发现在CAR-T输注后的一个月内,CRS首先由CAR-T与肿瘤抗原接触驱动,然后免疫细胞参与。在病原体侵袭或基因突变的情况下,不但可以通过TCR+MHC的方式有效增强CAR-T细胞杀伤能力,还可以通过克隆扩增增加CAR-T细胞,这种级联效应会触发严重的CRS,造成不可逆的器官损伤。这项研究提示CAR-T输注后的一个月内成为治疗 CRS 的最佳窗口期,同时病原体侵袭或基因突变以及TCR+MHC激活方式也为后续治疗提供一个新概念,即CAR-T再增殖需要更密切的监测和有效的医疗管理来减轻致死的严重程度。 本研究使用了ImmuHub®TCR/BCR检测方法,该方法由杭州艾沐蒽生物开发,利用公司独创的5’RACE或多重PCR技术,以高通量测序的方法实现TCR/BCR的全长序列或CDR3区序列鉴定。由该方法发展而来的seq-MRD在2023年被美国彭博社报道作为MRD推荐方法并广受医院和市场好评。 参考文献:Shuangshuang Yang, Jie Xu, Yuting Dai, Shiwei Jin, Yan Sun, Jianfeng Li, Chenglin Liu, Xiaolin Ma, Zhu Chen, Lijuan Chen, Jian Hou, Jian-Qing Mi & Sai-Juan Che
