
ABSTRACT
TзїЖиГЮжШѓйАВеЇФжАІеЕНзЦЂз≥їзїЯзЪДзїДжИРйГ®еИЖпЉМеЃГдїђзЪДеПНеЇФжШѓзФ±зЛђзЙєзЪДTзїЖиГЮеПЧдљУ(TCR)дїЛеѓЉзЪДпЉМTCRеПѓдї•иѓЖеИЂжЭ•иЗ™еРДзІНзФЯзЙ©зОѓеҐГзЪДзЙєеЃЪжКЧеОЯгАВеЫ†ж≠§пЉМеИЖжЮРTзїЖиГЮеЇУеПѓдї•жЫіе•љеЬ∞зРЖиІ£еЕНзЦЂеПНеЇФеТМзЩМзЧЗз≠ЙзЦЊзЧЕгАВ
дЇМдї£жµЛеЇПжКАжЬѓжЮБе§ІеЬ∞еЃЮзО∞дЇЖTCRеЇУзЪДйЂШйАЪйЗПеИЖжЮРгАВеЯЇдЇОињЗеОїеНБеєіеЬ®иѓ•йҐЖеЯЯзЪДдЄ∞еѓМзїПй™МпЉМдљЬиАЕжПРдЊЫдЇЖTCRжµЛеЇПзЪДж¶Вињ∞пЉМдїОжЬАеИЭзЪДжЦЗеЇУеЗЖе§Зж≠•й™§еИ∞жµЛеЇПеТМеИЖжЮРжЦєж≥ХпЉМжЬАеРОеИ∞еКЯиГљй™МиѓБжКАжЬѓгАВеЕ≥дЇОжХ∞жНЃеИЖжЮРпЉМдљЬиАЕиѓ¶зїЖдїЛзїНдЇЖTCRеЇУзЪДйЗНи¶БжМЗж†ЗпЉМеєґжПРеЗЇдЇЖеЗ†зІНйҐДжµЛжКЧеОЯзЙєеЉВжАІзЪДиЃ°зЃЧеЈ•еЕЈгАВ
жЬАеРОпЉМеЉЇи∞ГдЇЖTCRеЇУеИЖжЮРеЬ®дЇЖиІ£иВњзШ§зФЯзЙ©е≠¶еТМеЉАеПСзЩМзЧЗеЕНзЦЂж≤їзЦЧжЦєйЭҐзЪДйЗНи¶БеЇФзФ®гАВ
еЙНи®А
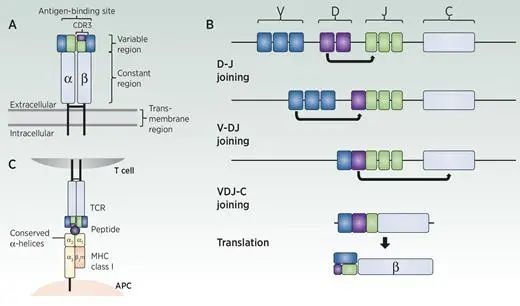
TCRжШѓйЂШеЇ¶е§Ъж†ЈеМЦзЪДеЉВдЇМиБЪдљУи°®йЭҐеПЧдљУпЉМдљњTзїЖиГЮиГље§ЯжПРдЊЫйТИеѓєеРДзІНдЄНеРМзЧЕеОЯдљУзЪДдњЭжК§,еКЯиГљжАІTCRзФ±дЄ§жЭ°йЕНеѓєзЪДиЫЛзЩљйУЊзїДжИРпЉМеЕґдЄ≠жЬЙќ±йУЊеТМќ≤йУЊпЉМжИЦќ≥йУЊеТМќійУЊ(еЫЊA)гАВ
е§Іе§ЪжХ∞TзїЖиГЮTCRќ±ќ≤йУЊиГље§ЯиѓЖеИЂеЬ®MHCиЫЛзЩљдЄКеСИзО∞зЪДжКЧеОЯ(3)гАВеП™жЬЙ1%-5%зЪДTзїЖиГЮTCRќ≥ќійУЊи°®иЊЊдЄНеПЧMHCйЩРеИґпЉМеПВдЄОеЕИ姩еЕНзЦЂеЇФз≠ФгАВзЫЃеЙНе∞ЪдЄНжЄЕж•ЪTзїЖиГЮзїУеРИзЪДз°ЃеИЗйЕНдљУ(5)гАВзФ±дЇОињЩдЇЫеОЯеЫ†пЉМќ±ќ≤еЮЛTCRйАЪеЄЄжШѓTCRжµЛеЇПеТМеРОзї≠дЄіеЇКеЇФзФ®зЪДйЗНзВєгАВ
жЧ†иЃЇйВ£зІНз±їеЮЛпЉМTCRйУЊйГљеМЕеРЂдЄАдЄ™иГље§ЯиѓЖеИЂжКЧеОЯзЪДNзЂѓеПѓеПШеМЇеТМдЄАдЄ™CзЂѓжБТеЃЪеМЇгАВеПѓеПШеМЇзФ±еПѓеПШ(V)гАБе§Ъж†ЈжАІ(D)еТМињЮжО•(J)еЯЇеЫ†зЙЗжЃµйАЪињЗжЬЙеЇПзЪДV(D)JйЗНзїДињЗз®ЛзїДи£ЕиАМжИРпЉМеЕґдЄ≠жѓПдЄ™еЯЇеЫ†зЙЗжЃµзЪДдЄАдЄ™з≠ЙдљНеЯЇеЫ†дЄОеЕґдїЦеЯЇеЫ†зЙЗжЃµзЪДз≠ЙдљНеЯЇеЫ†йЪПжЬЇйЗНзїДпЉМ嚥жИРеКЯиГљжАІжКЧеОЯиѓЖеИЂеМЇ(еЫЊB)TCRќ±еТМќ≥йУЊзФ±VеТМJеЯЇеЫ†зЙЗжЃµзїДжИРпЉМиАМTCRќ≤еТМќійУЊињШеМЕжЛђDеЯЇеЫ†зЙЗжЃµпЉМзїУжЮДжЫіеК†е§Ъж†ЈеМЦгАВеЯЇеЫ†зЙЗжЃµзЪДжХідљУзїДеРИе§Ъж†ЈжАІдЉійЪПзЭАињЮжО•е§Ъж†ЈжАІпЉМињЩжШѓзФ±еЯЇеЫ†зЙЗжЃµдєЛйЧіињЮжО•е§Дж†ЄиЛЈйЕЄзЪДйЪПжЬЇжЈїеК†жИЦеИ†йЩ§жЙАеЖ≥еЃЪзЪДгАВзїДеРИеТМињЮжО•зЪДе§Ъж†ЈжАІиµЛдЇИTзїЖиГЮе§ІйЗПзЪДжКЧеОЯзЙєеЉВжАІпЉМеПѓиГљеН†1015еИ∞1020дЄ™TCRйУЊ(8)гАВ
жѓПдЄ™TCRйУЊзЪДеПѓеПШзїУжЮДеЯЯжЬЙдЄЙдЄ™дЇТи°•еЖ≥еЃЪеМЇ(CDR): CDR1гАБCDR2еТМCDR3гАВCDR1еТМCDR2пЉМзФ±VеЯЇеЫ†зЙЗжЃµзЉЦз†БпЉМдЄїи¶БйАЪињЗдЄОMHCзЪДдњЭеЃИa-иЮЇжЧЛжО•иІ¶дњГињЫTCRеТМMHCдєЛйЧізЪДзЫЄдЇТдљЬзФ®гАВCDR3жШѓзФ±VеТМJжИЦDеТМJеЯЇеЫ†зЙЗжЃµзЪДдєЛйЧізЉЦз†БпЉМеѓЉиЗідЇЖйЂШеПШеЉВжАІгАВиѓ•еМЇеЯЯиіЯиі£зїУеРИMHCеСИйАТзЪДжКЧеОЯиВљ(8,10)гАВзФ±дЇОеЕґдЄОжКЧеОЯзЪДзЫіжО•зЫЄдЇТдљЬзФ®еТМеЫЇжЬЙзЪДйЂШеПШеЉВжАІпЉМCDR3еМЇдЄЇTCRзЪДзЙєеЉВжАІжПРдЊЫдЇЖдЄ∞еѓМзЪДе§Ъж†ЈжАІпЉМеЫ†ж≠§жШѓTCRжµЛеЇПеЄЄзФ®зЪДйЭґзВєеМЇеЯЯгАВ
TCRзЙєеЉВжАІжШѓеИ©зФ®TCRжµЛеЇПжЭ•дЇЖиІ£TзїЖиГЮзФЯзЙ©е≠¶еТМеК®еКЫе≠¶пЉМдї•еПКз†Фз©ґзЦЊзЧЕиГМжЩѓдЄЛзЪДTзїЖиГЮеТМдЄЇж≤їзЦЧжЦєж≥ХзЪДеПСе±ХжПРдЊЫдњ°жБѓзЪДеЯЇз°АгАВиЩљзДґзЫЄеРМзЪДTCRеПѓиГљжЫіеАЊеРСдЇОиѓЖеИЂзЫЄеРМзЪДжКЧеОЯпЉМдљЖдєЯиІВеѓЯеИ∞е≠ШеЬ®дЇ§еПЙеПНеЇФжАІпЉМеЕґдЄ≠еНХдЄ™TCRеЕЈжЬЙиѓЖеИЂе§ЪдЄ™pMHCеѓєзЪДиГљеКЫ(14-16)гАВеЫ†дЄЇTCRзЪДдЇ§еПЙеПНеЇФжАІжЬЙеПѓиГљдљњTзїЖиГЮзЊ§зЪДи°®еЊБеТМзЫСжµЛе§НжЭВеМЦпЉМеЫ†ж≠§еЬ®еИЖжЮРTCRжµЛеЇПеТМй™МиѓБжКЧеОЯзЙєеЉВжАІжЧґпЉМињЩдЄАзВєдЄНеЃєењљиІЖгАВ
жЦєж≥ХдЄОзїУжЮЬ
1
е§ЪйЗНPCRеТМ5вАЩRACEеїЇеЇУ
еЬ®TзїЖиГЮеЇУеИґе§ЗињЗз®ЛдЄ≠пЉМжЬЙдЄ§зІНеЄЄзФ®зЪДйЭґеРСжЙ©еҐЮжЦєж≥ХеИЖеИЂжШѓе§ЪйЗНPCRеТМ5вАЩRACE ,ињЩдЄ§зІНжЦєж≥ХйАЪеЄЄдЄїи¶БжЙ©еҐЮTCRзЪДCDR3еМЇеЯЯгАВ
е§ЪйЗНPCRеЉХзЙ©еїЇеЇУпЉЪ
е§ЪйЗНиБЪеРИйЕґйУЊеЉПеПНеЇФ襀府ж≥ЫеЇФзФ®пЉМеЃГжґЙеПКдљњзФ®JеЯЇеЫ†зЙЗжЃµз≠ЙдљНеЯЇеЫ†еЉХзЙ©жИЦTCRжБТеЃЪеМЇеЉХзЙ©дЄОеЈ≤зЯ•VеЯЇеЫ†зЙЗжЃµз≠ЙдљНеЯЇеЫ†зЪДжЈЈеРИзЙ©зїУеРИжЙ©еҐЮCDR3еМЇеЯЯзЪДgDNAжИЦRNAгАВдїОжЬђиі®дЄКиЃ≤пЉМе§ЪйЗНPCRеПЧеИ∞еПѓзФ®еЉХзЙ©зЪДйЩРеИґ;ж≠£еЫ†дЄЇе¶Вж≠§пЉМжЦ∞зЪДVз≠ЙдљНеЯЇеЫ†дЄНиÚ襀еЗЖз°ЃеЬ∞и°®иЊЊгАВж≠§е§ЦпЉМе§ЪйЗНPCRдЄ≠зЪДеЉХзЙ©еБПзљЃдЉЪеѓЉиЗіз≠ЙдљНеЯЇеЫ†жЙ©еҐЮдЄНеЭЗеМАпЉМеѓЉиЗідЄНеЗЖз°ЃзЪДзЫЄеѓєTCRеЇПеИЧйҐСзОЗ(8)гАВйАЪињЗиЃЊиЃ°дњЃжФєеПМжЭ°з†БеТМUMIжЬЙеК©дЇОеОїйЩ§PCRжЙ©еҐЮињЗз®ЛдЄ≠еЉХеЕ•зЪДдЇІзЙ©пЉМеєґжФѓжМБеЗЖз°ЃзЪДдЄЛжЄЄеЇПеИЧеИЖжЮРгАВ
5вАЩRACEеНХеѓєеЉХзЙ©еїЇеЇУпЉЪ
5вАЩRACEеИ©зФ®RNAпЉМеП™дљњзФ®дЄАеѓєеЉХзЙ©еѓєйЭґеРСTCRйУЊзЪДжБТеЃЪеМЇеЯЯеТМmRNA5вАЩзЂѓпЉМињЩжґИйЩ§дЇЖе§ЪйЗНPCRжЙАеЄ¶жЭ•зЪДеБПеЈЃпЉМеєґеЕБиЃЄжНХиОЈзїЩеЃЪж†ЈеУБдЄ≠е≠ШеЬ®зЪДжЙАжЬЙTCRгАВ
2
bulkжµЛеЇПеТМеНХзїЖиГЮжµЛеЇП
еЕ≥дЇОжµЛеЇПжЦєж≥ХпЉМbulkжµЛеЇПжИЦеНХзїЖиГЮжµЛеЇПеПѓзФ®дЇОеИЖжЮРTзїЖиГЮеЇУгАВ
bulkжµЛеЇПпЉЪ
еЃГеѓєж†ЈжЬђдЄ≠жЬ™йЕНеѓєзЪДTCRйУЊзЪДиБЪйЫЖињЫи°МжµЛеЇПпЉМйАЪеЄЄзФ®дЇОеИЖжЮРе§ІиІДж®°TCRе§Ъж†ЈжАІеєґжѓФиЊГжВ£иАЕйШЯеИЧдЄ≠зЪДдЇЇзЊ§(8)гАВдїОеОЖеП≤дЄКзЬЛпЉМжЙєйЗПеИЖжЮРжЦєж≥ХдЄїи¶БйЫЖдЄ≠дЇОTCRќ≤йУЊ(жИЦќі¬†гАБTзїЖиГЮдЄ≠зЪДќ≥ќі)зЪДжµЛеЇПпЉМеЫ†дЄЇдЄОќ±йУЊзЫЄжѓФпЉМе≠ШеЬ®йҐЭе§ЦзЪДDеЯЇеЫ†зЙЗжЃµеТМжЫіе§ІзЪДзїДеРИе§Ъж†ЈжАІгАВж≠§е§ЦпЉМTзїЖиГЮеПВдЄОвАЬз≠ЙдљНеЯЇеЫ†жОТжЦ•вАЭпЉМеЬ®ињЩзІНжГЕеЖµдЄЛпЉМTзїЖиГЮдЄ≠еП™жЬЙдЄАжЭ°еКЯиГљжАІќ≤йУЊе≠ШеЬ®пЉМиАМе§ЪжЭ°ќ±йУЊдєЯеПѓиГљи°®иЊЊ(27)гАВзДґиАМпЉМдїЕеѓєќ≤йУЊињЫи°МжµЛеЇПзЪДдЄАдЄ™дЄїи¶БйЩРеИґжШѓеЃГдЄНиГљжПРдЊЫеЕ≥дЇОќ≤йУЊйЕНеѓєжИЦжµЛеЇПеРОTзїЖиГЮдљУеЖЕзФЯзЙ©е≠¶еКЯиГљзЪДдњ°жБѓгАВ
еНХзїЖиГЮжµЛеЇПпЉЪ
еНХзїЖиГЮжµЛеЇПдЊІйЗНдЇОеНХдЄ™еЕНзЦЂзїЖиГЮгАВеНХзїЖиГЮеИЖз¶їжКАжЬѓзЪДињЫж≠•пЉМе¶ВиНІеЕЙжіїеМЦзїЖиГЮеИЖйАЙеТМеЊЃжµБжОІеє≥еП∞пЉМдЄЇеНХзїЖиГЮTCRжµЛеЇПзЪДжИРеКЯ商еЃЪдЇЖеЯЇз°А(28)гАВиЩљзДґbulkжµЛеЇПжПРдЊЫдЇЖTCRе§Ъж†ЈжАІзЪДеЃЭиіµдњ°жБѓпЉМдљЖеЃГзЉЇдєПеНХзїЖиГЮеИЖжЮРеЕ®TCRќ±ќ≤йУЊйЕНеѓєзЪДеИЖиЊ®зОЗгАВ
еНХзїЖиГЮжµЛеЇПжПРдЊЫдЇЖеѓєTзїЖиГЮеЇУжЫіжЬЙйТИеѓєжАІеТМзЙєеЉВжАІзЪДеИЖжЮРпЉМжПРдЊЫдЇЖйЕНеѓєќ±йУЊеТМќ≤йУЊеЇПеИЧзЪДйЗНи¶Бдњ°жБѓ;зДґиАМпЉМињЩзІНжЦєж≥ХеПЧеИ∞еПѓдї•дїОзїЩеЃЪж†ЈеУБдЄ≠е§ДзРЖзЪДзїЖиГЮжХ∞йЗПзЪДйЩРеИґпЉМеєґдЄФеПѓиГљжЧ†ж≥Хж£АжµЛеИ∞зљХиІБзЪДеЕЛйЪЖеЮЛгАВжАїзЪДжЭ•иѓіпЉМйАЪињЗеИЖжЮРеНХдЄ™зїЖиГЮдЄ≠зЪДеЯЇеЫ†и°®иЊЊпЉМеНХзїЖиГЮеИЖжЮРеПѓдї•жЫіжЈ±еЕ•еЬ∞дЇЖиІ£зїЖиГЮйЧійБЧдЉ†е§Ъж†ЈжАІеТМдљУеЖЕзФЯзЙ©е≠¶еКЯиГљгАВ
1
TCRеЇУзЪДжМЗж†ЗзЙєеЊБ
еЫЊ2.TзїЖиГЮеЇУжМЗж†ЗжШЊз§Ї
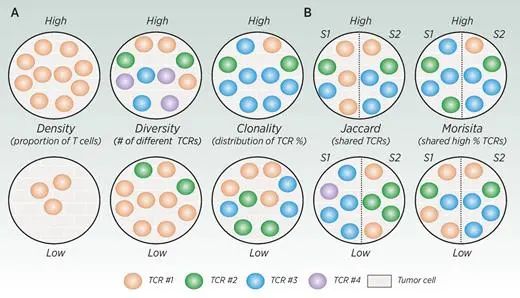
(еЫЊ2A)TзїЖиГЮеѓЖеЇ¶пЉМе§Ъж†ЈжАІеТМеЕЛйЪЖжМЗж†Зе±Хз§ЇTзїЖиГЮеЇУзЪДзЙєеЊБгАВйЂШжМЗж†ЗдЄОдљОжМЗж†ЗеѓєжѓФпЉМйҐЬиЙ≤дї£и°®дЄНеРМзЪДTзїЖиГЮеЕЛйЪЖз±їеЮЛгАВеѓЖеЇ¶жШѓжМЗTзїЖиГЮеЬ®зїЩеЃЪеМЇеЯЯзЪДжѓФдЊЛпЉМе§Ъж†ЈжАІжШѓжМЗж†ЈеУБдЄ≠зЛђзЙєеЕЛйЪЖеЮЛзЪДжХ∞йЗПпЉМеЕЛйЪЖжАІжШѓжМЗж†ЈеУБдЄ≠еЕЛйЪЖеЮЛзЪДжЙ©еҐЮгАВ
йЩ§дЇЖжК•еСКеНХдЄ™ж†ЈжЬђе±ЮжАІзЪДжМЗж†Зе§ЦпЉМињШжЬЙдЄАдЇЫжМЗж†ЗжЬЙеК©дЇОжѓФиЊГдЄНеРМж†ЈжЬђдєЛйЧізЪДTзїЖиГЮеЇУгАВеЄЄзФ®зЪДдЄ§дЄ™зЫЄдЉЉеЇ¶жМЗжХ∞жШѓJaccardжМЗжХ∞еТМMorisitaйЗНеП†жМЗжХ∞(MOI)гАВJaccardжМЗжХ∞еТМSorensenжМЗжХ∞з≠ЙзЫЄеЕ≥жМЗжХ∞дїЕеЯЇдЇОе§ЪдЄ™ж†ЈжЬђдЄ≠жШѓеР¶е≠ШеЬ®зЙєеЃЪзЪДTCRеЇПеИЧгАВињЩдЇЫжЦєж≥ХеЬ®жѓФиЊГжЧґеЊИжЬЙзФ®дљЖжЧ†ж≥ХжѓФиЊГж†ЈжЬђдєЛйЧізЙєеЃЪTCRеЇПеИЧзЪДзЫЄеѓєйҐСзОЗгАВзЫЄжѓФдєЛдЄЛпЉМMOIиІ£йЗКдЇЖзЫЄеѓєйҐСзОЗдї•еПКзЙєеЃЪTCRеЇПеИЧзЪДе≠ШеЬ®пЉМжПРдЊЫдЇЖжЭ•иЗ™дЄНеРМж†ЈжЬђзЪДTзїЖиГЮеЇУзЪДжЫіеЕ®йЭҐзЪДжѓФиЊГ(еЫЊ2B)гАВ
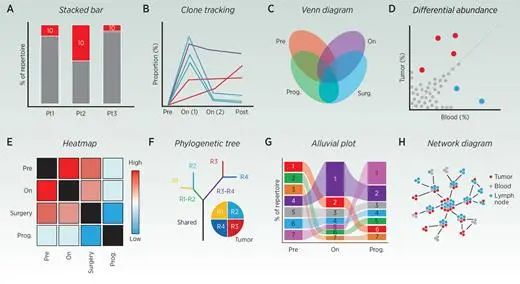
еЫЊ3.TCRжМЗж†ЗеТМйЗНеП†TOP10жХ∞жНЃ
еЕЛйЪЖеЮЛ(A)гАБеЕЛйЪЖиЈЯиЄ™еЫЊ(B)гАБзїіжБ©еЫЊ(C)гАБеЈЃеЉВдЄ∞еЇ¶еЫЊ(D)гАБзГ≠еЫЊ(E)гАБз≥їзїЯеПСиВ≤ж†С(F)гАБеЖ≤зІѓеЫЊ(G)еТМзљСзїЬеЫЊ(H);еЭЗзФ®дЇОи°®з§ЇTCRжХ∞жНЃгАВињЩдЇЫеЫЊи°®жПРдЊЫдЇЖеЕ≥дЇОTзїЖиГЮеЕЛйЪЖеЮЛеЬ®дЄНеРМжВ£иАЕгАБдЄНеРМзїДзїЗз±їеЮЛгАБдЄНеРМзЦЊзЧЕжИЦж≤їзЦЧжЭ°дїґдЄЛзЪДйҐСзОЗеТМињЫеМЦзЪДдњ°жБѓгАВ
еЕЛйЪЖиЈЯиЄ™еТМеЈЃеЉВдЄ∞еЇ¶еИЖжЮРеПѓдї•ењЂйАЯиѓЖеИЂзЇµеРСж†ЈжЬђдЄ≠жЙ©еҐЮеТМжФґзЉ©зЪДTзїЖиГЮзЊ§пЉМдљњз†Фз©ґдЇЇеСШиГље§ЯзЫСжµЛеТМйҐДжµЛеЬ®зЦЊзЧЕеТМж≤їзЦЧињЗз®ЛдЄ≠зЪДеЕНзЦЂеПНеЇФгАВ
2
TCRеТМжКЧеОЯжХ∞жНЃеЇУ
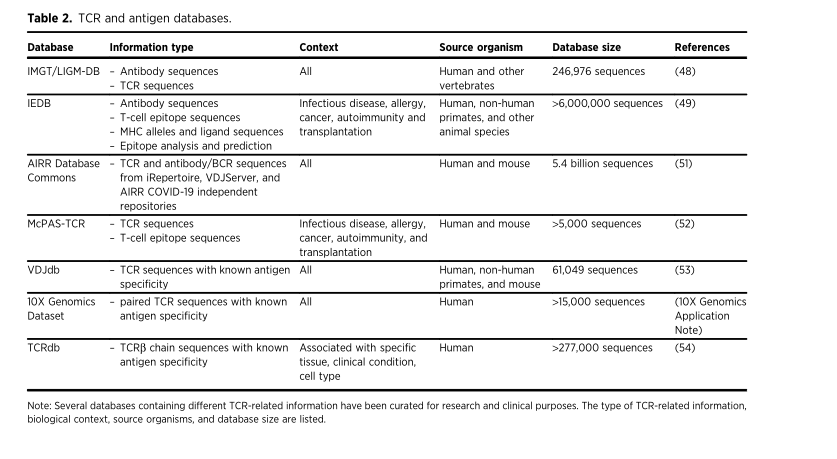
ињЩдЇЫжХ∞жНЃеЇУжШѓиЃЄе§ЪиЃ°зЃЧеЈ•еЕЈзЪДеЯЇз°АпЉМзФ®дЇОеИЖжЮРTCRеЇУеТМеЕНзЦЂеПНеЇФзЪДйЗНи¶БжЦєйЭҐгАВ
3
йҐДжµЛжКЧеОЯзЙєеЉВжАІзЪДиЃ°зЃЧеЈ•еЕЈ
дЄНдїЕйАЪињЗзЙєеЃЪжМЗж†ЗжППињ∞TзїЖиГЮеЇУзЪДеКЯиГљпЉМTCRжµЛеЇПињШдЄЇз°ЃеЃЪTзїЖиГЮжКЧеОЯзЙєеЉВжАІжПРдЊЫдЇЖдњ°жБѓгАВињЩдЇЫдњ°жБѓеПѓдї•еЄЃеК©жИСдїђжЫіе•љеЬ∞дЇЖиІ£дЄ™дљУеЖЕTзїЖиГЮеѓєеЕЈдљУжКЧеОЯзЪДеПНеЇФжГЕеЖµпЉМдїОиАМжЫіе•љеЬ∞зРЖиІ£еТМж≤їзЦЧжЯРдЇЫзЦЊзЧЕгАВеРМжЧґпЉМињЩдЇЫдњ°жБѓдєЯдЄЇиЃЊиЃ°еЃЪеИґзЪДеЕНзЦЂж≤їзЦЧжЦєж≥ХжПРдЊЫдЇЖеЯЇз°АгАВеЬ®зЩМзЧЗеЕНзЦЂе≠¶йҐЖеЯЯпЉМиѓЖеИЂеТМйЭґеРСзФ±зЩМзїЖиГЮзЙєжЬЙзЪДдљУзїЖиГЮз™БеПШдЇІзФЯзЪДжЦ∞жКЧеОЯеТМиВљиЃ©дЇЇдїђйЗНиІЖиµЈжЭ•(64)гАВйЪПзЭАжЬАињСHTSжКАжЬѓзЪДињЫж≠•пЉМеМЕжЛђдљЬиАЕиЗ™еЈ±еЬ®еЖЕзЪДиЃЄе§ЪеЫҐйШЯеЈ≤зїПеЉАеПСеЗЇеЯЇдЇОжЬЇеЩ®е≠¶дє†еТМеЯЇдЇОзЃЧж≥ХзЪДеЈ•еЕЈпЉМжЧ®еЬ®йШРжШОжКЧеОЯзЙєеЉВжАІ(и°®3)гАВ
1
иВњзШ§зЙєжАІзЪДи°®иЊЊ
еЫЊ4.TCRжµЛеЇПеТМTзїЖиГЮеЇУеИЖжЮРзЪДеЇФзФ®
TCRжµЛеЇПдњГињЫдЇЖеѓєеЕНзЦЂиВњзШ§еЉВиі®жАІзЪДи°®иЊЊпЉМињЩдЄОиВњзШ§еПСзФЯињЗз®ЛдЄ≠иВњзШ§зїЖиГЮзЪДеЯЇеЫ†зїДеЉВиі®жАІжЬЙеЕ≥пЉМдљЬиАЕеѓєйЭЮе∞ПзїЖиГЮиВЇзЩМ(NSCLC)ињЫи°МдЇЖTCRжµЛеЇПпЉМеПСзО∞дЄНеРМиВњзШ§еМЇеЯЯдєЛйЧіTзїЖиГЮеѓЖеЇ¶еТМеЕЛйЪЖжАІе≠ШеЬ®жШЊиСЧеЈЃеЉВпЉМиВњзШ§еЖЕеЯЇеЫ†зїДеТМеЕНзЦЂеЉВиі®жАІе≠ШеЬ®зЫЄеЕ≥жАІпЉМи°®жШОTCRиВњзШ§еЖЕеЉВиі®жАІеПѓиГљзФ±дЄНеРМиВњзШ§еМЇеЯЯзЪДзЙєеЉВжАІжКЧеОЯй©±еК®¬†(46)гАВ
жЬАињСпЉМJoshiеПКеЕґеРМдЇЛињШжППињ∞дЇЖNSCLC TCRеЇУзЪДеЉВиі®жАІпЉМеєґжПРдЊЫдЇЖжЫіе§ЪиѓБжНЃи°®жШОTCRиВњзШ§еЖЕеЉВиі®жАІеПНжШ†дЇЖдЄНеРМиВњзШ§еМЇеЯЯзЪДз™БеПШ(103)гАВ
еЬ®йЭЮе∞ПзїЖиГЮиВЇзЩМиљђзІїдї•еПКеЕґдїЦзЩМзЧЗе¶ВйїСиЙ≤зі†зШ§еТМиВЊзїЖиГЮзЩМдЄ≠дєЯиІВеѓЯеИ∞жШЊиСЧзЪДTCRиВњзШ§еЖЕеЉВиі®жАІ(104-106)гАВ
йЩ§дЇЖи°®еЊБиВњзШ§еЖЕеЉВиі®жАІе§ЦпЉМTCRжµЛеЇПињШеПѓзФ®дЇОиІВеѓЯиВњзШ§йЧіеЉВиі®жАІгАВеЕЈдљУжЭ•иѓіпЉМдљЬиАЕзЪДеЫҐйШЯеИ©зФ®TCRжµЛеЇПжЭ•иІВеѓЯиВЇзЩМеТМйїСиЙ≤зі†зШ§еРМж≠•иљђзІїзЪДеЉВиі®TзїЖиГЮи∞±пЉМињЩдЇЫеЉВиі®TзїЖиГЮи∞±еѓєеЇФдЇОеЉВиі®з™БеПШеТМзФ≤еЯЇеМЦ(104,105)гАВ
йАЪињЗињЩдЇЫз†Фз©ґпЉМе§ЪдЄ™еРМж≠•иВњзШ§зЪДTCRжµЛеЇПиГље§ЯеЬ®ж≤їзЦЧеЙНиѓДдЉ∞иВњзШ§зЪДеЈЃеЉВзФЯйХњгАВеЬ®еРМдЄАдЊЛжВ£иАЕдЄ≠пЉМйЩ§дЇЖзЧЕзБґзЙєеЉВжАІж≤їзЦЧеПНеЇФпЉМйЭґеРСж≤їзЦЧеТМеЕНзЦЂж£АжЯ•зВєе∞БйФБдєЛйЧізЪДиљђзІїеЬ®еРМдЄАжВ£иАЕ(105)гАВ
жАїдєЛпЉМTCRиВњзШ§еЖЕеТМиВњзШ§йЧіеЉВиі®жАІеЬ®йШРжШОзЩМзЧЗеЕНзЦЂжЬЇеИґеТМйҐДжµЛеЕНзЦЂж≤їзЦЧеПНеЇФжЦєйЭҐеЕЈжЬЙйЗНи¶БжДПдєЙгАВ
йЩ§дЇЖжПРдЊЫеЉВиі®жАІдњ°жБѓе§ЦпЉМTCRжµЛеЇПињШжПРдЊЫдЇЖдЄАзІНйАЪињЗеЕНзЦЂзЫСжµЛжЭ•иЈЯиЄ™иВњзШ§ињЫеМЦзЪДжЦєж≥ХгАВ
DejimaеТМдїЦзЪДеРМдЇЛеПСзО∞пЉМйЪПзЭАиВЇзЩМдїОзЩМеЙНзЧЕеПШеПСе±Х䪯浪洶жАІиВЇиЕЇзЩМпЉМTзїЖиГЮдїЛеѓЉзЪДжКЧиВњзШ§еЕНзЦЂеКЯиГљдЉЪдЄЛйЩНгАВеЕЈдљУжЭ•иѓіпЉМйЪПзЭАиВЇзЩМжБґжАІз®ЛеЇ¶зЪДеК†йЗНпЉМеЕНзЦЂжњАжіїйАЪиЈѓдЄЛи∞ГпЉМеЕНзЦЂжКСеИґйАЪиЈѓдЄКи∞ГпЉМTзїЖиГЮеЕЛйЪЖжАІеТМtзїЖиГЮиВњзا浪洶еЗПе∞С(108)гАВ
CuiеТМдїЦзЪДеРМдЇЛжК•йБУпЉМеЬ®дїОеЃЂйҐИдЄКзЪЃеЖЕзШ§еПШеИ∞еЃЂйҐИзЩМзЪДињЗз®ЛдЄ≠пЉМе§ЦеС®и°АдЄ≠TCRеЇУзЪДе§Ъж†ЈжАІйАРжЄРеЗПе∞СпЉМеєґдЄФеЬ®жВ£иАЕдєЛйЧіе≠ШеЬ®еЕЈжЬЙзЫЄдЉЉCDR3еЯЇеЇПзЪДзЙєеЉВжАІеЕЛйЪЖеЮЛ(109)гАВ
иВњзШ§еПСе±ХињЗз®ЛдЄ≠еЕНзЦЂе≠¶иґЛеКњзЪДиѓЖеИЂжЬЙеК©дЇОиВњзШ§зЪДеИЖз±їеИЖзЇІдї•еПКеЄЃеК©дЉШеМЦеЯЇдЇОзЩМзЧЗеИЖжЬЯзЪДеЕНзЦЂзЦЧж≥ХгАВ
еЯЇдЇОжЬАињСзЪДиІВеѓЯпЉМзЩМзЧЗзЫЄеЕ≥TCRдЄОж≠£еЄЄзїДзїЗдЄ≠зЪДTCRеЕЈжЬЙзЫЄдЉЉзЪДзФЯеМЦзЙєеЊБпЉМBeshnovaеТМеРМдЇЛеЉАеПСдЇЖдЄАзІНеРНдЄЇDeepCAT(зЩМзЧЗзЫЄеЕ≥TCRзЪДжЈ±еЇ¶CNNж®°еЮЛ)зЪДжЬЇеЩ®е≠¶дє†жЦєж≥ХпЉМдї•йҐДжµЛжВ£иАЕе§ЦеС®и°АдЄ≠жШѓеР¶е≠ШеЬ®зЩМзЧЗзЫЄеЕ≥зЪДTCRгАВDeepCATеЬ®еМЇеИЖзЩМзЧЗжВ£иАЕеТМеБ•еЇЈдЄ™дљУжЦєйЭҐи°®зО∞еЗЇеЊИйЂШзЪДйҐДжµЛеЗЖз°ЃжАІпЉМеѓєеЗ†зІНжЧ©жЬЯзЩМзЧЗ(еМЕжЛђдє≥иЕЇзЩМгАБеНµеЈҐзЩМеТМйїСиЙ≤зі†зШ§)зЪДAUCйЂШдЇО0.95гАВжАїзЪДжЭ•иѓіпЉМDeepCATдї£и°®дЇЖдЄАзІНжљЬеЬ®зЪДжЧ†еИЫжЧ©жЬЯзЩМзЧЗж£АжµЛжЦєж≥Х(110)гАВ
2
еЕНзЦЂзЦЧж≥ХзЪДеПСе±ХеТМзЙєжАІ
TCRжµЛеЇПжШѓељУеЙНTзїЖиГЮж≤їзЦЧжЙАењЕйЬАзЪДгАВињЗзїІжАІTзїЖиГЮиљђзІїж≤їзЦЧдї•еЙНдЊЭиµЦдЇОиЗ™дљУиЊУж≥®жЙ©е§ІзЪДиВњзا浪洶жАІTзїЖиГЮ;зДґиАМпЉМзФ±дЇОиВњзا浪洶зїДдЄ≠жЦ∞жКЧеОЯзЙєеЉВжАІTзїЖиГЮзЪДйҐСзОЗиЊГдљОпЉМиЃЄе§ЪжВ£иАЕеѓєињЩзІНж≤їзЦЧж≤°жЬЙеПНеЇФ(111)гАВ
и°®иЊЊжЦ∞еЮЛTCRsзЪДеЯЇеЫ†дњЃй•∞TзїЖиГЮеЬ®еЖЕзЪДTзїЖиГЮзЦЧж≥ХзЪДињЫе±ХеЈ≤зїПеПСе±ХеИ∞еПѓдї•еЉХеПСиВњзШ§зЙєеЉВжАІзЪДиВњзШ§зїЖиГЮеЕНзЦЂеПНеЇФ(112) гАВ
йАЪињЗйЙіеЃЪжЬАдљ≥йЭґжКЧеОЯеТМиВњзШ§жКЧеОЯзЙєеЉВжАІTCR, TCRжµЛеЇПеЬ®жПРйЂШTзїЖиГЮж≤їзЦЧзЪДзЦЧжХИжЦєйЭҐеПСжМ•зЭАйЗНи¶БдљЬзФ®(11,113)гАВ
еИЖз¶їзЪДжЦ∞жКЧеОЯзЙєеЉВжАІTзїЖиГЮеПѓдї•ињЫи°МжХідљУжИЦеНХзїЖиГЮTCRжµЛеЇПпЉМдї•йЙіеЃЪиВњзШ§еЖЕзЪДжШЊжАІTCRеЕЛйЪЖеЮЛ(111)гАВ
йЩ§дЇЖжО®еК®TзїЖиГЮзЦЧж≥ХзЪДзЙєеЉВжАІпЉМTCRжµЛеЇПдєЯеПѓдї•дљЬдЄЇдЄАзІНиѓДдЉ∞еТМиЈЯиЄ™еЕНзЦЂж≤їзЦЧеРОзЪДTзїЖиГЮеЕЛйЪЖеЮЛзЪДеЈ•еЕЈгАВдЊЛе¶ВпЉМйАЪињЗеѓєTCRќ≤йУЊеПѓеПШеМЇеЯЯзЪДжЈ±еЇ¶жµЛеЇПпЉМиЈЯиЄ™дЇЖдЄАеРНзїПињЗињЗзїІзїЖиГЮж≤їзЦЧеРОиВњзШ§жґИйААзЪДиљђзІїжАІзїУзЫіиВ†зЩМжВ£иАЕдљУеЖЕTCRsеѓєз™БеПШдљУKRAS G12DеПСзФЯеПНеЇФзЪДйҐСзОЗгАВеПСзО∞иЊУж≥®еРОдЄАжЃµжЧґйЧіж≤°жЬЙж£АжµЛеИ∞жЬАдЄїи¶БзЪДеЕЛйЪЖеЮЛпЉМиАМдЄН姙䪿и¶БзЪДеЕЛйЪЖеЮЛжМБзї≠е≠ШеЬ®(114)гАВж≠§е§ЦпЉМеѓєTCRќ≤йУЊзЪДжµЛеЇПжШЊз§ЇпЉМеµМеРИжКЧеОЯеПЧдљУ(CAR-T)зїЖиГЮзЪДеЕЛйЪЖе§Ъж†ЈжАІеЬ®жА•жАІжЈЛеЈізїЖиГЮзЩљи°АзЧЕеТМйЭЮйЬНе•ЗйЗСжЈЛеЈізШ§жВ£иАЕзЪДи°Ажґ≤дЄ≠жЬАйЂШпЉМеєґйЪПзЭАжЧґйЧізЪДжО®зІїиАМдЄЛйЩНгАВињШеПСзО∞еНХдЄ™TзїЖиГЮеЕЛйЪЖеЮЛи°®зО∞еЗЇдЄНеРМзЪДеЕЛйЪЖеК®еКЫе≠¶пЉМеєґеЬ®еЫЮиЊУеРОеѓєCAR-TзїЖиГЮ汆䯲зФЯдЄНеРМзЪДељ±еУН(115)гАВ
еѓєTCRеЇУзЪДеИЖжЮРдєЯдљњз†Фз©ґдЇЇеСШиГље§ЯйШРжШОеЕНзЦЂж≤їзЦЧзЪДжљЬеЬ®дљЬзФ®жЬЇеИґпЉМдї•еПКеЃГеѓєеЕНзЦЂзїЖиГЮзЪДељ±еУНгАВSipuleucel-TжШѓдЄАзІНиЗ™дљУзїЖиГЮзЦЧж≥ХпЉМдєЯжШѓдЄАзІНзЩМзЧЗзЦЂиЛЧпЉМеЕґдЄ≠APCs襀жњАжіїдї•еѓєжКЧеЙНеИЧиЕЇйЕЄз£ЈйЕЄйЕґжКЧеОЯпЉМиѓ•жКЧеОЯеЬ®еЙНеИЧиЕЇзЩМдЄ≠еєњж≥Ыи°®иЊЊ(116)гАВSheikеПКеЕґеРМдЇЛеИ©зФ®TCRжµЛеЇПжЭ•и°®еЊБsipuleucel-TзЪДдљЬзФ®жЬЇеИґгАВдїЦдїђеПСзО∞пЉМж≤їзЦЧдњГињЫдЇЖTзїЖиГЮињЫеЕ•еЙНеИЧиЕЇзЪДеЛЯйЫЖпЉМиАМдЄНжШѓдњГињЫTзїЖиГЮеЕЛйЪЖзЪДжЙ©еЉ†пЉМеЫ†дЄЇеЊ™зОѓTзїЖиГЮзЪДе§Ъж†ЈжАІеЗПе∞СдЇЖпЉМиАМиВњзا浪洶зЪДе§Ъж†ЈжАІдєЯеЗПе∞СдЇЖTзїЖиГЮеҐЮеК†(117)гАВ
еЬ®еП¶дЄАй°єз†Фз©ґдЄ≠пЉМWielandеПКеЕґеРМдЇЛеИ©зФ®TCRжµЛеЇПж£АжµЛдЇЖйїСиЙ≤зі†зШ§жВ£иАЕе§ЦеС®и°АеТМиВњзا浪洶CD8+TзїЖиГЮзЪДзїДжИРпЉМињЩдЇЫзїЖиГЮеЬ®жКЧPD-1ж≤їзЦЧеРО襀жњАжіїпЉМдїЦдїђеЬ®е§ЦеС®и°АдЄ≠еПСзО∞дЇЖCD8+TзїЖиГЮзЪДDAеНХеЕЛйЪЖеЇУпЉМеєґи°®жШОе§Іе§ЪжХ∞жШЊжАІе§ЦеС®и°АеЕЛйЪЖеЬ®ж≤їзЦЧеРОж≤°жЬЙжЙ©еҐЮпЉМиАМеЬ®еИЗйЩ§зЪДиВњзШ§дЄ≠еПСзО∞еЕЛйЪЖжЙ©еҐЮгАВ
3
йҐДжµЛжВ£иАЕйҐДеРОгАБж≤їзЦЧеПНеЇФеТМжѓТжАІ
йЩ§дЇЖдЄЇеЕНзЦЂзЦЧж≥ХзЪДеПСе±ХжПРдЊЫдњ°жБѓе§ЦпЉМTCRжµЛеЇПеТМи°НзФЯзЪДTCRеЇУжМЗж†ЗеЬ®йҐДжµЛжВ£иАЕйҐДеРОжЦєйЭҐеЕЈжЬЙеЃЮзФ®дїЈеАЉгАВ
TCRе§Ъж†ЈжАІдї£и°®дЇЖйїСиЙ≤зі†зШ§жВ£иАЕзЪДйҐДеРОзФЯзЙ©ж†ЗењЧзЙ©пЉМеЬ®йїСиЙ≤зі†зШ§жВ£иАЕдЄ≠пЉМе§ЦеС®и°АеТМжЈЛеЈізїУиљђзІїдЄ≠tзїЖиГЮеЭЗеМАеЇ¶еТМдЄ∞еѓМеЇ¶жЫійЂШзЪДжВ£иАЕеЕЈжЬЙжЫійХњзЪДжЧ†ињЫе±ХзФЯе≠ШжЬЯеТМжАїзФЯе≠ШжЬЯ(119)гАВ
иВњзا浪洶жАІTзїЖиГЮеЯЇзЇњTCRеЇУе§Ъж†ЈжАІзЪДеҐЮеʆ襀еПСзО∞еѓєе§ЪзІНзЩМзЧЗзЪДйҐДеРОжЬЙељ±еУНпЉМеМЕжЛђдє≥иЕЇзЩМгАБйїСиЙ≤зі†зШ§гАБиВЇзЩМеТМиВЊзЩМ(120)гАВ
еЬ®дЄАй°єйТИеѓєйЂШзЇІеИЂжµЖжґ≤жАІеНµеЈҐзЩМзЪДз†Фз©ґдЄ≠пЉМйЂШTзїЖиГЮеЕЛйЪЖжАІзїУеРИеЯЇеЫ†зїДдЄНз®≥еЃЪжАІзЙєеЊБ(еМЕжЛђеРМжЇРйЗНзїДзЉЇйЩЈеТМжЛЈиіЭжХ∞еПШеЉВ)жИЦTзїЖиГЮ浪洶еИ∞иВњзШ§дЄ≠еѓЉиЗійЂШйҐДеРОдїЈеАЉ(121)гАВ
ж≠§е§ЦпЉМжЙ©еҐЮзЪДTзїЖиГЮеѓєжЭ•иЗ™йЂШеПШеЉВз≠ЙдљНеЯЇеЫ†йҐСзОЗз™БеПШзЪДжЦ∞жКЧеОЯеЕЈжЬЙжЫійЂШдЇ≤еТМеКЫзЪДжВ£иАЕпЉМжЫіжЬЙеПѓиГљеЬ®иВЇзЩМеТМйїСиЙ≤зі†зШ§дЄ≠и°®зО∞еЗЇжЫіе•љзЪДйҐДеРОеТМеѓєеЕНзЦЂзЦЧж≥ХзЪДеПНеЇФ(35).
TCRеЇУдєЯеПѓзФ®дЇОйҐДжµЛжВ£иАЕеѓєдЄНеРМзЩМзЧЗеЕНзЦЂзЦЧж≥ХзЪДеПНеЇФгАВжЩЪжЬЯйїСиЙ≤зі†зШ§жВ£иАЕеЬ®жО•еПЧipilimumab(дЄАзІНCTLA-4жКСеИґеЙВ)ж≤їзЦЧдєЛеЙНпЉМе§ЦеС®и°АдЄ≠TCRе§Ъж†ЈжАІзЪДдЄ∞еѓМеЇ¶еТМеЭЗеМАеЇ¶йГљжЬЙжЙАеҐЮеК†пЉМдЄОж≤їзЦЧзЫЄжѓФпЉМдЄіеЇКиОЈзЫКжЫіе§І(122)гАВ
дЄАй°єйТИеѓєжЩЪжЬЯйЭЮе∞ПзїЖиГЮиВЇзЩМзЪДз†Фз©ґи°®жШОпЉМеЬ®ж≤їзЦЧжЬЯйЧіе§ЦеС®и°АдЄ≠TCRеРЂйЗПиЊГйЂШзЪДжВ£иАЕдїОжКЧPD-1еЕНзЦЂж≤їзЦЧдЄ≠иОЈеЊЧдЇЖжЬАе§ІзЪДдЄіеЇКзЫКе§ДпЉМеРМжЧґдєЯеїґйХњдЇЖжЧ†ињЫе±ХзФЯе≠ШжЬЯеТМжАїзФЯе≠ШжЬЯгАВеЬ®еРМдЄАй°єз†Фз©ґдЄ≠пЉМдї•ж≤їзЦЧеЙНеТМдЄНеРМж≤їзЦЧжЧґйЧізВєдєЛйЧізЪДJaccardзЫЄдЉЉжМЗжХ∞еАЉиЊГйЂШзЪДжВ£иАЕжШЊз§ЇеЗЇжФєеЦДзЪДжЧ†ињЫе±ХзФЯе≠ШжЬЯпЉМеЗЄжШЊдЇЖж≤їзЦЧжЬЯйЧіеЕНзЦЂзЫСжµЛзЪДйЗНи¶БжАІ(123)гАВ
еЬ®зїПеЕЄйЬНе•ЗйЗСжЈЛеЈізШ§жВ£иАЕдЄ≠пЉМTCRеЇУеЯЇзЇњеҐЮеК†еТМж≤їзЦЧжЬЯйЧізЪДеЕЛйЪЖжАІеҐЮеК†дЄОnivo-lumabпЉИдЄАзІНPD-1жКСеИґеЙВпЉЙзЪДжШЊиСЧеПНеЇФжЬЙеЕ≥пЉМдЄ§иАЕеЬ®еЯЇзЇњжЧґйГљеҐЮеК†дЇЖTCRеЇУзЪДе§Ъж†ЈжАІпЉМжВ£иАЕеѓєPD-1жКСеИґеЙВзЇ≥ж≠¶еНХжКЧ(nivolumab)жЬЙжШЊиСЧзЪДеЇФз≠ФпЉМиАМеѓєPD-1жКСеИґеЙВзЇ≥ж≠¶еНХжКЧ(nivolumab)жЬЙжШЊиСЧзЪДеЇФз≠ФпЉМзїПеЕЄйЬНе•ЗйЗСжЈЛеЈізШ§жВ£иАЕпЉМдї•еПКEBVйШ≥жАІйЉїеТљзЩМжВ£иАЕиЗ™дљУEBзЧЕжѓТ(EBV)жЙ©е±ХCTLsеЕНзЦЂж≤їзЦЧгАВ
ж≠§е§ЦпЉМеЬ®ж≤їзЦЧеЙНиВњзا浪洶TзїЖиГЮжЫійЂШзЪДTCRеЕЛйЪЖжАІеПѓйҐДжµЛиљђзІїжАІйїСиЙ≤зі†зШ§жВ£иАЕжКЧPD -1еЕНзЦЂж≤їзЦЧзЪДзЦЧжХИ(120)гАВ
иЩљзДґзЩМзЧЗеЕНзЦЂзЦЧж≥ХдњГињЫдЇЖжШЊиСЧзЪДжКЧиВњзШ§еЕНзЦЂеПНеЇФпЉМдљЖеЃГдїђдєЯжЬЙеПѓиГљеЉХиµЈдЄОзВОзЧЗзЫЄеЕ≥зЪДжѓТжАІеПНеЇФгАВйЩ§дЇЖдљЬдЄЇйҐДеРОеТМйҐДжµЛжВ£иАЕйҐДеРОеТМеЕНзЦЂж≤їзЦЧеПНеЇФзЪДзФЯзЙ©ж†ЗењЧзЙ©е§ЦпЉМTCRжµЛеЇПдєЯеПѓдї•жПРдЊЫдЄОжљЬеЬ®зЪДеЕНзЦЂж≤їзЦЧзЫЄеЕ≥зЪДжѓТжАІеПНеЇФзЪДдњ°жБѓгАВеЬ®жО•еПЧжКЧCTLA-4ж≤їзЦЧзЪДеЙНеИЧиЕЇзЩМжВ£иАЕдЄ≠пЉМеЕЛйЪЖжАІзЪДж£АжµЛдЄОеЕНзЦЂзЫЄеЕ≥дЄНиЙѓдЇЛдїґпЉИirAEпЉЙжЬЙеЕ≥пЉЫеЬ®е§ЦеС®и°АдЄ≠жЙ©еҐЮдЇЖ55дЄ™дї•дЄКCD8+TзїЖиГЮеЕЛйЪЖдљУйҐДз§ЇзЭАдЄ•йЗНзЪДirAEзЪДеПСе±ХпЉИ126пЉЙгАВеП¶дЄАй°єз†Фз©ґе∞ЖCD4+иЃ∞ењЖTзїЖиГЮеЬ®жВ£жЬЙйїСиЙ≤зі†зШ§жВ£иАЕзЪДе§ЦеС®и°АдЄ≠зЪДеѓЖеЇ¶еТМе§Ъж†ЈжАІдЄОжКЧ-PD-1еНХдЄАзЦЧж≥ХеТМжКЧ-PD-1еТМжКЧ-CTLA-4иБФеРИзЦЧж≥ХзЪДдЄ•йЗНirAEзЪДеПСе±ХзЫЄеЕ≥иБФпЉИ127пЉЙгАВ
TCRеЇУжµЛеЇПжМЗж†ЗеПѓиГљдЄОзІѓжЮБеТМжґИжЮБзЪДдЄіеЇКзїУжЮЬзЫЄеЕ≥иБФпЉМTCRжµЛеЇПеПѓдї•дЄЇеЉАеПСдЄ™жАІеМЦзЪДеЕНзЦЂж≤їзЦЧжЦєж≥ХжПРдЊЫдњ°жБѓпЉМдї•жПРйЂШж≤їзЦЧжХИжЮЬеТМйБњеЕНдЄНењЕи¶БзЪДй£ОйЩ©гАВ(еЫЊ4)гАВ
TCRжµЛеЇПзЪДеЃЮзФ®жАІдЄНдїЕдїЕйЩРдЇОзЩМзЧЗеЇФзФ®гАВзФ±дЇОTзїЖиГЮеПКеЕґTCRйАЪињЗиѓЖеИЂеТМжґИйЩ§дЄНзЫЄеЃєзЪДзїДзїЗеЬ®еУЇдє≥еК®зЙ©еЉВдљУеПНеЇФдЄ≠иµЈзЭАдЄНеПѓжИЦзЉЇзЪДдљЬзФ®пЉМз†Фз©ґдЇЇеСШеИ©зФ®TCRжµЛеЇПжЭ•и°®еЊБеЩ®еЃШзІїж§НзЪДеПНеЇФ(128)гАВ
еЕЈдљУжЭ•иѓіпЉМTCRеЇУеПѓдї•йАЪињЗTзїЖиГЮдїЛеѓЉзЪДжОТжЦ•еПНеЇФеТМзІїж§НзЙ©жКЧеЃњдЄїзЧЕжПРдЊЫжОТжЦ•й£ОйЩ©зЪДдњ°жБѓпЉМеєґеЈ≤еЬ®иВЊгАБиВЭеТМйА†и°Аеє≤зїЖиГЮзІїж§НжЦєйЭҐињЫи°МдЇЖиѓДдЉ∞(129-132)гАВ
йЩ§дЇЖзІїж§Не§ЦпЉМTCRжµЛеЇПеЬ®зФЯзЙ©е≠¶и°®еЊБгАБзЦЊзЧЕеИЖе±ВеТМиЗ™иЇЂеЕНзЦЂжАІзЦЊзЧЕзЫСжµЛжЦєйЭҐдєЯжЬЙжљЬеЬ®зЪДеЇФзФ®гАВдЊЛе¶ВпЉМйАЪињЗеИЖжЮРTCRеЯЇеЫ†еЇУпЉМз†Фз©ґдЇЇеСШеЈ≤зїПжЈ±еЕ•дЇЖиІ£дЇЖе§ЪеПСжАІз°ђеМЦзЧЗдЄ≠зЪДз©ЇйЧіTзїЖиГЮеК®жАБпЉМз°ЃеЃЪдЇЖдє≥з≥Ьж≥їеЕЈжЬЙзЙєеЉВжАІзЪДTCRеЕЛйЪЖеЮЛпЉМеєґеЃЪдєЙдЇЖIеЮЛз≥Це∞њзЧЕдЄ≠зЪДеЕЛйЪЖеЮЛжЙ©еҐЮеТМTCRйУЊйЕНеѓє(133-135)гАВ
TзїЖиГЮеЬ®еѓєзЧЕеОЯдљУзЪДеЕНзЦЂеПНеЇФдЄ≠иµЈзЭАйЗНи¶БдљЬзФ®гАВеЫ†ж≠§пЉМTCRжµЛеЇПеѓєдЇОз†Фз©ґйАВеЇФжАІеЕНзЦЂеК®жАБгАБзЫСжµЛжДЯжЯУињЫе±Хдї•еПКеЉАеПСйТИеѓєе§ЪзІНдЄНеРМзЧЕжѓТжДЯжЯУ(еМЕжЛђSARS-CoV-2)зЪДжЦ∞еЮЛеЕНзЦЂзЦЧж≥ХеЕЈжЬЙйЗНи¶БдїЈеАЉ(136,137)гАВеЬ®еЕґдїЦеБ•еЇЈзКґеЖµдЄЛпЉМе¶ВзЉЇи°АжАІењГиДПзЧЕеТМжА•жАІеЖ†зКґеК®иДЙзїЉеРИзЧЗпЉМеПѓдї•ињЫи°МTCRи∞±з≥їеИЖжЮРдї•ињЫи°Мй£ОйЩ©еИЖе±ВеТМиѓКжЦ≠(138,139)гАВ
жАїзЪДжЭ•иѓіпЉМињЩи°®жШОTCRжµЛеЇПеТМTCRеЕНзЦЂеЇУеПѓдї•зФ®дЇОиЃЄе§ЪзФЯзЙ©е≠¶йҐЖеЯЯзЪДз†Фз©ґпЉМеєґдЄФеЬ®зФЯзЙ©еМїе≠¶йҐЖеЯЯдЄ≠еЕЈжЬЙйЭЮеЄЄеєњж≥ЫзЪДеЇФзФ®еЙНжЩѓ(еЫЊ4)гАВ
зїУиЃЇ
TCRжµЛеЇПжШѓжППињ∞еЕНзЦЂеПНеЇФзЪДеЈ•еЕЈпЉМдЇЖиІ£TCRеЇУзЪДжАІиі®пЉМеєґжЬЙеК©дЇОйЙіеЃЪTCRжКЧеОЯеѓєгАВеЕЈдљУеИ∞зЩМзЧЗпЉМTCRжµЛеЇПжЬЙеК©дЇОиВњзШ§еЉВиі®жАІеТМиВњзШ§ињЫеМЦзЪДеЯЇжЬђзЙєеЊБгАВдїОдЄіеЇКиІТеЇ¶жЭ•зЬЛпЉМTCRжµЛеЇПжЧҐжШѓTзїЖиГЮеЕНзЦЂзЦЧж≥ХзЪДеЯЇз°АпЉМдєЯжШѓиѓДдЉ∞еРДзІНеЕНзЦЂзЦЧж≥ХзЦЧжХИзЪДеЈ•еЕЈгАВж≠§е§ЦпЉМдїОжµЛеЇПжХ∞жНЃеИЖжЮРдЄ≠еЊЧеЗЇзЪДTCRеЇУжМЗж†ЗеПѓдї•дљЬдЄЇиЃЄе§ЪдЄНеРМзЩМзЧЗз±їеЮЛжВ£иАЕйҐДеРОгАБжКЧзЩМж≤їзЦЧеПНеЇФеТМеЕНзЦЂзЫЄеЕ≥жѓТжАІй£ОйЩ©зЪДйЗНи¶БйҐДжµЛжМЗж†ЗгАВ
NGSжЦєж≥ХеТМTCRжХ∞жНЃеИЖжЮРеЈ•еЕЈдЄНжЦ≠жФєињЫпЉМе±Хз§ЇеЗЇжЫіе§ІзЪДе§ДзРЖиГљеКЫеєґжЙ©е±ХдЇЖз†Фз©ґеТМдЄіеЇКеЇФзФ®гАВ
еПВиАГжЦЗзМЃ
Meredith L. Frank, Kaylene Lu, Can Erdogan, Yi Han, Jian Hu, Tao Wang, et al.T-Cell Receptor Repertoire Sequencing in the Era of¬†Cancer Immunotherapy.Clin Cancer Res¬†(2023) 29 (6): 994вАУ1008.
дїАдєИжШѓImmuHub¬ЃжКАжЬѓпЉЯ
жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄжИРзЂЛдЇО2016еєіпЉМжШѓеЫљеЖЕеЙНж≤њзЪДдЄУж≥®дЇОеЕНзЦЂеЯЇеЫ†зїДе≠¶жКАжЬѓзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВеИЫеІЛдЇЇеЫҐйШЯжЭ•иЗ™зЊОеЫљиКЭеК†еУ•е§Іе≠¶пЉМеЬ®2010еєіеЉАеІЛдљњзФ®еЕНзЦЂзїДжµЛеЇПжКАжЬѓеЉАе±ХеРДзІНзЦЊзЧЕзЫЄеЕ≥з†Фз©ґпЉМдЇО2016еєійАЪињЗиЗ™дЄїз†ФеПСпЉМеЕ®еЫљй¶ЦеЃґжО®еЗЇSeq-MRDи°Ажґ≤иВњзШ§еЊЃе∞ПжЃЛзХЩзЧЕпЉИMRDпЉЙж£АжµЛпЉМеєґжОИжЭГж≥ЫзФЯе≠РпЉИзЇ≥жЦѓиЊЊеЕЛдї£з†БпЉЪGTHпЉЙдљњзФ®гАВеРМжЧґпЉМеЕђеПЄжЛ•жЬЙImmun-TraqиВњзШ§ж≤їзЦЧдЉійЪПиѓКжЦ≠гАБImmun-Cheq |TзїЖиГЮеЕНзЦЂжµЛиѓДдї•еПКImmuHubеЕНзЦЂзїДжµЛеЇПзІСз†ФжЬНеК°дЇІеУБпЉМеєґеЄГе±АжЬЙеЯЇдЇОAIжЬЇеЩ®е≠¶дє†зЃЧж≥ХзЪДT-classifier зЦЊзЧЕжЧ©з≠ЫгАБеНХзїЖиГЮжµЛеЇПгАБTCR-TиНѓзЙ©еЉАеПСз≠Йеє≥еП∞зЃ°зЇњгАВеЕђеПЄжЮДеїЇеЗ†еНБй°єеПСжШОдЄУеИ©еТМиљѓдїґиСЧдљЬжЭГдЄЇж†ЄењГзЪДиЗ™дЄїзЯ•иѓЖдЇІжЭГдљУз≥їпЉМдЄЇеМїйЩҐдЄіеЇКгАБзФЯеСљзІСе≠¶з†Фз©ґгАБжЦ∞иНѓеЉАеПСз≠ЙжПРдЊЫиІ£еЖ≥жЦєж°ИеТМдЇІеУБгАВ

