食管癌是最常见和致命的癌症类型之一,尤其是在东亚。在组织学上,食管癌可分为两种亚型:腺癌(EAC)和鳞状细胞癌(ESCC),ESCC是主要亚型,占全球食管癌病例的90%。对ESCC中浸润性免疫细胞的系统剖析将有助于分析ESCC的免疫状态,探索创新的免疫疗法。每个T细胞表达一个独特的T细胞受体(TCR),它可以识别一个独特的同源肽中的抗原,即主要组织相容性复合体(MHC)。对TCRα和β链CDR3区域的深度测序可以监测t细胞对治疗反应的动态,TCR的克隆性和多样性显示了与广泛的肿瘤相关抗原反应的相关性。本文展示了TCR测序应用于食管癌的相关研究。

标题:Clinical and biomarker analyses of sintilimab versus chemotherapy as second-line therapy for advanced or metastatic esophageal squamous cell carcinoma: a randomized, open-label phase 2 study
辛迪利单抗与化疗作为晚期或转移性食管鳞癌二线治疗的临床和生物标志物分析:一项随机、开放的2期研究
发表期刊:nature commmunications
发表日期:2022年2月
影响因子:17.694
自2019年以来,几种PD-1抑制剂被批准为ESCC的二线治疗药物。目前,PD-1/PD-L1治疗方案中最突出的生物标志物是PD-L1的表达,但这一生物标志物在识别受益的ESCC患者方面仍不完善。辛迪利单抗是一种人源化的抗PD-1单克隆抗体,本文作者进行了ORIENT-2研究,比较辛迪利单抗与化疗作为晚期或转移性ESCC的二线治疗的有效性和安全性。
辛迪利单抗组的94名患者治疗前的外周血样本。
(1)随机分组:分为辛迪利单抗组和化疗组
(2)PD-L1的测量
(3)NLR(中性粒细胞计数/淋巴细胞计数)的测量
(4)对TCR CDR3区域和游离DNA进行二代测序,使用生信学方法进行生物标志物分析
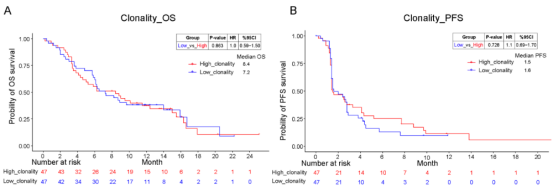
图1
注:a. 高和低TCR克隆性亚组的总生存率;b. 高和低TCR克隆性亚组的无进展生存率。
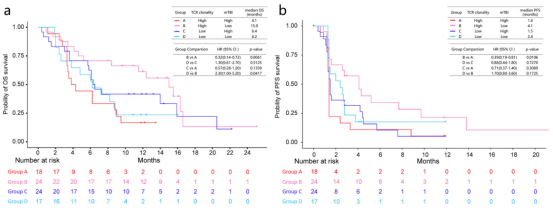
图2
注:a总的生存率;b无进展生存率。
仅凭TCR克隆性并不能有效地预测临床结果(图1)。然而,当TCR克隆性与分子肿瘤负荷指数(mTBI)结合时,对OS获益的预测能力可以增强。TCR克隆性高、mTBI低的患者中位OS和PFS最长,分别为15.0个月和4.1个月(图2)。
与化疗作为晚期或转移性ESCC患者的二线治疗相比,辛迪利单抗单药治疗明显延长了生存期,安全性良好。治疗后第6 周的 NLR <3 以及高 TCR 克隆性与低 mTBI 的组合可能是预测接受辛迪利单抗治疗的 ESCC 患者 OS 和 PFS 改善的有效生物标志物。

标题:Multi-region sequencing unveils novel actionable targets and spatial heterogeneity in esophageal squamous cell carcinoma
多区域测序揭示了食管鳞状细胞癌中新的治疗靶点和空间异质性
发表期刊:nature commmunications
发表日期:2019年11月
影响因子:12.121
基于基因组学数据选择药物已经在个性化和靶向治疗的早期研究中取得了成果,一些靶向药物已被用于ESCC,然而,只有一小部分患者从这些靶点治疗中长期获益,这提出了一个问题,是否肿瘤内异质性(ITH)或肿瘤免疫微环境,如肿瘤浸润淋巴细胞和T细胞受体(TCR)是造成差异的原因。因此,有必要在决策前识别新的目标并评估目标的空间异质性。
39例食管鳞状细胞癌患者的多区域肿瘤组织、正常组织和血液样本。
(1)样本选择和DNA提取
(2)全外显子组测序
(3)对其中10例患者的样本进行TCR测序
(4)生信学分析和统计分析
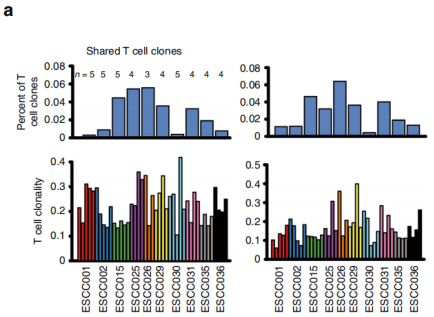
图1
注:所有原发肿瘤区域中共享TCR的百分比(上面板)和每个原发肿瘤区域中的T细胞克隆性(下面板)。左面板是TRA的统计数据,右面板是TRB的数据。
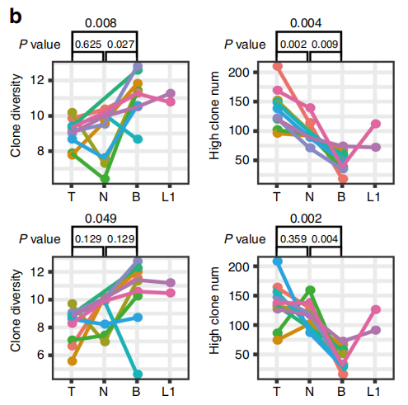
图2
注:整体克隆多样性(香农指数,左面板)和高频率克隆数(freq.>0.01%右面板)。TRA(上面板)TRB(下面板)。T原发肿瘤样本,N正常样本,B外周血样本,L淋巴结转移。
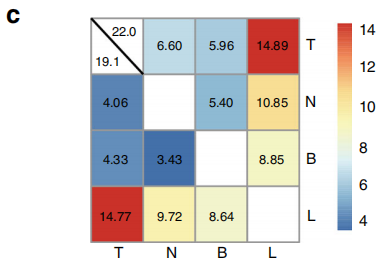
图3
注:由热图显示的任意两种类型的样本之间的中位数重叠率。热图中的颜色表示Jaccard指数的值(范围:0-100)。左下角为TRA结果,右上角为TRB结果。
在患者体内,观察到整体TCR库的变化,包括T细胞克隆性、高频克隆和V-J基因配对多样性。在原发性肿瘤样本中共享的T细胞克隆很少,并且在不同患者中显示出很大的多样性(图1)。
与正常组织和肿瘤组织相比,血液中的TCR多样性更高,而正常组织和肿瘤组织之间没有差异。与血液和正常组织中相比,原发性肿瘤中TRA和TRB的高频克隆(>0.1%)数量更高(图2),这可能是由于新抗原的出现。
利用Jaccard指数来量化正常、肿瘤组织和淋巴结转移之间T细胞库的相似性和重叠性(图3)。发现原发肿瘤样本之间的关系最密切,其次是原发肿瘤和淋巴转移之间的关系。
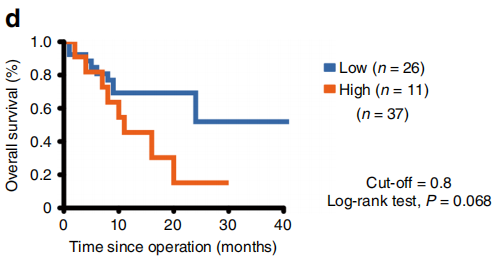
图4
注:Kaplan-Meier生存曲线显示具有明显新抗原异质性的ESCC的生存结果。
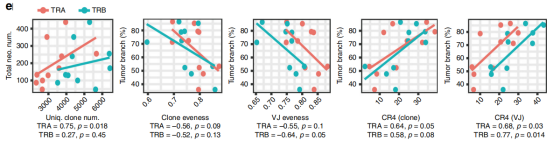
图5
注:T细胞库与分支新抗原的相关性。原发肿瘤中独特克隆数的中位数与总新抗原数之间的Spearman相关性(左);原发肿瘤中的预测分支新抗原的百分比与克隆均匀度、V-J配对的均匀度、克隆的CR4和V-J基因配对的CR4之间的Spearman相关性。
为了确定与TCR多样性相关的潜在生物学和临床相关性,作者分析了临床信息和新抗原,特别是更有可能影响TCR库异质性的分支新抗原。分支新抗原的高比例与较短的总生存率相关,具有边际意义,这可能是由于样本量不足(图4)。
新抗原总数与TRA的独特克隆数相关;分支新抗原的百分比与克隆的均匀度和V-J对的均匀度呈负相关;分支新抗原与高频率克隆或V-J配对之间存在正相关关系(图5)。
这些发现表明,分支新抗原可能与TCR的整体多样性有关,一些扩增的TCR克隆可能对肿瘤细胞多样性的增加有反应。
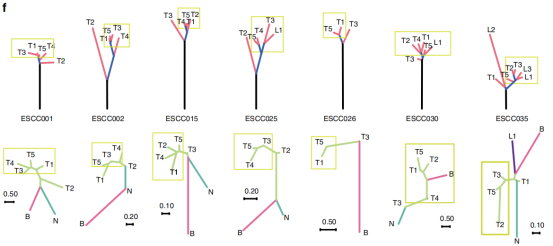
图6
注:7例患者的TCR树和基因树的比较。上面板为基因树,树干、分支和共享分支分别用黑色、蓝色和红色表示;下面板为TCR树,树按组织类型着色(湖蓝:正常;绿色:区域肿瘤;粉红色:血液;紫色:转移淋巴结)。黄色矩形突出了来自同一分支的区域肿瘤,它们在TCR树中具有更多的相似性。
作者进一步比较了TCR树和基因树的区域肿瘤拓扑结构。在其中七例患者中,与其他进化枝相比,属于基因树同一分支的区域肿瘤在TCR树中往往具有更多的相似性(图6)。这些结果表明,ESCC中TCR库的ITH在很大程度上是由不同肿瘤区域的遗传异质性驱动的。
多区域采样对于未来的驱动基因鉴定和生物标志物预测是必要的。高比例的分支新抗原与总体短生存期有关。在原发性肿瘤内,空间TCR库的关系在一定程度上与基因组肿瘤内异质性(ITH)相关,这表明来源于基因组进化的ITH可能通过影响肿瘤免疫微环境的变化而在ESCC中具有临床相关性。

标题:Time-spatial analysis of T cell receptor repertoire in esophageal squamous cell carcinoma patients treated with combined radiotherapy and PD-1 blockade
放疗和PD-1抑制剂联合治疗食管鳞状细胞癌患者T细胞受体库的时空分析
发表期刊:Oncoimmunology
发表日期:2022年1月
影响因子:7.723
PD-1抑制剂在晚期/转移性食管鳞状细胞癌(ESCC)中显示出了良好的应用前景。然而,只有少数ESCC患者对PD-1抑制剂单独治疗有客观反应。为了改善患者选择的临床结果,迫切需要识别抗pd-1治疗的有效生物标志物。鉴于检查点封锁和TMB诱导的新抗原有助于T细胞的抗肿瘤免疫反应性,T细胞图谱越来越被认为对免疫治疗具有很大的预测和预后价值。作者之前有进行过相关临床试验,显示放疗联合卡瑞珠单抗对局部晚期ESCC具有抗肿瘤疗效,毒性可控。
19例ESCC患者肿瘤活检组织和外周血CD8+T细胞
(1)研究设计和样本采集
(2)外周血CD8+T细胞的纯化
(3)组织处理和DNA提取
(4)全外显子组测序
(5)二代测序分析肿瘤突变负荷(TMB)
(6)对TCR β链CDR3区测序,在治疗前和治疗4周时
(7)新抗原预测
(8)测序数据分析和多重免疫荧光分析
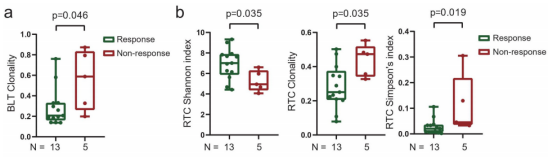
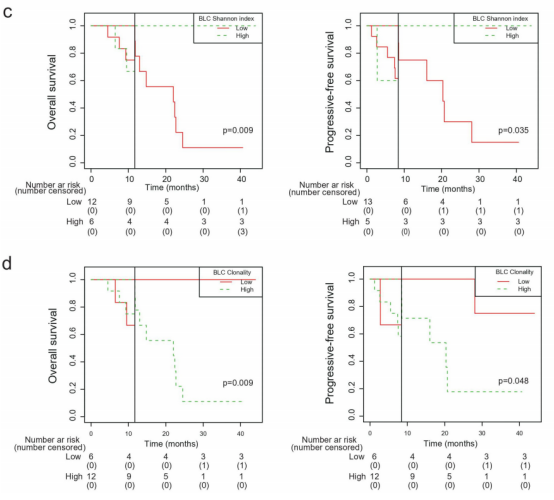
图1
注:TCR多样性与放疗联合坎雷珠单抗治疗结果相关。(a)应答性患者在基线肿瘤中的克隆性较低。(b)应答性患者在治疗期间,外周血CD8+ T细胞的香农指数较高,克隆性较低,辛普森指数较低。基线外周血CD8+ T细胞的香农指数(c)和克隆性(d)与OS、PFS的关系。BLT:基线肿瘤组织。RTC:40gy放疗和2轮卡姆雷珠单抗后的外周CD8+T细胞。BLC:基线外周血CD8+T细胞。
与无反应性(疾病稳定或进展)患者相比,客观反应性(部分反应或完全反应)患者的基线肿瘤内克隆性更低(图1a)。与无应答患者相比,应答患者的治疗后外周CD8+ T细胞的TCR多样性显著更高(Shannon指数增加,克隆性和Simpson指数降低)(图1b)。
没有发现基线肿瘤、治疗时肿瘤或治疗时的外周血CD8+T细胞的TCR多样性与患者生存相关。然而,landmark分析显示,基线外周血CD8+T细胞中TCR多样性高的患者有更好的OS和PFS(图1c),相反,基线外周血CD8+ T细胞的高克隆性与更差的OS和PFS有关(图1d)。
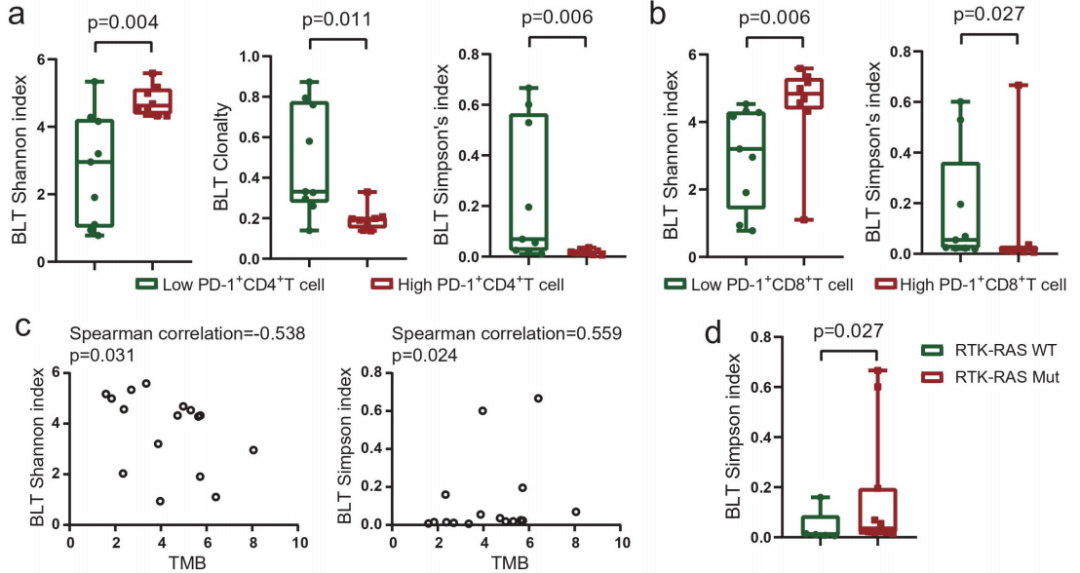
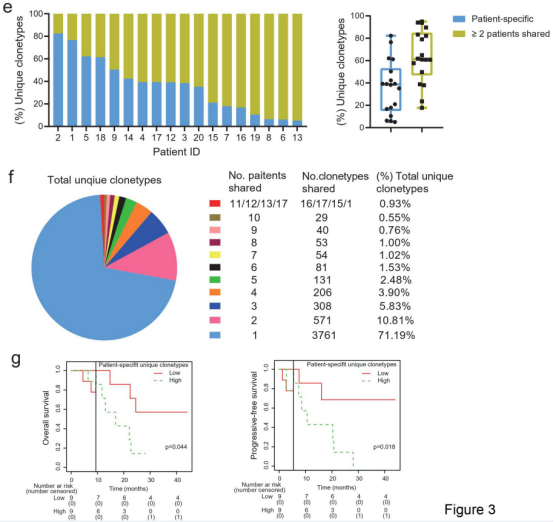
图2
注:基线肿瘤组织中的TCR库与肿瘤微环境相关。(a)基线肿瘤中PD-1+CD4+TILs较高的患者具有较高的香农指数,克隆性较低,辛普森指数较低。(b)基线肿瘤中PD-1+CD8+TILs较高的患者香农指数较高,辛普森指数较低。(c)TCR多样性与肿瘤突变负荷之间的相关性。(d)RTK-RAS通路突变的患者在基线肿瘤中有较高的辛普森指数。(e)个体患者的患者特异型克隆和共享克隆型。(f)患者之间共享的独特t细胞克隆型。(g)对基线肿瘤中患者特异性独特克隆型患者的总生存期和无进展生存期的landmark分析。
基线肿瘤中PD-1+CD4+TILs高的患者TCR多样性高,克隆性低(图2a)。同样,基线肿瘤中PD-1+CD8+TILs高的患者也有更高的TCR多样性和较低的克隆性(图2b)。
TCR多样性与TMB的相关性较弱(图2c),这可能是由于样本有限所致。RTK-RAS通路突变多的患者具有更高的TCR克隆性(Simpson指数增加)(图2d)。
将基线肿瘤中确定的独特TCR克隆型分为两类。第一类包括“患者特异性”克隆型,它们只在个体患者中检测到,不与其他患者共享。第二类包括在不少于2名患者的基线肿瘤中发现的共享克隆型。共享克隆型的中位数百分比高于“患者特异性”克隆型(61.35% vs 38.65%,图2e)。
在这些基线肿瘤样本中的5283个独特克隆型中,“患者特异性”克隆型是那些共享克隆型的2.8倍(71.19% vs. 18.81%),TCR克隆型的数量随着共享患者数量的增加而急剧减少(图2f)。
landmark分析显示在基线肿瘤中高“患者特异性”克隆型的患者OS和PFS都更短(图2g)。
这些结果表明基线肿瘤内TCR多样性与免疫环境和异质性相关。
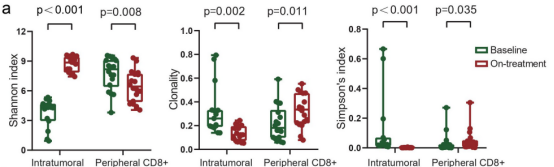
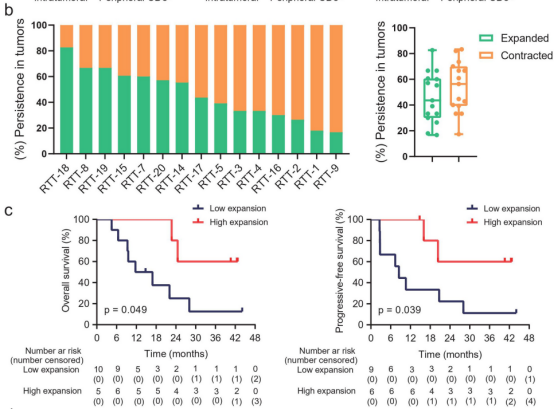
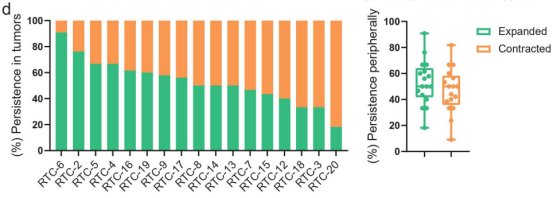
图3
注:放疗加卡瑞珠单抗重塑TCR多样性。(a)联合治疗过程中香农指数、克隆性和辛普森指数的变化。(b)在基线时确定的瘤内克隆型在治疗期间的肿瘤中扩大或收缩。(c)持续克隆型在治疗期间的瘤内扩增与患者生存相关。(d)在治疗期间,基线时发现的瘤内克隆型在外周CD8+T细胞中扩大或收缩。RTT:40 Gy放疗和2轮卡曲瑞单抗后的瘤内T细胞。RTC:40 Gy放疗和2轮卡姆雷珠单抗后的外周CD8+T细胞。
首先比较了15例患者匹配的治疗前和治疗中肿瘤的TCR库。与基线时相比,治疗期间瘤内TCR多样性显著增加;相反,肿瘤内克隆性在治疗期间显著降低。与肿瘤中TCR库的变化相反,治疗期间外周CD8+TCR的多样性减少(图3a)。所有19例患者在联合治疗后的淋巴细胞计数与基线时相比凋亡。
在治疗前和治疗期间,肿瘤中持续存在的克隆型不到0.1%。由于治疗时的TCR丰富度只在所有肿瘤中增加,因此根据治疗时肿瘤中比基线肿瘤更高(扩大)或更低(收缩)的频率,将这些持续克隆型分为扩大型或收缩型。在治疗期间,中位数为46%(范围从17%至83%)的持续t细胞克隆在肿瘤中扩增(图3b)。
在治疗期间的肿瘤中,这些持续克隆扩增的较高比例与较长的OS和PFS相关(图3c)。
作者还评估了中位数为19个(范围从3到65)t细胞克隆型,这些在基线肿瘤中确定的克隆型在治疗期间持续存在于外周血中,这些克隆的50%(范围从18%至91%)在外周血中扩增(图3d)。
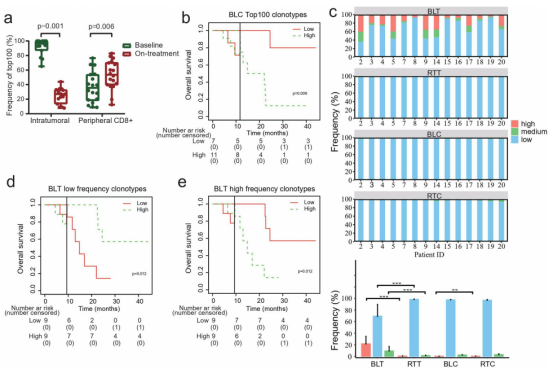
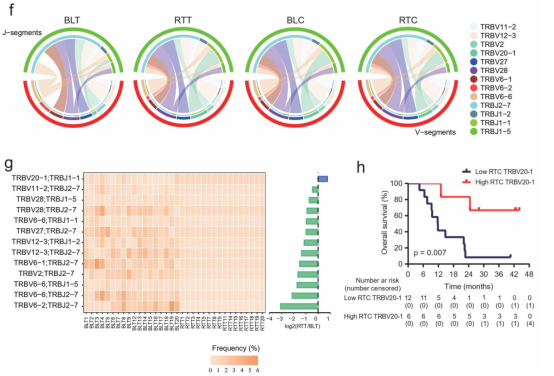
图4
注:联合治疗期间的克隆型再分配。(a)治疗前和治疗期间肿瘤或外周血CD8+T细胞中TOP100克隆型的总频率。(b)基线外周血CD8+T细胞TOP100克隆频率患者总生存期的landmark分析。(c)治疗期间不同克隆型的频率。上四张图显示了每个患者在治疗前和治疗期间的肿瘤或外周CD8+T细胞中高频、中频和低频克隆型的比例。(d和e)对基线肿瘤中低频克隆型(d)和高频克隆型(e)患者的总生存期进行landmark分析。(f)在治疗前和治疗期间,肿瘤或外周CD8+T细胞中TCRβ(TRB)的V/J基因使用谱。在所有肿瘤和外周CD8+T细胞样本中发现的V-J对均被纳入分析。(g)每个患者在治疗前和治疗期间的肿瘤中TRB的V/J基因谱的频率。在所有肿瘤中发现的V-J对都被纳入了分析。(h)Kaplan-Meier估计了治疗期间TRBV20-1患者的总生存期。
在治疗期间,肿瘤内TOP100克隆的总频率降低,而外周血CD8+T细胞的TOP100总频率增加(图4a)。
基线外周血CD8+T细胞中TOP100克隆频率较低的患者的OS更长(图4b)。
然后,作者将t细胞克隆分为高频克隆(克隆频率≥0.1%)、中频克隆(0.01%至0.1%)和低频克隆(≤0.01%),与基线肿瘤相比,在治疗期间,所有肿瘤高频、中频克隆的比例下降,而低频克隆的比例增加;在治疗过程中,外周血CD8+T细胞的高频比例增加(图4c)。
基线肿瘤内低频克隆较高的患者有更好的OS(图4d)。然而,基线肿瘤内高频克隆高的患者OS更差(图4e)。
作者还分析了TRB在治疗前和治疗期间的V-J基因使用谱。TRBV6-1/TRBJ2-7对在基线肿瘤内T细胞中最常见,但其频率下降,而TRBV20-1/TRBJ2-7对在治疗过程中的频率最高(图4f)。
在基线肿瘤中发现的V-J配对片段中,TRBV20-1/TRBJ1-1对是唯一一个在治疗期间频率增加的片段(图4g)。在治疗期间的外周血CD8+ T细胞中,TRBV20-1水平较高的患者的OS更好(图4h)。
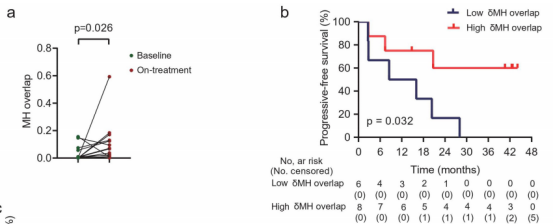
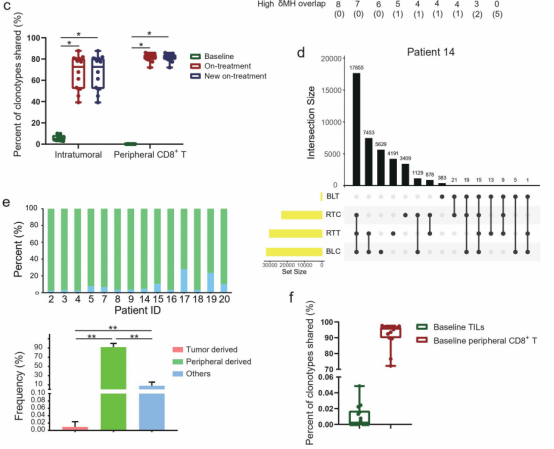
图5
注:肿瘤和外周血之间的T细胞克隆的相互流入。(a)肿瘤与外周CD8+T细胞(MH)重叠指数。(b)MH重叠指数的增加与PFS相关。(c)在基线和治疗期间肿瘤和外周CD8+T细胞之间的克隆型。治疗中新的TCR克隆型:在治疗过程中首次在肿瘤和外周CD8+T细胞之间共享。(d)具有代表性的颠覆维恩图,以评估基线和治疗期间肿瘤和外周CD8+T细胞中独特的TCR克隆型。每一行,在单个测试样本中具有独特的克隆型。样本之间的每个列、交集集(共享克隆型)或异常集(特殊克隆型)。(e)在治疗过程中,新的共享克隆型的不同衍生。(f)基线样本中新的共享克隆型。
使用Morisita-Horn(MH)重叠技术来评估肿瘤组织和外周CD8+T细胞之间共享的T细胞克隆。14例患者纳入分析。86%(12/14)患者治疗期间的MH重叠部分升高(图5a)。更高的MH双重重叠(治疗时MH重叠-基线MH重叠)预示着PFS的改善(图5b)。这些结果表明了局部肿瘤和系统血液之间的迁移。
作者随后重点研究了治疗期间肿瘤和外周CD8+T细胞之间新共享的T细胞克隆型,即在基线时这两个区域之间不共享的T细胞克隆型。在治疗期间,肿瘤内和外周CD8+T细胞中,新的共享克隆型分别占总克隆型的72.63%和81.88%(图5c)。
根据这些新的共享克隆型的基线位置,将它们分为在基线肿瘤中也检测到的肿瘤来源、在基线外周CD8+T细胞中也检测到的外周来源、以及基线时在两个区域中均未检测到的其他(图5d)。
在所有新的共享克隆型中,超过90%是外周来源的,少数肿瘤来源的,其他来源在本研究中不太清楚(图5e)。
7例(7/14,50%)患者与他们的基线肿瘤共享了新的共享克隆型(图5f),占这些患者中新的共享克隆型的0.015%。与基线肿瘤和基线外周CD8+T细胞共享的新共享克隆型的中位比例分别为0.002%和95.78%(图5f)。
这些结果表明,在联合治疗下,肿瘤和外周血之间的t细胞克隆相互流入。
放疗与卡瑞珠单抗联合治疗极大地促进了肿瘤内TCR的多样性以及肿瘤与外周血T细胞的相互流入。基线肿瘤内TCR库与肿瘤免疫微环境密切相关,并且在患者之间具有异质性。基线外周血CD8+T细胞的高度多样性增加,肿瘤与外周血CD8+T细胞之间的治疗中MH重叠以及持续性肿瘤内T细胞克隆的扩增是预测治疗结果的生物标志物候选者。

标题:Clonal Expansion of Tumor-Infiltrating T Cells and Analysis of the Tumor Microenvironment within Esophageal Squamous Cell Carcinoma Relapsed after Definitive Chemoradiation Therapy
肿瘤浸润性T细胞的克隆扩增及食管鳞状细胞癌在确定性放化疗后复发的肿瘤微环境分析
发表期刊:International Journal of Molecular Sciences
发表日期:2021年1月
影响因子:6.208
一些研究已经报道了确定性放化疗(CRT)与单纯手术的类似预后。然而,并不是所有的ESCC患者都接受确定性的CRT作为一线治疗,原因之一是,局部复发可能需要挽救性食管切除术,这可能有严重的并发症。因此,有必要使用由可靠的预测或预后标志物确定的最佳医疗手段来进行治疗。本研究检测了CRT后复发的ESCC中肿瘤浸润淋巴细胞(TILs)和肿瘤微环境(TMEs)的克隆性,以探索预后标志物。
入组了7例ESCC患者,以13例口腔鳞状细胞癌(OSCC)和18例健康志愿者作为对照组,取ESCC和OSCC的肿瘤组织样本和健康志愿者的外周血样本。
(1)收集患者和入组。在7例ESCC患者中,2例仅接受手术治疗,其他患者主要采用确定性CRT治疗,然后进行挽救性食管切除术。OSCC患者仅通过手术治疗。
(2)从肿瘤组织和外周血中提取RNA
(3)TCR测序和分析
(4)cDNA合成和定量聚合酶链反应
(5)多样性指标计算和统计学分析
图1
注:TRA和TRB库的典型结果,分别是仅通过手术治疗的ESCC(A)和确定性放化疗(CRT)后复发的ESCC(B)。三维图形 x 轴表示J 片段的使用,y 轴表示V片段的使用, z 轴上显示每个克隆的频率(百分比)。
在确定性放化疗后复发的ESCC中观察到的寡克隆扩增更多(B),而不是单独通过手术治疗的ESCC(A)。
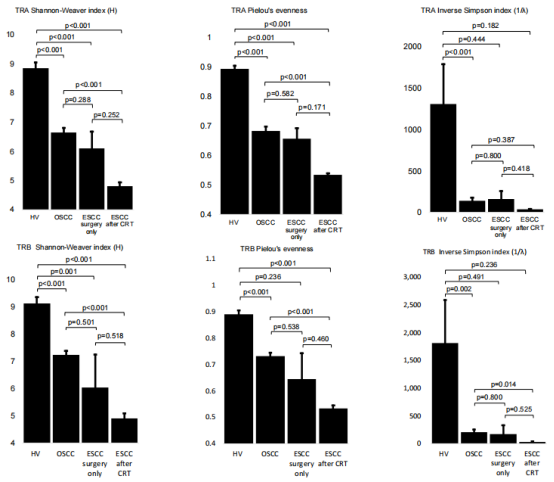
图2
注:健康志愿者(HV)、单纯手术治疗的OSCC患者和伴或不伴CRT治疗的ESCC患者的t细胞受体(TCR)多样性指数。
用香农-韦弗指数H、逆辛普森指数(1/λ)和Pielou的均匀度来表达TCR序列的多样性和均匀度。
健康志愿者TCR库的多样性和均匀度高于OSCC患者、单独手术治疗的ESCC患者、确定性CRT治疗后复发的ESCC患者。
单独手术治疗的OSCC和ESCC患者之间未观察到统计学上的显著差异,两组各多样性指数的平均值相似。
OSCC组和确定性CRT后复发的ESCC患者统计学上存在显著差异,但TRA 的逆辛普森指数除外(p = 0.387)。
单独手术治疗的ESCC组和确定性CRT后复发的ESCC组之间的差异无统计学意义,尽管单独手术组的平均多样性指数始终高于确定性CRT后复发的ESCC组。这可能是由于仅通过手术治疗的ESCC患者数量有限。(图2)
肿瘤浸润性T淋巴细胞的克隆扩增在ESCC和OSCC肿瘤组织中显著诱导,并且主要在确定性CRT后复发的ESCC中诱导。
图3
注:TRA和TRB库在ESCCs中的典型结果。
TIL TCR库的差异在确定性CRT后复发的ESCC挽救手术后预后良好或较差的患者之间没有显著差异(TRA的香农-韦弗指数H的p = 0.765,逆辛普森指数的p = 0.525,Pielou均匀性p = 0.958,TRB的香农-韦弗指数H的p = 0.599,辛普森逆的p = 0.631,Pielou均匀性p = 0.668)。
在确定性CRT后诱导了TIL的克隆扩增;此外,通过定量PCR分析得出PD-L1 mRNA与CD8 mRNA的比值可作为确定性CRT后局部复发后挽救手术的预后标志物候选。

标题:Immune suppressive landscape in the human esophageal squamous cell carcinoma microenvironment
食管鳞状细胞癌微环境中的免疫抑制景观
发表期刊:nature commmunications
发表日期:2020年11月
影响因子:14.919
对ESCC中浸润性免疫细胞的系统了解将有助于分析ESCC的免疫状态,评估当前检查点封锁的应用,最重要的是,导致创新的免疫疗法。肿瘤中免疫细胞的单细胞转录组分析提供了一种在高度复杂的肿瘤微环境中全面研究这些细胞的方法。
7例ESCC患者手术切除的肿瘤组织和邻近食管组织
(1)样品采集和制备
(2)用于10×基因组学单细胞5′ 和VDJ测序的RNA-Seq文库制备
(3)scRNA-seq 数据分析
(4)TCR数据分析
(5)流式细胞术分析
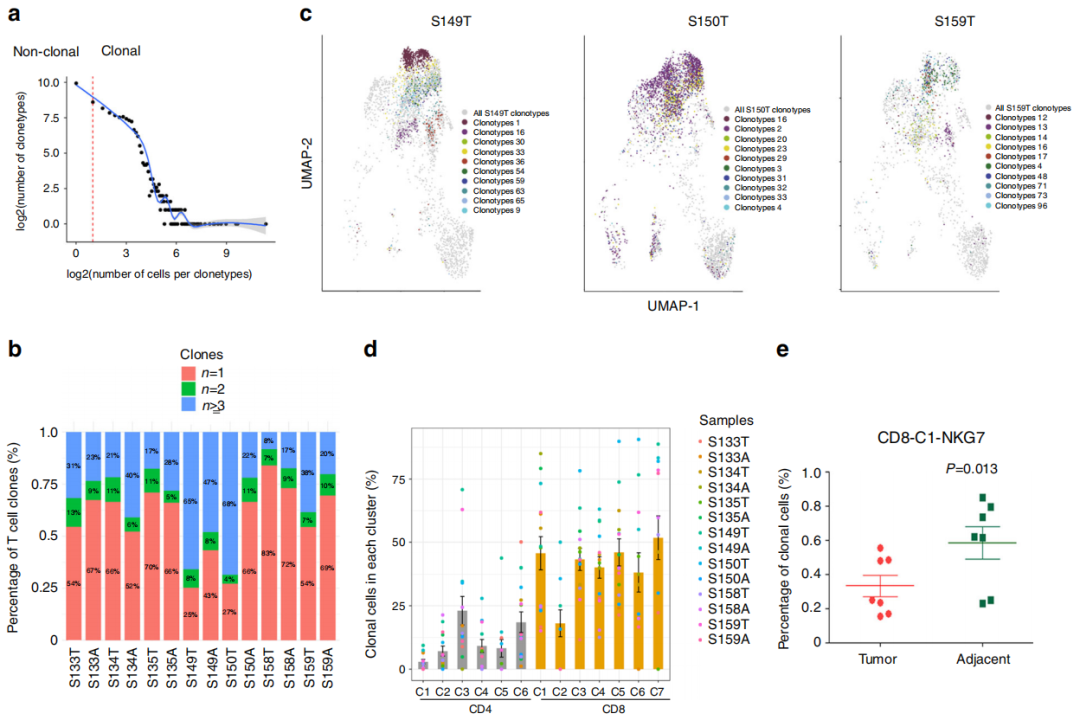
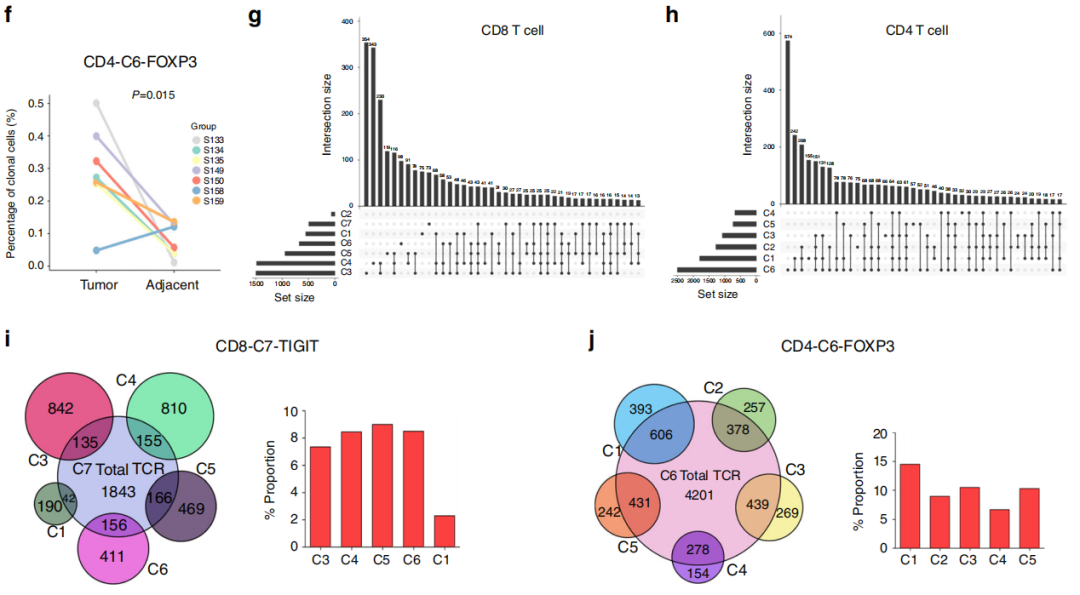
图1
注:CD4和CD8 T细胞的克隆性。(a)T细胞克隆型的数量与每个克隆型的细胞数量之间的关系。虚线分离非克隆细胞和克隆细胞;实线显示了两个轴之间的相关性。(b)不同样本中T细胞的TCR分布。A,邻近组织;T,肿瘤。(c)通过TCR测序确定的每个肿瘤(灰色)中显著性克隆型(颜色前10位)的代表性例子。(d)条形图显示每个聚类中所有14个样本中克隆T细胞的平均分数,点的颜色代表不同的样本。e,f.来自肿瘤和邻近组织的CD8-C1-NKG7( e)和CD4-C6- FOXP3(f)中克隆细胞的百分比(n = 7)。g,h.在CD4 T细胞(g)和CD8 T细胞(h
)中,在不同簇之间共享TCR克隆类型。连接这些点的线表示共享TCR克隆类型的集群,条形图显示共享的TCR克隆类型编号,而点只表示唯一的克隆类型。(i)肿瘤中CD8-C7-TIGIT和其他CD8簇之间共享TCR的数量(左图)和百分比(右图)。(j)肿瘤中CD4-C6-FOXP3和其他CD4簇之间共享TCR的数量(左图)和百分比(右图)。
共观察到15,654个独特的TCR序列,观察到克隆扩增,克隆大小从2到2600(图1a)。患者之间没有发现共享克隆。
然而,TCR克隆型组成在患者中差异很大。一些患者表现出少量的克隆扩增(S134、S135和S158),另一些患者则主要是少数T细胞克隆主导(S149和S150)。S149和S150肿瘤显示65%和68%的T细胞具有两个以上细胞共享的TCR,表明T细胞在这些肿瘤中高克隆扩增。与匹配的相邻组织相比,7个患者的肿瘤中有4个肿瘤中扩增的克隆数量增加(图1b)。
每个聚类实际上都是由不同的克隆型组合子集组成的(图1c)。一般而言,CD8 T细胞的克隆细胞明显多于CD4 T细胞(图1d)。
CD8-C1- NKG7是CD8 T细胞中的细胞毒性簇,在邻近组织中出现的频率更高,在邻近组织中也比在肿瘤组织中克隆扩增增加(图1e)。
然而,与匹配的邻近组织相比,肿瘤中的treg细胞的克隆数量有所增加(图1f),这表明特异性克隆细胞的扩增可能是肿瘤中treg比例较高的原因。虽然大多数细胞含有独特的TCR,但在不同的簇中观察到不同程度的克隆扩增。
CD4细胞内的所有簇,包括treg,以及CD8细胞内除C2外的所有簇之间都存在TCR序列的共享(图1g,h)。
CD8-C7-TIGIT与CD8-C5- CCL5和CD8-C6-STMN1之间共享的克隆数分别为166个(9.0%)和156个(8.4%)(图4i)。Treg簇CD4-C6-FOXP3在肿瘤中也有相同的趋势,与CD4-C1-CCR7共享克隆型占14.4%,(图1j)。
数据表明不同簇的T细胞不是完全独立的,但可能经历广泛的状态转变。
本研究结合了深层sc-RNA-seq和TCR-seq,并展示了整个免疫景观,包括ESCC和邻近组织中的先天性和适应性免疫细胞图谱。对ESCC和邻近组织的免疫细胞的转录图谱为理解免疫状态提供了一个框架,并揭示了ESCC环境中免疫细胞的动态性质。此外,从多个方面说明了ESCC的免疫抑制状态,所有这些都是开发ESCC和其他癌症免疫疗法的潜在新靶点。
END
ImmuHub®技术平台是基于第二代高通量基因测序(NGS)平台利用5’RACE或多重PCR技术,使我们能直接从基因组RNA或DNA来扩增TCR/BCR的全长序列或CDR3区序列,从而进行高通量测序和数据分析。是艾沐蒽开发的一套灵活度极高的TCR/BCR二代测序平台。
ImmuHub®提供了真正捕获免疫系统所需要的深度和广度。TCR/BCR作为T/B细胞克隆的一个独特性标记,能够随着时间的变化来跟踪T细胞和B细胞,表征免疫系统的多样性,并评估反应疾病和治疗的动态情况,如免疫组测序提供的一个有价值的指标是克隆性,这是一种检测受体序列在群体中分别均匀程度的方法,可以量化免疫系统对一组特定抗原的集中程度。

什么是ImmuHub®技术?
杭州艾沐蒽生物科技有限公司成立于2016年,是国内前沿的专注于免疫基因组学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出Seq-MRD®血液肿瘤微小残留病(MRD)检测,并授权泛生子(纳斯达克代码:GTH)使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier® 疾病早筛、单细胞测序、TCR-T药物开发等平台管线。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。

