
题目:在新辅助治疗的NeoALTTO和CALGB 40601随机试验中,免疫学和临床病理学特征可以预测her2阳性乳腺癌的预后 发表期刊:Nature Communications 发表时间:2023年11月 影响因子:16.6 在接受新辅助治疗的患者中识别预后标志物对于HER2阳性乳腺癌的治疗优化至关重要,而免疫微环境是一个关键因素。在该回顾性研究中,作者通过对BCR和TCR库的表征进一步剖析了HER 2阳性乳腺癌的异质性,探索了BCR、TCR库多样性对治疗反应和预后的影响。另外作者整合了免疫学和临床病理学特征以及治疗反应,建立一个预后模型,可以实现准确的预后分层,为实施优化的新辅助/术后治疗策略开辟道路。 从NeoALTTO和CALGB 40601两个临床试验的RNA-seq数据中鉴定BCR和TCR克隆型。通过多样性指数(Gini指数,Gini-Simpson指数和均匀度evenness指数)、top1克隆、second克隆的占比、CDR3核苷酸长度等指标来描述BCR/TCR库的特征。 作者探索了BCR和TCR库特征与激素受体状态、PAM 50亚型、TIL水平的关联。 如图1a所示,与HR+肿瘤相比,HR-肿瘤具有显著更高的BCR读数和克隆数,表明更高水平的B细胞浸润与HR-肿瘤的更高免疫原性相一致。 在PAM 50亚型之间,BCR库更具有异质性,多样性指数、TOP1和second克隆的比例分布等均不同(图1b),而TCR库更均匀些。总体而言,与LumA、normal-like样本相比,HER2-E、basal-like和LumB样本显示出与B细胞介导的免疫应答和克隆扩增激活相一致的特征。 TIL水平以肿瘤内基质面积的%评分定义。BCR和TCR的标准化读数、克隆数、以及BCR基尼指数与TIL水平呈中等正相关,BCR均匀度、TCR TOP1和second克隆频率与TIL水平呈负相关。由于TIL水平和BCR/TCR多样性测量之间的相关性是中等的,因此由TIL定量和BCR/TCR表征带来的信息可以是互补的。与TIL定量相比,多样性测量可能提供免疫应答方面的“定性”信息。
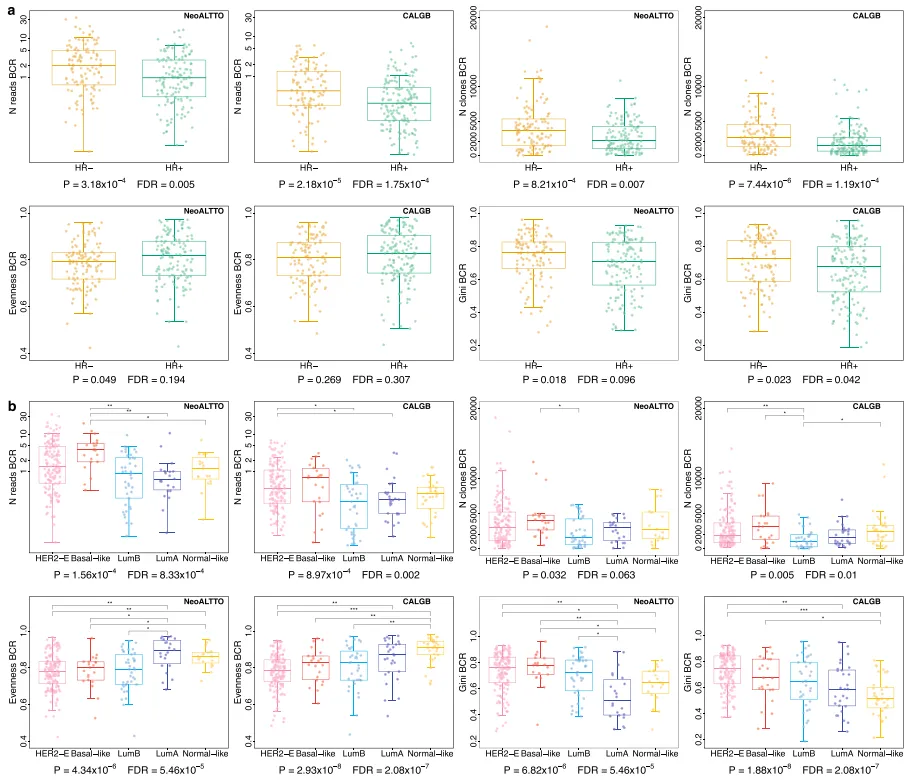
图1
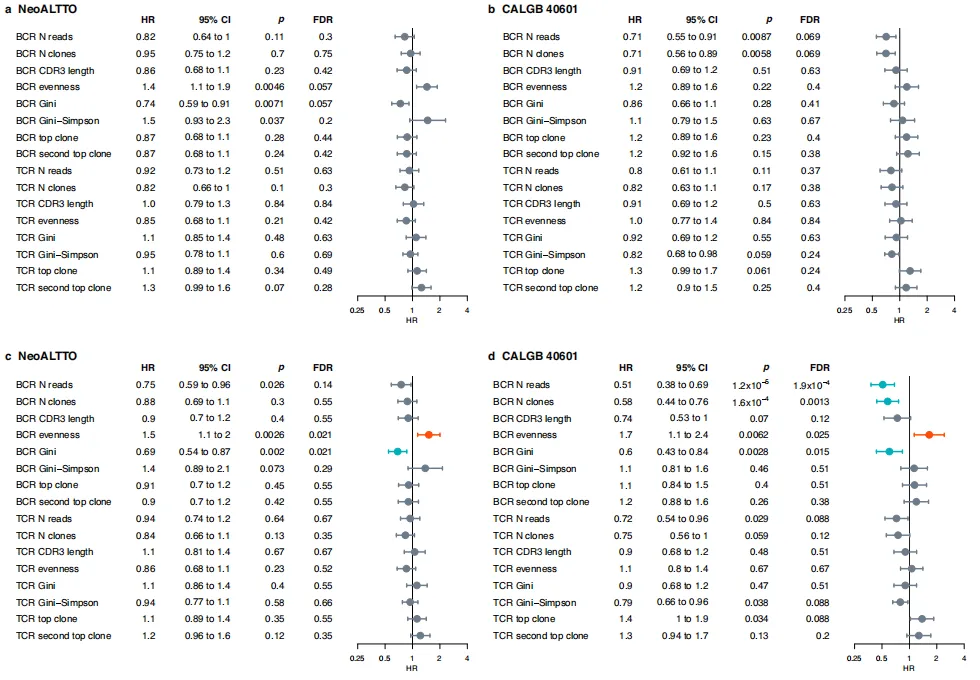
图2
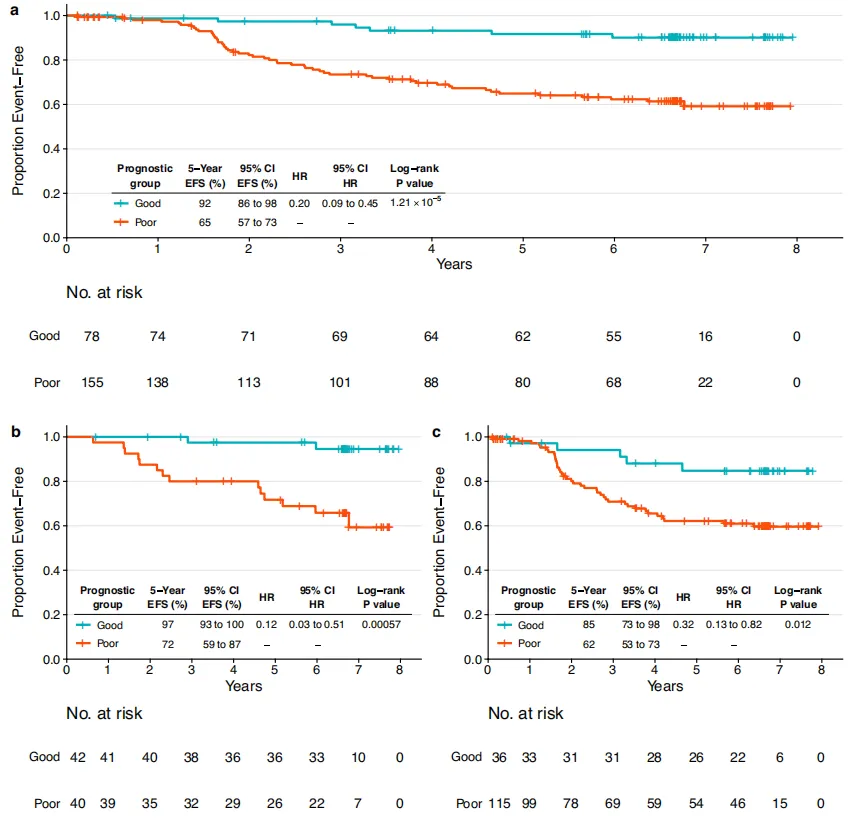
图3
然后在CALGB 40601组中对模型进行验证。预后良好组和预后不良组的5年EFS率分别为93%和75%(图4a)。pCR组的差异无显著统计学意义,但观察到与训练集相似的趋势(图4b)。在未实现乳腺pCR的患者中鉴定出具有不同预后的组(图4c),这与训练集中的发现一致。 当比较预后良好组pCR患者和未pCR患者的EFS时,在训练集和验证集中均未发现显著差异,TIL、BCR均匀性、淋巴结状态和雌激素受体状态等类似的变量也是如此。总之,综合临床病理特征、治疗反应信息和免疫学特征的多模式方法对于预测患者的预后非常重要。
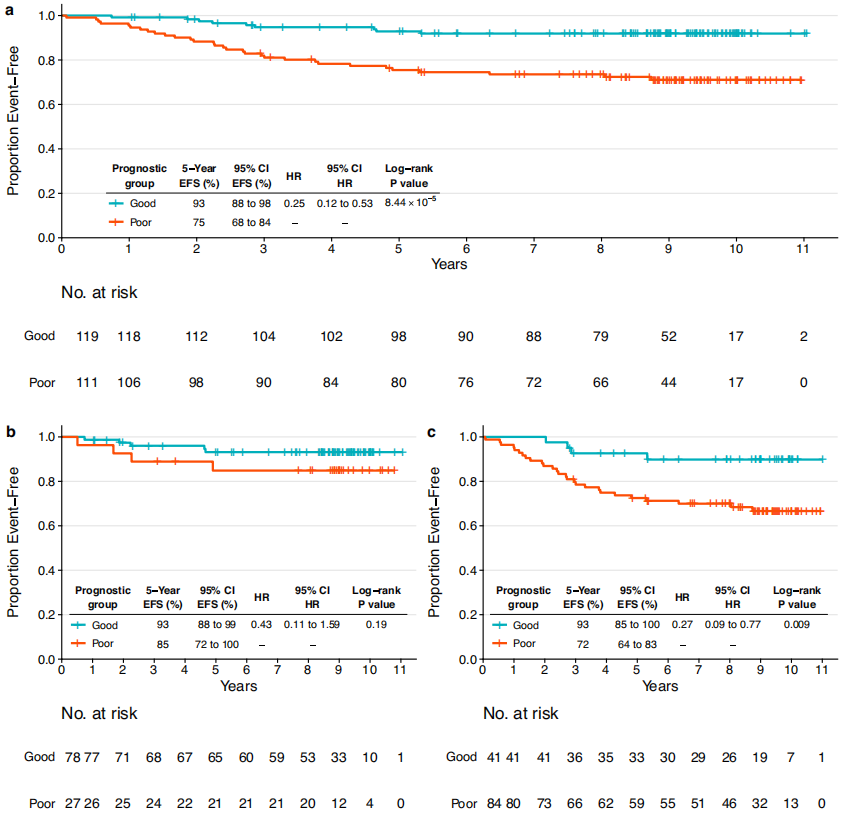
图4
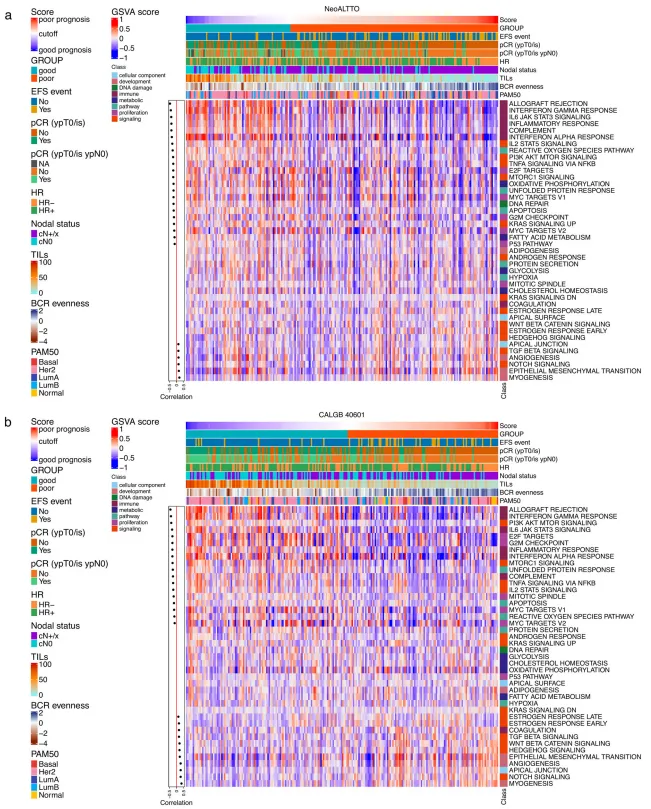
图5
预后良好的pCR和残留病(RD)组均呈现明显的免疫特征富集。预后不良的样本,特别是那些患有RD的样本,反而呈现出较低的免疫相关信号。此外,无论预后如何,达到pCR的肿瘤显示出更高的ERBB2和更低的ESR1表达水平,并且PIK3CA通路激活特征在具有pCR和良好预后的肿瘤中更高。 这些发现表明,根据模型,在属于同一预后组的肿瘤中,肿瘤的内在生物学特性似乎是新辅助治疗反应的主要驱动因素,这可以用pCR来衡量。相比之下,免疫相关特征主要与预后相关,与pCR状态无关。
研究结论:该研究证明了HER2阳性乳腺癌中BCR库测量和免疫反应的异质性,以及BCR多样性作为预后生物标志物的潜力。构建的预后模型鉴别出了一组具有免疫特征富集的肿瘤患者,这些患者即使存在残留病也可能符合降级治疗的条件。并强调了整合临床病理特征、治疗反应信息和免疫相关特征以确定新辅助治疗临床风险的重要性。
杭州艾沐蒽生物科技有限公司成立于2016年,是国际前沿的专注于免疫驱动医学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组基因高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子(纳斯达克代码:GTH)使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®肿瘤早筛、单细胞测序、TCR-T和抗体发现等平台管线。目前为止发表了数十篇论文,其中包括:Nature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24), Nature Communications (IF:17)等多篇高分杂志。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。END
