急性T细胞淋巴细胞白血病(T-ALL)是一类侵袭性儿童血液系统恶性肿瘤。因其独特的生物遗传学特征和复杂的分子学发病机制,T-ALL治疗靶点少,相比儿童急性B细胞淋巴细胞白血病总体疗效较差,复发T-ALL的耐药机制挖掘仍是领域内研究的重点和难点。
2023年10月6日,中国医学科学院血液病医院(中国医学科学院血液学研究所)竺晓凡、张英驰及章婧嫽共同通讯在Blood(IF=20)在线发表题为“Clonal Evolution Dissection Reveals High MSI2 Level Promotes Chemo-resistance in T-cell Acute Lymphoblastic Leukemia ”的研究论文,此研究利用单细胞多组学技术解析了儿童T-ALL的白血病克隆演化模式,揭示了克隆演化过程中RNA结合蛋白MSI2通过调控癌基因MYC表达诱导化疗耐药的分子机制。
两种白血病的进化模式,“克隆转移”和“克隆漂移”被揭示。配对Dx_Rel T-ALL样本的靶向单细胞DNA测序进一步证实了两种不同克隆进化模式的存在,揭示了动态转录变异可能导致突变静态克隆进化为耐药克隆。对常见富集漂移基因特征的分析显示,在复发时持续性TCR克隆型中,RNA结合蛋白MSI2的表达显著上调。综合体外和体内功能研究表明,MSI2通过转录后调控MYC促进T-ALL的增殖和化疗耐药,确定MSI2是T-ALL的信息生物标志物和新的治疗靶点。
研究背景
相较于正常细胞,肿瘤细胞能够更快增殖与存活,因此,血液系统恶性肿瘤的发展被也认为是“自然选择”的结果。然而,肿瘤细胞是否存在相似的进化模式?这个问题是困扰科学家多年的难题。单细胞测序(scRNA-seq)的发展,使得人们有机会从更精细的层面(单细胞的基因组水平)来探讨肿瘤细胞的演化范式。近期,在实体瘤中的scRNA-seq解释了肿瘤免疫微环境中肿瘤细胞与T细胞的相互作用模式,也进一步了解了癌症进化/转移和肿瘤浸润免疫动力学之间关系。然而,T-ALL免疫调节环境的组成及其在T-ALL化疗期间对白血病增殖的支持作用尚未阐明。
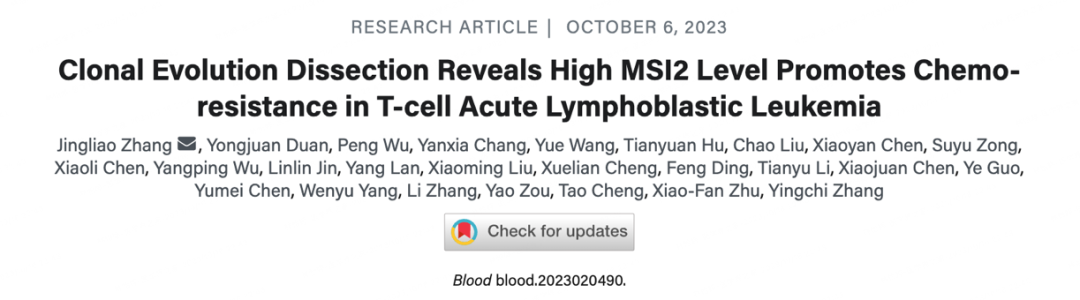
本研究创新性结合scRNA-seq与scTCR-seq,旨在使用tapstri平台来描绘T-ALL异质性、克隆性和非白血病T细胞在配对的初诊-复发(Dx-Rel)患者中的特征
研究方法
该研究完成了5对初诊-复发(Dx-Rel)配对的T-ALL患儿CD7+骨髓单个核细胞单细胞转录组及T细胞抗原受体测序,结合单细胞基因靶向测序验证,揭示复发T-ALL白血病存在2种类型的克隆演化模式:即主克隆发生改变的克隆“更替(Shift)”和同一主克隆持续存在但转录特征改变的克隆“漂移(Drift)”。
研究结果
本研究利用单细胞多组学分析的研究提供了T-ALL从诊断到复发的克隆结构演变的快照。多维证据表明,在白血病进展中“克隆转移”和“克隆漂移”共存,拓宽了目前对肿瘤内异质性情况下克隆进化的理解。对漂移T-ALL克隆的系统分析已经提供了令人信服的证据,证明静态亚克隆与白血病进展到化疗-耐药之间存在潜在的特征相关性(图1)。
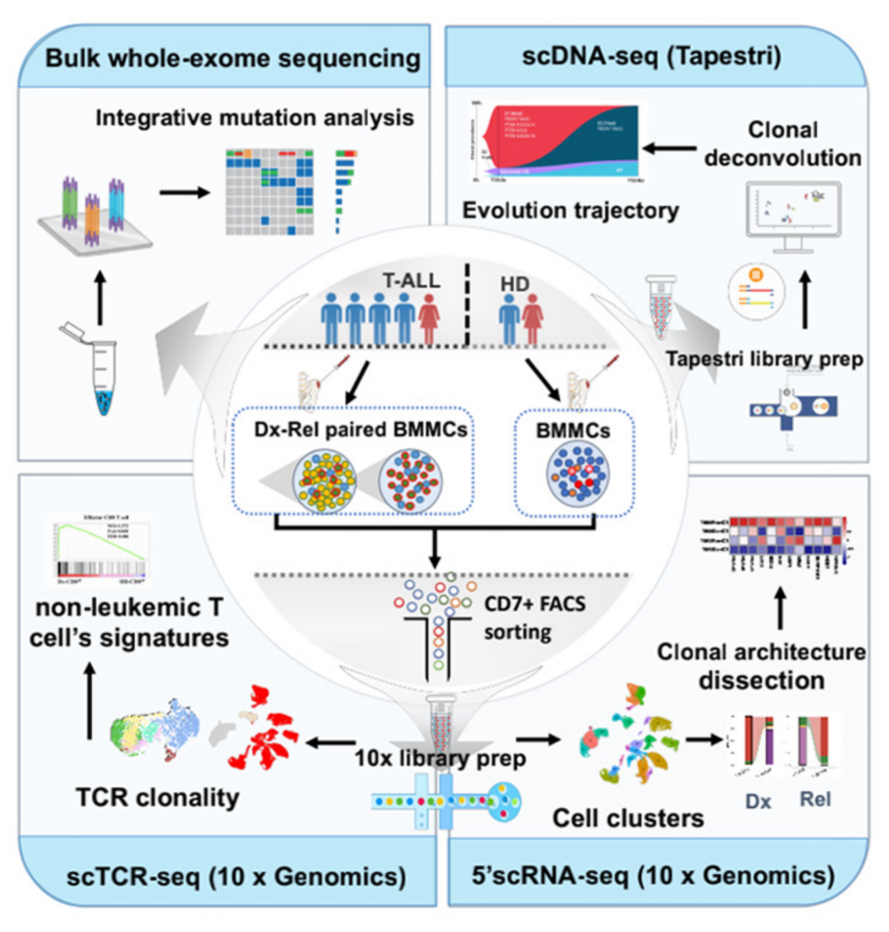
图1
通过解析复发白血病主克隆特征并结合分子生物学实验,该研究发现并证实了MSI2通过转录后调控稳定MYC mRNA及蛋白水平表达。进一步队列研究发现,MSI2高表达与化疗耐药及化疗后偏高水平的微小残留病密切相关。推测化疗过程中MSI2不断上调,会进一步提高包括MYC在内的癌基因蛋白水平表达,导致白血病细胞抗凋亡机制激活和化疗耐药,进而引起白血病化疗缓解后复发。
体外药理模型和小鼠体内实验表明,MSI2功能抑制剂(Ro 08-2750)与T-ALL诱导及巩固化疗中重要的细胞毒药物柔红霉素和阿糖胞苷具有显著的协同作用,Ro 08-2750联合化疗药物,能够延缓白血病细胞的体内扩增并显著延长白血病模型小鼠生存时间,该发现为儿童T-ALL靶向治疗联合化疗克服耐药及复发提供了新思路(图2)。
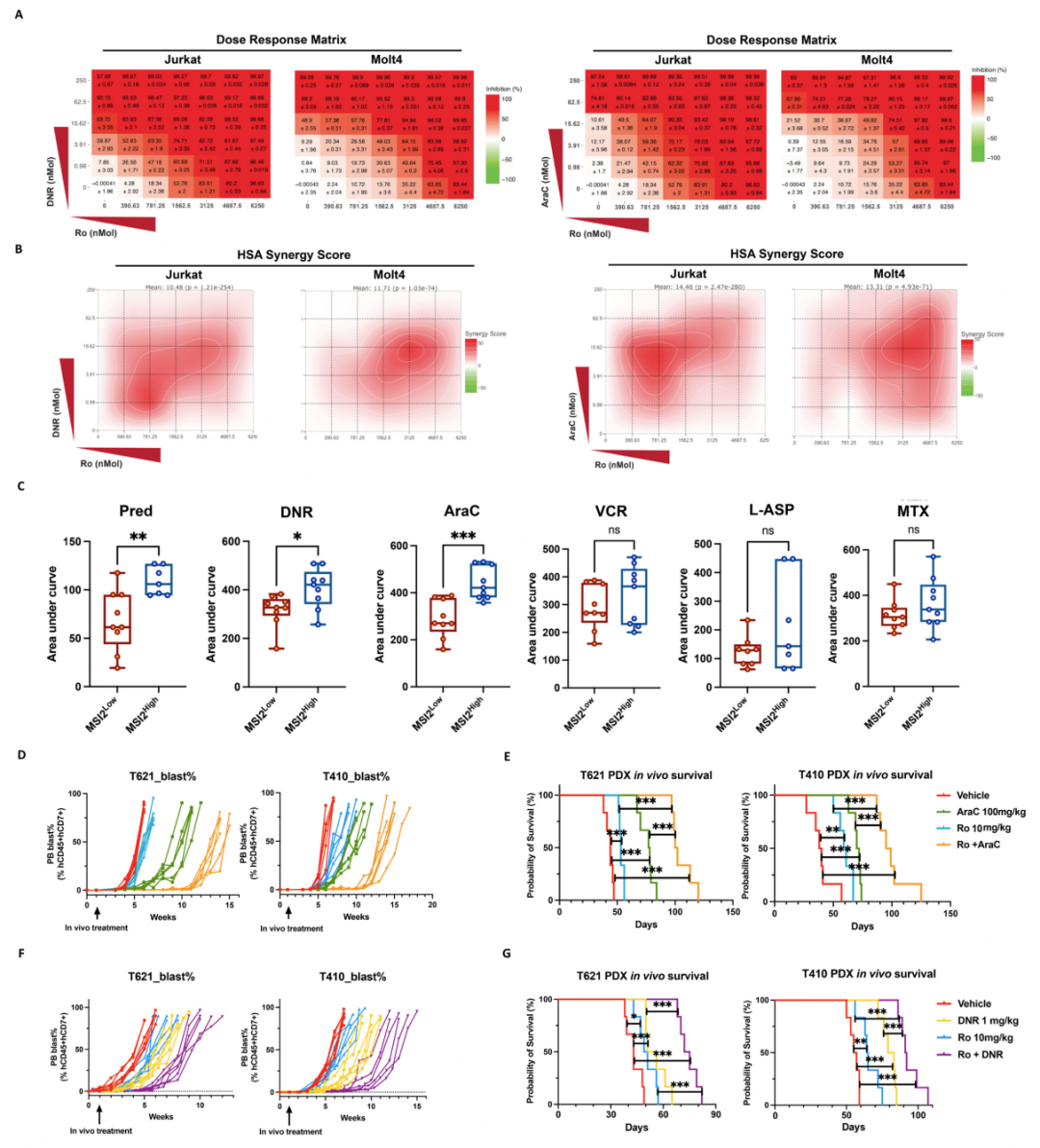
图2
讨论
在本研究中,作者同时进行scRNA-seq和scTCR-seq,以准确分辨出T-ALL样本中的白血病细胞和非白血病T细胞。通过这种方式,作者配合单细胞遗传谱分析Dx-Rel的T-ALL样本,从而确证了两种不同克隆进化模式的存在。这两种模式分别对应于治疗压力下出现的“动态”与“稳定”白血病克隆类别。
“克隆转移”的进化模式,特点是优势克隆群体的波动变化以及敏感亚克隆的消退。在这一模式中,那些最初被忽略、但具有耐药性的亚克隆在细胞毒性化疗过程中将被选择性地富集。另一种被称作“克隆漂移”的进化模式,是通过保持一种突变静态状态的方式,在持续的亚克隆群体中产生转录组的显著变异,从而达到免疫适应。
以往的研究强调,转录组突变数量的增加与抗癌疗法发生耐药性及癌症复发的相关。目前已有许多研究已经采用配对的Dx-Rel样本进行广泛研究,旨在预测与药物敏感性相关的分子生物标志。除对基因克隆进行选择外,作者也描绘出了一种进化模型,该模型显示了在化疗期间表型均质群体中的存在显著的表观遗传和转录进化趋势,这些进展与前述的进化模式相结合,可从多维视角对于解析耐药决定因素的重要性。
另外,白血病中的MSI2作为肿瘤蛋白,已被报道能调控一系列下游靶点,例如IKZF2、HOXA9、MYC和PTEN。在一系列研究中发现MSI2的高表达是与AML和ALL患者发生较差的临床结果相关的重要因素。事实上,作者从两个独立的T-ALL队列中得知,MSI2的高表达与化疗后仍无法完全消除的白血病细胞直接相关。然而,MSI2高表达患者未必与长期疗效相关。
本研究进一步确认,抑制MSI2可以协同提高T-ALL细胞对化疗的敏感性,并延缓白血病的发展,由此可见,MSI2可能是复发/难以治愈的T-ALL的重要预后预测因子和潜在的分子治疗靶点。在未来,我们希望以单细胞多组学分析方法,提供一个展示T-ALL从诊断到复发克隆结构演变的全面视角,深化对于肿瘤内克隆演化异质性环境的理解,并为解决耐药性问题提供新的思路与目标。
参考文献
Pui, C.H., et al., Clinical impact of minimal residual disease in children with different subtypes of acute lymphoblastic leukemia treated with Response-Adapted therapy. Leukemia, 2017. 31(2): p. 333-339.
Liu, Y., et al., The genomic landscape of pediatric and young adult T-lineage acute lymphoblastic leukemia. Nat Genet, 2017. 49(8): p. 1211-1218.
-
Teachey, D.T. and C.H. Pui, Comparative features and outcomes between paediatric T-cell and B-cell acute lymphoblastic leukaemia. Lancet Oncol, 2019. 20(3): p. e142-e154.

杭州艾沐蒽生物科技有限公司成立于2016年,是国际前沿的专注于免疫驱动医学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组基因高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子(纳斯达克代码:GTH)使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®肿瘤早筛、单细胞测序、TCR-T和抗体发现等平台管线。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。

