¬† дљЬиАЕпЉЪKroopa Joshi ,Martina Milighetti and Benjamin
вАЬ
Abstracts
/¬† жСШи¶Б
T зїЖиГЮеПЧдљУ (TCR) жµЛеЇПеЈ≤жИРдЄЇеИЖжЮРеЃњдЄї-иВњзШ§зЫЄдЇТдљЬвљ§зЪДвЉАй°єеЉЇвЉ§жЦ∞жКАжЬѓгАВ
NextGen жµЛеЇПжКАжЬѓзЪДињЫж≠•пЉМеК†дЄКеЉЇвЉ§зЪДжЦ∞еЮЛвљ£зЙ©дњ°жБѓе≠¶вЉѓеЕЈпЉМеПѓдї•еѓєиґКжЭ•иґКе§ЪзЪДеРДзІНеЃЮдљУзЩМжВ£иАЕзЪДиВњзШ§еТМвЊОжґ≤ж†ЈжЬђињЫвЊПеЃЪйЗПеТМеПѓйЗНе§НзЪДи°®еЊБгАВ
еЬ®ињЩзѓЗзїЉињ∞дЄ≠пЉМжИСдїђе∞ЖиАГиЩСе¶ВдљХдїОињЩдЇЫTCRеЇПеИЧдЄ≠жПРеПЦеЗЇзїЉеРИжМЗж†ЗпЉИиѓЄе¶ВTзїЖиГЮеЕЛйЪЖжАІеТМе§Ъж†ЈжАІпЉЙпЉМеєґзФ®дЇОжЈ±еЕ•дЇЖиІ£еЕНзЦЂж£АжЯ•зВєйШїжЦ≠зЪДдљЬзФ®жЬЇеИґгАВж≠§е§ЦпЉМжИСдїђињШжОҐиЃ®дЇЖTCRеЕ±дЇЂеЇПеИЧеИЖжЮРе¶ВдљХиГљеЄЃеК©еЃЪдєЙжКЧиВњзШ§еЕНзЦЂеПНеЇФзЪДз©ЇйЧіеТМжЧґйЧідЄКзЪДеЉВиі®жАІгАВ
жЬАеРОпЉМжИСдїђжАїзїУе¶ВдљХеИЖжЮРTCRзЪДеЇПеИЧеТМзїУжЮДгАВжЧ†иЃЇжШѓеНХдЄ™TCRињШжШѓдЄАз≥їеИЧзЫЄеЕ≥зЪДTCRжХ∞жНЃйЫЖпЉМйГљеПѓдї•зФ®жЭ•ж≥®йЗКжКЧеОЯзЙєеЉВжАІпЉМињЩеѓєеЉАеПСдЄ™жАІеМЦзЪДзїЖиГЮеЕНзЦЂзЦЧж≥ХеЕЈжЬЙйЗНи¶БжДПдєЙгАВ
вАЬ
Content
/¬† ж≠£жЦЗ
гАРиГМжЩѓдїЛзїНгАС
TзїЖиГЮеПЧдљУ ( TCR ) жµЛеЇПжШѓдЄАзІНеПѓдї•и°®еЊБжКЧиВњзШ§еЕНзЦЂеПНеЇФзЪДжЈ±еЇ¶гАБеЉЇеЇ¶еТМеК®жАБзЫСжµЛзЪДеЉЇжЬЙеКЫзЪДеЈ•еЕЈгАВ
 
дЇМдї£ (NextGen) жµЛеЇПжКАжЬѓеТМзЫЄеЕ≥вљ£зЙ©дњ°жБѓе≠¶жµБз®ЛзЪДињЫж≠•жШЊзЭАжПРвЊЉдЇЖTCR еЇУз†Фз©ґзЪДзБµжХПеЇ¶гАБеЗЖз°ЃжАІеТМеЃЪйЗПйЩРпЉМдїОвљљдЇІвљ£дЇЖвЉ§йЗПзЪДеЗЇзЙИзЙ©еТМзЫЄеЕ≥жХ∞жНЃйЫЖгАВ
 
зДґвљљпЉМеЬ®дїОTCRеЇУзЪДйЭЩжАБењЂзЕІдЄ≠жО®жЦ≠еК®жАБеТМжКЧеОЯзЙєеЉВжАІжЦєйЭҐдїНзДґе≠ШеЬ®йЗНе§ІзЪДиЃ°зЃЧжМСжИШгАВ
 
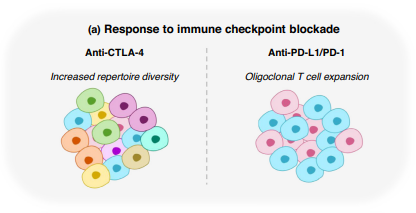
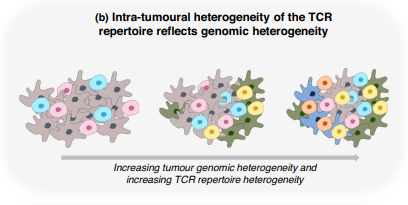
еЬ®ињЩвЊ•жИСдїђеЫЮй°ЊдЇЖеЇФвљ§ TCR еЇУеИЖжЮРжЭ•иЈЯиЄ™еЃњдЄїеѓєеЕНзЦЂж≤їзЦЧж£АжЯ•зВєйШїжЦ≠зЪДеЕНзЦЂеПНеЇФжЦєйЭҐзЪДињЫе±ХгАВеЬ®дЄНжЦ≠еПШеМЦзЪДиВњзШ§еЊЃзОѓеҐГдЄ≠иЈЯиЄ™еПНеЇФзЪДжЉФеПШеТМеЉВиі®жАІпЉМеєґжП≠з§ЇTзїЖиГЮжКЧеОЯзЙєеЉВжАІгАВ
TCRжµЛеЇПеИЖжЮРжЬ™жЭ•жЦєеРС
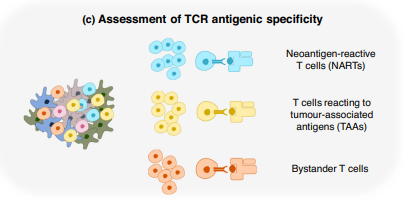
е∞љзЃ°ињЩдЇЫз†Фз©ґе∞Ж TCR еЇУжµЛеЇПдЄОиѓЖеИЂвљђж†ЗжКЧеОЯзЪДеКЯиГљзЫЄзїУеРИпЉМдљЖйАЪињЗеКЯиГљвљЕж≥Хеѓє TCR ињЫвЊПж≥®йЗКпЉМдїНзДґжЮБеЕЈжМСжИШжАІгАБеК≥еК®еЉЇеЇ¶вЉ§дЄФжИРжЬђвЊЉпЉМйЩРеИґдЇЖеЕґеЬ®е∞СжХ∞иµДвЊ¶зЙєеИЂеЕЕвЊЬзЪДз†Фз©ґдЄ≠вЉЉдєЛе§ЦзЪДдЄіеЇКз†Фз©ґдЄ≠зЪДеЇФвљ§гАВ
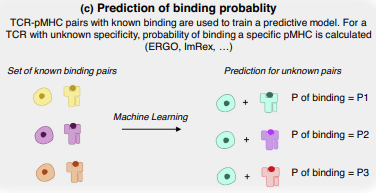
еЫ†ж≠§пЉМвЉИдїђеѓєдїЕдїОеЇПеИЧйҐДжµЛеНХдЄ™ TCR зЪДиВљ MHC (pMHC) жКЧеОЯзЙєеЉВжАІдЇІвљ£дЇЖжµУеОЪзЪДеЕіиґ£пЉМињЩжШѓвЉАй°єжЮБеЕЈжМСжИШжАІзЪДиЃ°зЃЧжМСжИШгАВ
вЉПй°єз†Фз©ґ[25,31,32]и°®жШОпЉМзїУеРИзЫЄеРМи°®дљНзЪД TCR жШЊвљ∞еЗЇдњЭеЃИзЪДеЇПеИЧеЯЇеЇПпЉМе∞§еЕґжШѓеЬ® CDR3 дЄ≠пЉМеН≥дЄОиВљи°®дљН嚥жИРжЬАвЉіж≥ЫжО•иІ¶зЪД TCR еМЇеЯЯ[33,34]гАВ
жИСдїђеТМеЕґдїЦвЉИеЈ≤зїПдљњвљ§еРДзІНеЇПеИЧзЫЄдЉЉжАІжМЗж†ЗжЭ•еЉАеПС TCR иБЪз±їзЃЧж≥ХпЉМдї•жЈ±вЉКдЇЖиІ£ TCR зЪДжКЧеОЯзЙєеЉВжАІ[35вАТ38]гАВвЉАжЧ¶еЈ≤зЯ•з∞ЗдЄ≠жЯРдЇЫжИРеСШзЪДжКЧеОЯзЙєеЉВжАІпЉМињЩжШѓвЉАзІНиѓЖеИЂеЇУдЄ≠зЫЄеЕ≥еЇПеИЧзЪДжЬЙжХИвљЕж≥ХпЉИеЫЊ3bпЉЙгАВдЊЛе¶ВпЉМиБЪз±їзЃЧж≥Х GLIPH2 жЬАињСеЈ≤襀⚧дЇОеЬ®дЄ§дЄ™зЛђвљізЪД NSCLC жХ∞жНЃйЫЖдЄ≠еѓїжЙЊ TCR зЙєеЉВжАІзїДпЉМеєґзїУеРИеЃЮй™МжАІжКЧеОЯеПСзО∞иГље§ЯиѓЖеИЂеѓєиВњзШ§жКЧеОЯиµЈеПНеЇФзЪД T зїЖиГЮ[39]гАВ
зЉЦз†БеПѓвљ§ TCR жКЧеОЯеѓєеЇПеИЧдњ°жБѓзЪДжЫіе§НжЭВзЪДжЬЇеЩ®е≠¶дє†вљЕж≥ХдєЯеПѓвљ§дЇОйҐДжµЛ TCR зЙєеЉВжАІпЉИеЫЊ3cпЉЙ [ 25,31,40,41,42,43 ]гАВвЉ§е§ЪжХ∞еПѓвљ§зЪДзЃЧж≥ХйГљйЬАи¶БеѓєзО∞жЬЙжХ∞жНЃйЫЖињЫвЊПйҐДжµЛиЃ≠зїГпЉМдєЯе∞±жШѓиѓіпЉМйЬАи¶БвЉАзїДеЈ≤зЯ•еПѓиѓЖеИЂзЙєеЃЪи°®дљНзЪД TCRпЉМжЙНиГљз°ЃеЃЪжЦ∞зЪД TCR жШѓеР¶дЉЪдЄОеРМвЉАжКЧеОЯзїУеРИгАВзДґвљљпЉМжКЧеОЯзЙєеЉВжАІзЫЄеЕ≥еЇПеИЧеЊАеЊАжШѓжЬ™зЯ•зЪДпЉМдїОвљљйЩРеИґдЇЖињЩдЇЫзЪДеЃЮйЩЕеЇФвљ§вљЕж≥ХгАВ
дЄЇдЇЖеЕЛжЬНињЩвЉАжМСжИШпЉМе∞ЭиѓХеѓєеЇПеИЧдљњзФ®жЬЇеЩ®е≠¶дє†[44,45,46]зЃЧж≥ХйҐДжµЛжЬ™зЯ• TCR еТМжКЧеОЯи°®дљНзЪДзїУеРИж¶ВзОЗгАВеАЉеЊЧж≥®жДПзЪДжШѓпЉМдЄНеРМзЪДзЃЧж≥ХйЬАи¶БдЄНеРМзЪДиЊУвЉКпЉЪERGO еТМ ImRex еП™йЬАи¶Б CDR3b еТМиВљеЇПеИЧпЉЫGLIPH дЊЭиµЦдЇО CDR3b еЇПеИЧеТМ V еЯЇеЫ†зЪДдљњвљ§пЉЫељУдЄ§жЭ°йУЊйГљеМЕеРЂжЬЙеЕ≥дЄЙдЄ™ CDR еМЇеЯЯпЉИдї•еПК CDR2 еТМ CDR3 дєЛйЧізЪДзђђеЫЫдЄ™еМЇеЯЯпЉЙзЪДдњ°жБѓжЧґпЉМTCRdist жШЊвљ∞еЗЇжЬАдљ≥жАІиГљгАВ
зЫЄеПНпЉМеЯЇдЇОзїУжЮДзЪДеИЖз±їеЩ®еЯЇдЇОжХідЄ™е§НеРИдљУзЪДпЉИйҐДжµЛзЪДпЉЙжЮДи±°зЪДе±ЮжАІињЫвЊПйҐДжµЛпЉМињЩе∞ЖеПЦеЖ≥дЇОдЄ§дЄ™ TCR йУЊзЪДеЇПеИЧеТМзїУжЮДпЉИеМЕжЛђ CDR зОѓпЉМињШеМЕжЛђж°ЖжЮґзЙєеЊБз°ЃеЃЪеЊ™зОѓеЃЪдљНпЉЙгАВзФ±дЇОйЕНеѓєзЪД ab йУЊеѓєдЇОзїУжЮДвљЕж≥ХжШѓењЕйЬАзЪДпЉМеЫ†ж≠§еЇПеИЧеИЖз±їеЩ®жЫіеЃєжШУйАВвљ§дЇОдЄНжПРдЊЫйЕНеѓєдњ°жБѓзЪД TCR seq дњ°жБѓгАВ
зДґвљљпЉМйЬАи¶БињЫвЉАж≠•зЪДвЉѓдљЬжЭ•е∞ЖињЩдЇЫиЃ°зЃЧвљЕж≥ХзЪДеЗЖз°ЃжАІжПРвЊЉеИ∞еЃГдїђеѓєиВњзШ§еЕНзЦЂе≠¶еЕЈжЬЙзЫіжО•дїЈеАЉзЪДз®ЛеЇ¶гАВ

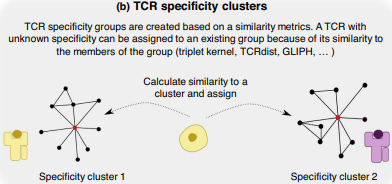
еЫЊ3пЉЪTCR-жКЧеОЯйЕНеѓєзЪДиЃ°зЃЧвљЕж≥Х
¬†(a) иБЪз±їзЃЧж≥ХгАВиБЪз±їзЃЧж≥ХеЬ®вЉАдЄ™еЇПеИЧдЄ≠жЙЊеИ∞еЇПеИЧзЫЄдЉЉзЪД TCRпЉМеЫ†ж≠§еПѓиГљеЕЈжЬЙжКЧеОЯзЙєеЉВжАІгАВж†єжНЃеЃГдїђзЪДеЇПеИЧиЃ°зЃЧжѓПеѓє TCR дєЛйЧізЪДиЈЭз¶їеЇ¶йЗПпЉМе¶ВжЮЬиЈЭз¶їдљОдЇОжЯРдЄ™йШИеАЉпЉМеИЩе∞ЖеЃГдїђеИЖйЕНеИ∞еРМвЉАйЫЖзЊ§
¬†(b) TCR зЙєеЉВжАІз∞ЗгАВиБЪз±їзЃЧж≥ХзЪДжЙ©е±ХжШѓдЄЇжѓПдЄ™з∞ЗеИЖйЕНзЙєеЉВжАІпЉМеН≥з∞ЗдЄ≠зЪД TCR еЈ≤зЯ•еПѓиѓЖеИЂзЪДиВљжКЧеОЯгАВзДґеРОеПѓдї•ж†єжНЃдїОжѓПдЄ™з∞ЗзЪДжИРеСШиЃ°зЃЧзЪДиЈЭз¶їе∞ЖеЕЈжЬЙжЬ™зЯ•зЙєеЉВжАІзЪДжЦ∞ TCR еИЖйЕНзїЩзЙєеЉВжАІз∞З¬†
(c) зїУеРИж¶ВзОЗзЪДйҐДжµЛгАВеИЖз±їеЩ®еЬ®вЉАзїДеЈ≤зЯ•зЪД TCR-жКЧеОЯеѓєдї•еПКвЉАзїДеЈ≤зЯ•зЪДвЊЃзїУеРИзЙ©дЄКињЫвЊПиЃ≠зїГгАВеѓєдЇОжЦ∞зЪД TCR-жКЧеОЯеѓєпЉМеИЖз±їеЩ®е∞ЖиЊУеЗЇ TCR зїУеРИзЙєеЃЪиВљзЪДж¶ВзОЗ
вАЬ
Conclusions
/¬† жАїзїУ
TCRжµЛеЇПж≠£вљЗзЫКжИРдЄЇзЩМзЧЗеЕНзЦЂе≠¶еЃґж≠¶еЩ®еЇУдЄ≠дЄНеПѓжИЦзЉЇзЪДвЉАйГ®еИЖгАВ
йЪПзЭАжµЛеЇПжИРжЬђињЫвЉАж≠•дЄЛйЩНпЉМжЦєж°ИеПШеЊЧжЫіеК†ж†ЗеЗЖеМЦпЉМиЃ°зЃЧвЉѓеЕЈжЫіеК†еПѓйЭ†еТМжЦєдЊњдљњзФ®пЉМTCRжµЛеЇПе∞ЖиґКжЭ•иґКе§ЪеЬ∞еЬ®дЄіеЇКдЄКеЊЧеИ∞еЇФзФ®пЉМвљ§дЇОзЫСжµЛзЦЊзЧЕе§НеПСеТМињЫе±ХпЉМиѓДдЉ∞еѓєеЕ®вЊЭж≤їзЦЧзЪДеПНеЇФеТМжВ£иАЕеИЖе±ВгАВ
зДґиАМпЉМдєЯиЃЄTCRеИЖжЮРжЬАеЉЇе§ІзЪДељ±еУНе∞ЖжЭ•иЗ™дЇЇеЈ•жЩЇиГљжЬАжЦ∞ињЫе±ХзЪДеЇФвљ§пЉМињЩжЬАзїИе∞ЖеЕБиЃЄеЬ®жКЧиВњзШ§еЕНзЦЂеПНеЇФзЪДжКЧеОЯдЄОеЕНзЦЂзїДеЯЇеЫ†ињЫи°Мж≥®йЗКпЉМињЩе∞ЖеѓєеЃЮдљУиВњзШ§жВ£иАЕзЪДзїЖиГЮзЦЧж≥ХзЪДеЉАеПСеЕЈжЬЙйЗНи¶БзЪДдЄіеЇКжДПдєЙгАВ
еПВиАГжЦЗзМЃпЉИзХ•пЉЙ
еЕ≥дЇОиЙЊж≤РиТљ
жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄзФ±зЊОеЫљиКЭеК†еУ•е§Іе≠¶зІСз†ФеЫҐйШЯеЫЮеЫљеИЫеКЮпЉМжШѓдЄАеЃґдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВ
¬†иЙЊж≤РиТљзЂЩеЬ®йАВеЇФжАІеЕНзЦЂз≥їзїЯз†Фз©ґзЪДеЙНж≤њпЉМиЗ™дЄїз†ФеПСзЪДеЕНзЦЂеМїе≠¶еє≥еП∞еПѓжП≠з§ЇеТМзњїиѓСйАВеЇФжАІеЕНзЦЂз≥їзїЯзЪДйБЧдЉ†еѓЖз†БпЉМеєґиГљеЇФзФ®дЇОзЩМзЧЗгАБиЗ™иЇЂеЕНзЦЂжАІзЦЊзЧЕгАБдЉ†жЯУжАІзЦЊзЧЕз≠ЙеЕНзЦЂдїЛеѓЉжАІзЦЊзЧЕзЪДиѓКжЦ≠гАБзЫСжµЛеТМж≤їзЦЧдЄ≠гАВ

ImmunoDiagnostics | ImmunoMonitoring
еЕНзЦЂиѓКжЦ≠¬†|¬†еЕНзЦЂзЫСжОІ
дЄУж≥®дЇОеЕНзЦЂзїДйЂШйАЪйЗПжµЛеЇП

йХњжМЙеЕ≥ж≥®иЙЊж≤РиТљзФЯзЙ©
 ImmuHub | Seq-MRD | Seq-SHM 
Immun-Traq| Immun-Cheq
WebпЉЪwww.immuquad.com
EmailпЉЪContact@immuquad.com
TelпЉЪ0571-81061561
AddressпЉЪжЭ≠еЈЮеЄВдЄКеЯОеМЇзЯ≥ж°•иЈѓ196еПЈжµЩж±ЯзЬБеЖЬеИЫеЫ≠
4еПЈж•Љ1е±В
 
зВєеЗїйШЕиѓїеОЯжЦЗпЉМдЇЖиІ£жЫіе§ЪжЬЙеЕ≥ImmuHub¬Ѓ