еЕНзЦЂзЦЧж≥ХзЪДеЉАеПСдЄЇзЩМзЧЗж≤їзЦЧеЄ¶жЭ•йЭ©еСљжАІзЪДељ±еУНпЉМеЕґдЄ≠еГПжШѓжКЧPD-1гАБPD-L1жКЧдљУз≠ЙеЕНзЦЂж£АжЯ•зВєжКСеИґеЙВеЈ≤жИРдЄЇиЃЄе§ЪзЩМзЧЗзЪДдЄАзЇњзЦЧж≥ХпЉМзДґиАМиЗ≥дїКдїНжЬЙиЃЄе§ЪзЧЕжВ£еѓєж≠§з±їзЦЧж≥ХеєґдЄНдЇІзФЯеЇФз≠ФгАВ
ињСжЧ•пЉМеК†еЈЮе§Іе≠¶жіЫжЭЙзЯґеИЖж†°зРЉж£ЃзїЉеРИзЩМзЧЗдЄ≠ењГпЉИUCLA Jonsson Comprehensive Cancer Center¬†пЉЙзЪДдЄАдЄ™з†Фз©ґе∞ПзїДй¶Цжђ°з°ЃеЃЪеєґеИЖжЮРдЇЖеЕНзЦЂзїЖиГЮе¶ВдљХвАЬзЬЛиІБвАЭзЩМзїЖиГЮеєґдЇІзФЯзЫЄеЕ≥еПНеЇФпЉМињЩе∞ЖжЬЙеК©дЇОиІ£йЗКеЕНзЦЂж£АжЯ•зВєжКСеИґеЙВиГМеРОзЪДиАРиНѓжЬЇеИґпЉМеєґдЄЇдЄНеЇФз≠ФжВ£иАЕеЉАеПСзЫЄеѓєеЇФзЪДдЄ™дљУеМЦеЕНзЦЂзЩМзЧЗзЦЧж≥ХгАВз†Фз©ґиЃЇжЦЗвАЬNeoantigen-targeted CD8 T cell responses with PD-1 blockade therapy+вАЭеПСи°®еЬ®зЯ•еРНжЬЯеИКгАКNatureгАЛдЄКгАВ

жЦ∞жКЧеОЯпЉИneoantigensпЉЙжШѓжЇРиЗ™дЇЇз±їзЩљзїЖиГЮжКЧеОЯпЉИHLAsпЉЙеСИзО∞зЪДйЭЮеРМдєЙз™БеПШзЪДиВљпЉМеŴ襀жКЧиВњзШ§TзїЖиГЮиѓЖеИЂгАВе§ІйЗПзЪДHLAз≠ЙдљНеЯЇеЫ†е§Ъж†ЈжАІеТМжЬЙйЩРзЪДдЄіеЇКж†ЈжЬђйЩРеИґдЇЖеѓєжВ£иАЕж≤їзЦЧињЗз®ЛдЄ≠жЦ∞жКЧеОЯйЭґеРСTзїЖиГЮеПНеЇФзЪДз†Фз©ґгАВ
 
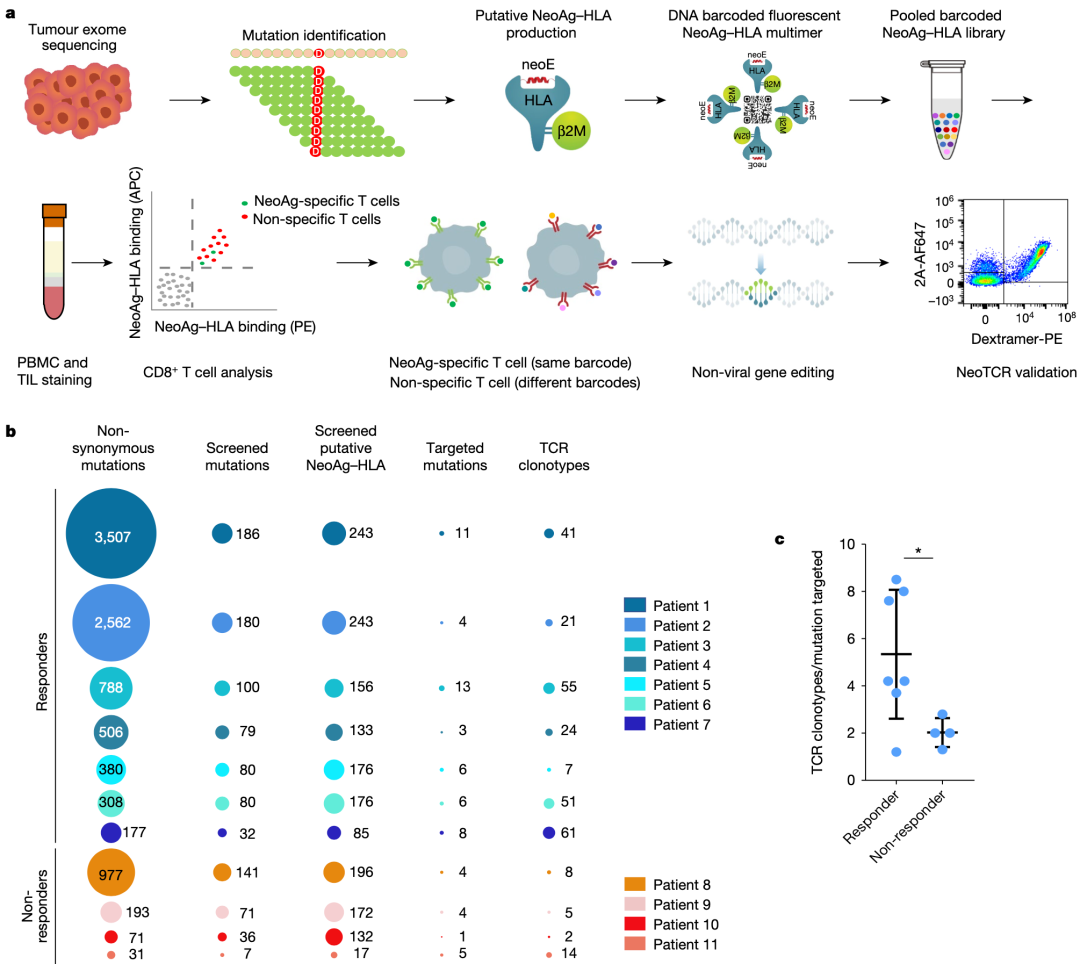
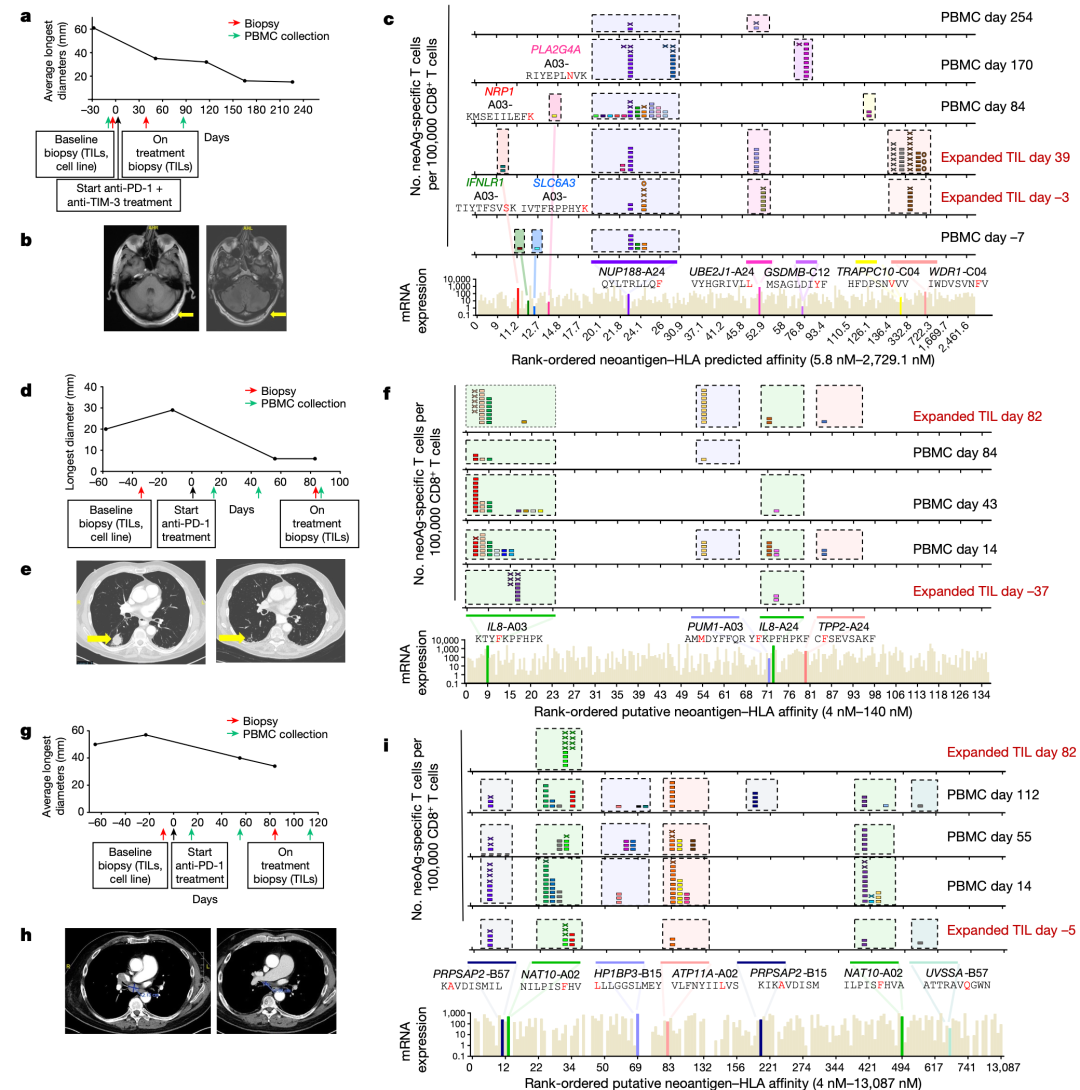
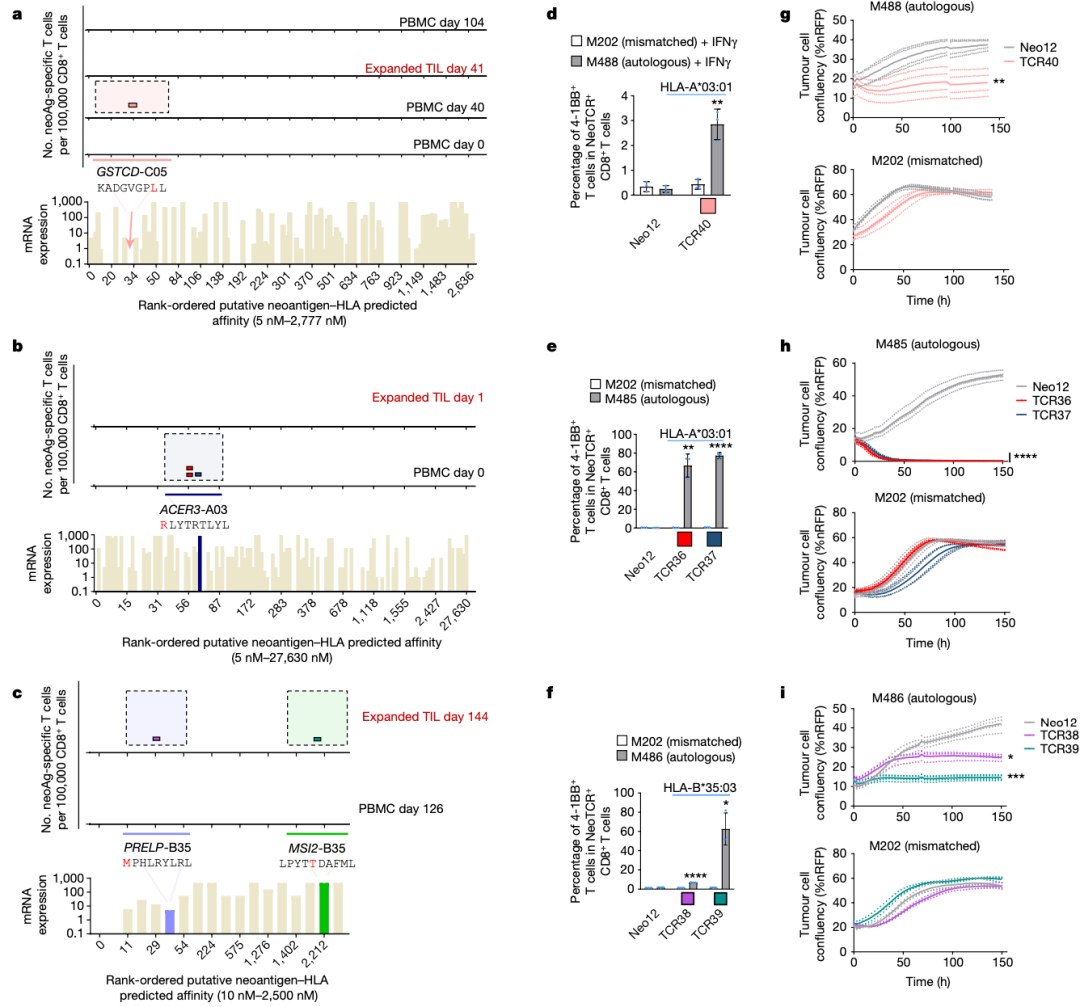
з†Фз©ґзїУжЮЬи°®жШОпЉМиВњзШ§зЪДжЦ∞жКЧеОЯзЙєеЉВжАІеЕНзЦЂеПНеЇФйТИеѓєйїСзі†зШ§дЄ≠жЬЙйЩРжХ∞йЗПзЪДеЕНзЦЂжШЊжАІз™БеПШ(иМГеЫі3еИ∞13)пЉМдЄОиВњзШ§з™БеПШиіЯиНЈеТМеЕНзЦЂж≤їзЦЧзЪДдЄіеЇКеПНеЇФжЧ†еЕ≥гАВжЧ†иЃЇе¶ВдљХпЉМеЬ®еѓєжКЧPD-1жЬЙйХњжЬЯдЄіеЇКеПНеЇФзЪДжВ£иАЕдЄ≠пЉМжЦ∞жКЧеОЯзЙєеЉВжАІTзїЖиГЮеПНеЇФжШѓе§ЪеЕЛйЪЖзЪДпЉМйЪПзЭАжЧґйЧізЪДжО®зІїпЉМе§ЪдЄ™жЦ∞жКЧеОЯзЙєеЉВжАІTCRеЕЛйЪЖеЮЛ(иМГеЫі1еИ∞23)еПНе§НйТИеѓєзЫЄеРМзЪДз™БеПШпЉМеєґеЬ®и°Ажґ≤еТМиВњзШ§дЄ≠ж£АжµЛеИ∞гАВињЩдЇЫзїУжЮЬи°®жШОпЉМиЗ™зДґTзїЖиГЮеПНеЇФйАЪињЗйЭґеРСжХ∞йЗПйЭЮеЄЄжЬЙйЩРзЪДдЄНеРМTзїЖиГЮеЕЛйЪЖеЮЛз™БеПШжЭ•жЄЕйЩ§иВњзШ§пЉМеЕґдЄ≠дЄАдЇЫзїЖиГЮиѓЖеИЂдЄНеРМзЪДHLA-жЦ∞и°®дљНе§НеРИзЙ©пЉМеСИзО∞зЫЄеРМзЪДйЭЮеРМдєЙз™БеПШгАВжЧ†иЃЇе¶ВдљХпЉМз†Фз©ґиАЕдЄНиГљжОТйЩ§TзїЖиГЮйЭґеРСйЭЮз™БеПШзЪДиВњзШ§зЫЄеЕ≥жКЧеОЯ(е¶ВйїСзі†дљУеИЖеМЦжКЧеОЯ)еЬ®жХідљУжКЧиВњзШ§еПНеЇФдЄ≠зЪДдљЬзФ®гАВ
 
еПВиАГжЦЗзМЃпЉЪ
Puig-Saus C, Sennino B, Peng S, Wang CL, Pan Z, Yuen B, Purandare B, An D, Quach BB, Nguyen D, Xia H, Jilani S, Shao K, McHugh C, Greer J, Peabody P, Nayak S, Hoover J, Said S, Jacoby K, Dalmas O, Foy SP, Conroy A, Yi MC, Shieh C, Lu W, Heeringa K, Ma Y, Chizari S, Pilling MJ, Ting M, Tunuguntla R, Sandoval S, Moot R, Hunter T, Zhao S, Saco JD, Perez-Garcilazo I, Medina E, Vega-Crespo A, Baselga-Carretero I, Abril-Rodriguez G, Cherry G, Wong DJ, Hundal J, Chmielowski B, Speiser DE, Bethune MT, Bao XR, Gros A, Griffith OL, Griffith M, Heath JR, Franzusoff A, Mandl SJ, Ribas A. Neoantigen-targeted CD8+ T cell responses with PD-1 blockade therapy. Nature. 2023 Mar 8. doi: 10.1038/s41586-023-05787-1. Epub ahead of print. PMID: 36890230.
 
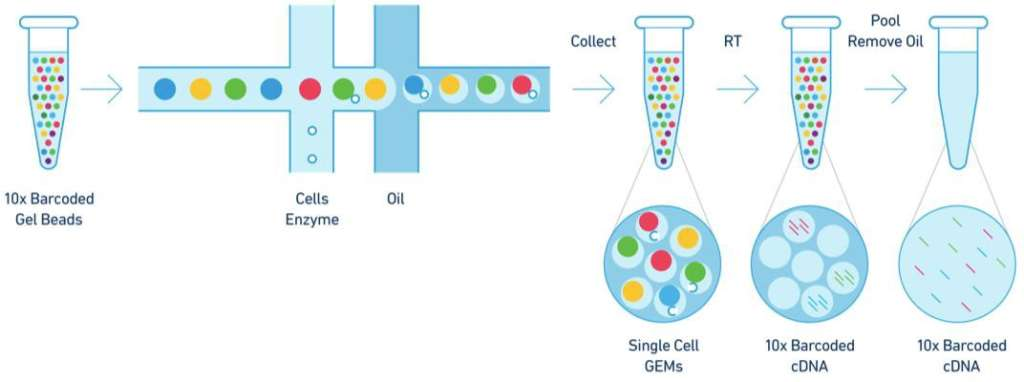
еЕ≥дЇО10X V(D)JеНХзїЖиГЮжµЛеЇП
 
 
10xеНХзїЖиГЮV(D)JжµЛеЇПжШѓеИ©зФ®8йАЪйБУзЪДеЊЃжµБдљУвАЬеПМеНБе≠ЧвАЭдЇ§еПЙз≥їзїЯе∞ЖеРЂBarcoded RT PrimersзЪДGel BeadsгАБзїЖиГЮеТМйЕґзЪДжЈЈеРИзЙ©гАБж≤єдЄЙиАЕзїУеРИ嚥жИРGEMsпЉМеЬ®GEMsдЄ≠пЉМеЗЭиГґзП†иЗ™еК®жЇґиІ£йЗКжФЊе§ІйЗПbarcodeеЇПеИЧпЉМеРМжЧґжѓПдЄ™зїЖиГЮи£ВиІ£йЗКжФЊеЗЇmRNAпЉМmRNAеЖНйАЖиљђељХдЇІзФЯеЄ¶жЬЙ10xbarcodeеТМUMIдњ°жБѓзЪДcDNAгАВж†ЗиЃ∞еРОзЪДcDNA襀еИЖжИР2дїљпЉМдЄАдїљдљњзФ®йТИеѓєTCR/BCRзЪДCеМЇеЈҐеЉПеЉХзЙ©жЙ©еҐЮпЉМдїОиАМеѓМйЫЖTзїЖиГЮжИЦBзїЖиГЮпЉМиОЈеЊЧTCR/BCRеЕ®йХњVDJеЇПеИЧпЉМеП¶дЄАдїљзЫіжО•жЮДеїЇеЯЇеЫ†и°®иЊЊзЪДжЦЗеЇУпЉМиОЈеПЦ5вАЩзЂѓеЯЇеЫ†и°®иЊЊзЪДжХ∞жНЃгАВжЬАеРОдљњзФ®IlluminaжµЛеЇПеє≥еП∞еѓєжЦЗеЇУињЫи°МжµЛеЇПж£АжµЛпЉМеН≥еПѓдЄАжђ°жАІиОЈеЊЧе§ІйЗПеНХзїЖиГЮзЪДеЯЇеЫ†и°®иЊЊеТМеЕНзЦЂзїДеЇУжХ∞жНЃпЉМдїОиАМеЃЮзО∞еЬ®еНХзїЖиГЮж∞іеє≥ињЫи°МеЕНзЦЂзїДеЇУжµЛеЇПзЪДзЫЃзЪДгАВ
 
еЕ≥дЇОImmuHub¬Ѓ
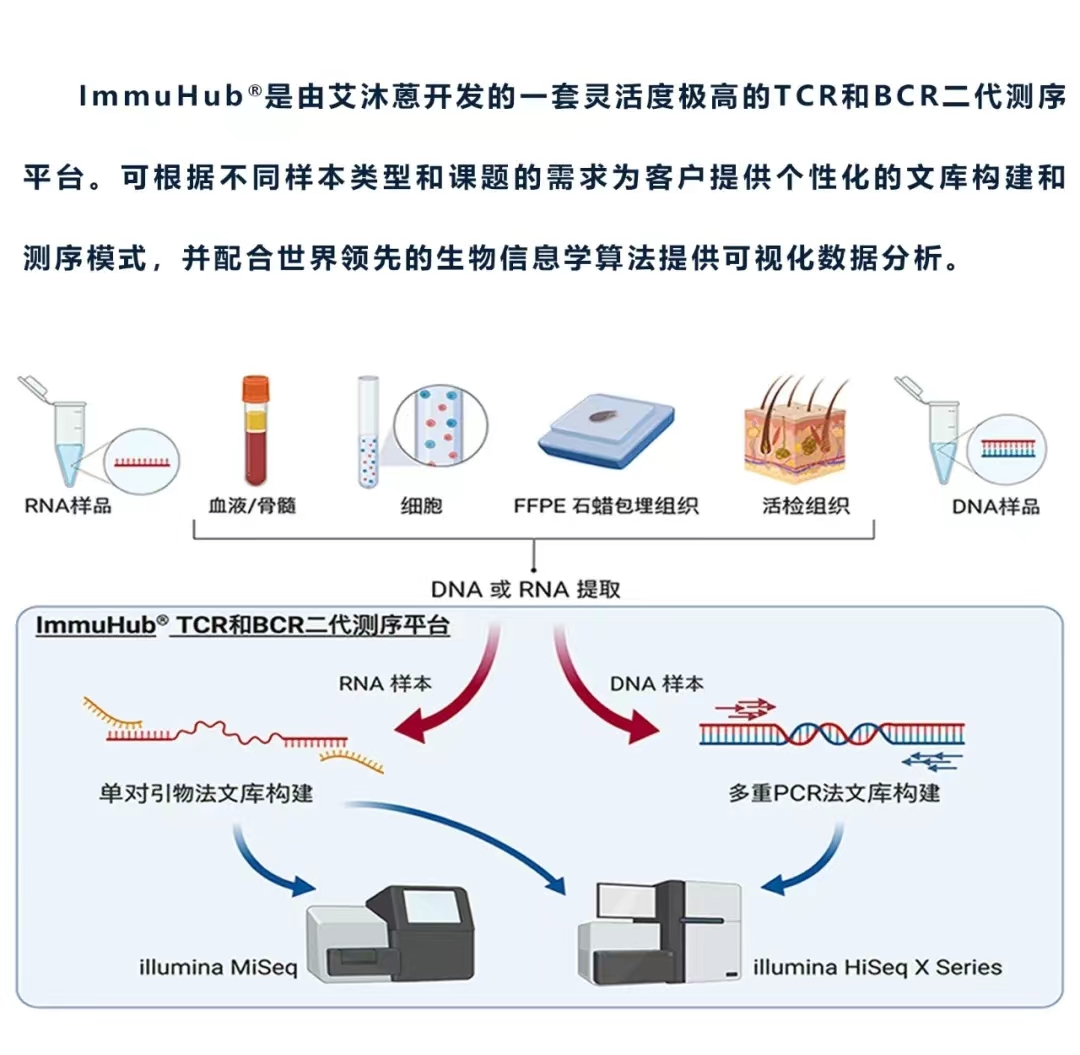
ImmuHub¬ЃжКАжЬѓеє≥еП∞жШѓеЯЇдЇОзђђдЇМдї£йЂШйАЪйЗПеЯЇеЫ†жµЛеЇПпЉИNGSпЉЙеє≥еП∞еИ©зФ®5’RACEжИЦе§ЪйЗНPCRжКАжЬѓпЉМдљњжИСдїђиГљзЫіжО•дїОеЯЇеЫ†зїДRNAжИЦDNAжЭ•жЙ©еҐЮTCR/BCRзЪДеЕ®йХњеЇПеИЧжИЦCDR3еМЇеЇПеИЧпЉМдїОиАМињЫи°МйЂШйАЪйЗПжµЛеЇПеТМжХ∞жНЃеИЖжЮРгАВжШѓиЙЊж≤РиТљеЉАеПСзЪДдЄАе•ЧзБµжіїеЇ¶жЮБйЂШзЪДTCR/BCRдЇМдї£жµЛеЇПеє≥еП∞гАВ
 
ImmuHub¬ЃжПРдЊЫдЇЖзЬЯж≠£жНХиОЈеЕНзЦЂз≥їзїЯжЙАйЬАи¶БзЪДжЈ±еЇ¶еТМеєњеЇ¶гАВTCR/BCRдљЬдЄЇT/BзїЖиГЮеЕЛйЪЖзЪДдЄАдЄ™зЛђзЙєжАІж†ЗиЃ∞пЉМиГље§ЯйЪПзЭАжЧґйЧізЪДеПШеМЦжЭ•иЈЯиЄ™TзїЖиГЮеТМBзїЖиГЮпЉМи°®еЊБеЕНзЦЂз≥їзїЯзЪДе§Ъж†ЈжАІпЉМеєґиѓДдЉ∞еПНеЇФзЦЊзЧЕеТМж≤їзЦЧзЪДеК®жАБжГЕеЖµпЉМе¶ВеЕНзЦЂзїДжµЛеЇПжПРдЊЫзЪДдЄАдЄ™жЬЙдїЈеАЉзЪДжМЗж†ЗжШѓеЕЛйЪЖжАІпЉМињЩжШѓдЄАзІНж£АжµЛеПЧдљУеЇПеИЧеЬ®зЊ§дљУдЄ≠еИЖеИЂеЭЗеМАз®ЛеЇ¶зЪДжЦєж≥ХпЉМеПѓдї•йЗПеМЦеЕНзЦЂз≥їзїЯеѓєдЄАзїДзЙєеЃЪжКЧеОЯзЪДйЫЖдЄ≠з®ЛеЇ¶гАВ
зВєеЗївАЭйШЕиѓїеОЯжЦЗвАЬпЉМдЇЖиІ£жЫіе§ЪжЬЙеЕ≥ImmuQuad¬Ѓ
 
 
жЭ≠еЈЮиЙЊж≤РиТљзФЯзЙ©зІСжКАжЬЙйЩРеЕђеПЄзФ±зЊОеЫљиКЭеК†еУ•е§Іе≠¶зІСз†ФеЫҐйШЯеЫЮеЫљеИЫеКЮпЉМжШѓдЄАеЃґдЄУж≥®дЇОйАЪињЗиІ£з†БйАВеЇФжАІеЕНзЦЂз≥їзїЯжЭ•жФєеПШзЦЊзЧЕзЪДиѓКжЦ≠еТМж≤їзЦЧпЉМеєґиЗіеКЫдЇОжО®ињЫеЕНзЦЂй©±еК®еМїе≠¶йҐЖеЯЯеПСе±ХзЪДеЫљеЃґйЂШжЦ∞жКАжЬѓдЉБдЄЪгАВиЙЊж≤РиТљзЂЩеЬ®йАВеЇФжАІеЕНзЦЂз≥їзїЯз†Фз©ґзЪДеЙНж≤њпЉМиЗ™дЄїз†ФеПСзЪДеЕНзЦЂеМїе≠¶еє≥еП∞еПѓжП≠з§ЇеТМзњїиѓСйАВеЇФжАІеЕНзЦЂз≥їзїЯзЪДйБЧдЉ†еѓЖз†БпЉМеєґиГљеЇФзФ®дЇОзЩМзЧЗгАБиЗ™иЇЂеЕНзЦЂжАІзЦЊзЧЕгАБдЉ†жЯУжАІзЦЊзЧЕз≠ЙеЕНзЦЂдїЛеѓЉжАІзЦЊзЧЕзЪДиѓКжЦ≠гАБзЫСжµЛеТМж≤їзЦЧдЄ≠гАВ
 
 

